中国农业大学生物学院博士研究生宋润杰、郭佩兰、任欣为该论文共同第一作者,李向东教授为通讯作者。中国农业大学刘佳利课题组、解放军总医院李席如主任、刘梅主任和张艳君主任等参与了该研究。

亮 点
2)敲降circCAPG显著抑制TNBC患者来源的类器官的生长。
3)circCAPG可翻译成一种CAPG-171aa多肽。
4)SLU7调节circCAPG的生物生成。
5)多肽CAPG-171aa可防止MEKK2泛素来促进肿瘤生长。
1、circleCAPG在TNBC样本中高表达具有临床生物标志物的潜能
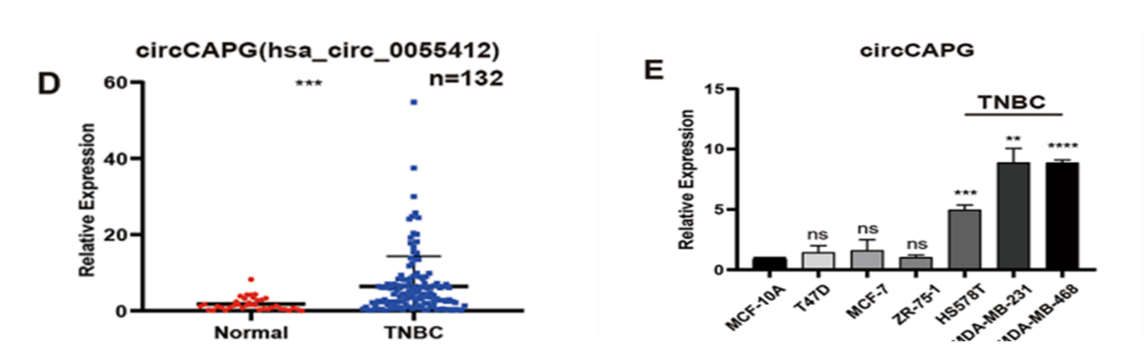 图1 circCAPG在TNBC病人组织和细胞系中表达上调
图1 circCAPG在TNBC病人组织和细胞系中表达上调
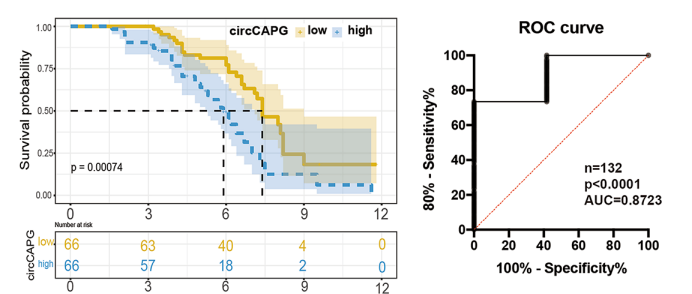 图2 KM生存分析和ROC分析
图2 KM生存分析和ROC分析
通过对132例TNBC患者进行长达10年的随访,Kaplan-Meier生存分析显示circCAPG高表达的TNBC患者10年总生存显着降低,受试者操作曲线ROC分析表明circCAPG有作为诊断标志物的潜力。
2、cricCAPG促进TNBC细胞的生长和迁移
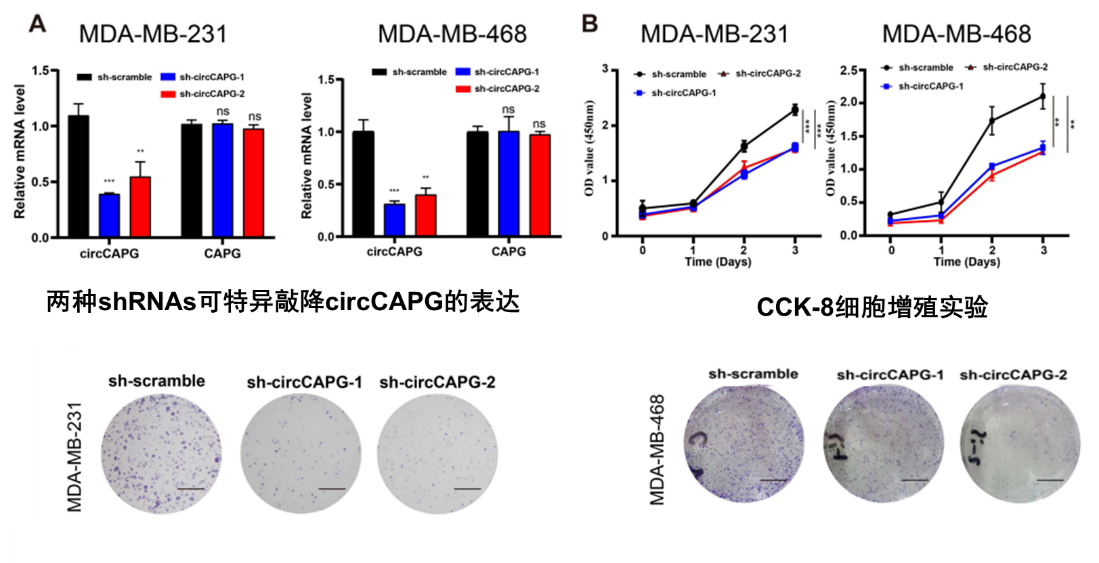
图3 敲降cricCAPG抑制TNBC细胞的生长
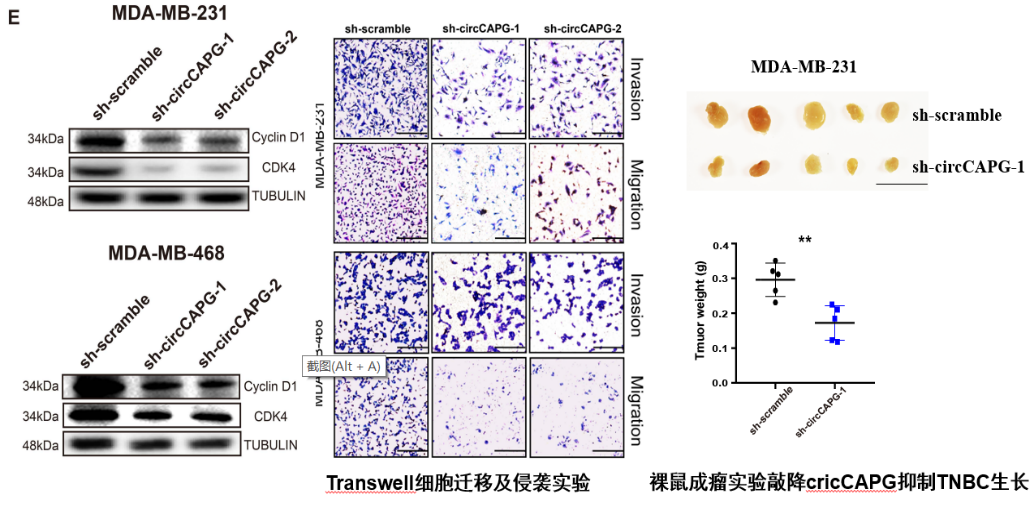
图4 敲降cricCAPG抑制了TNBC细胞侵袭迁移及周期进展
3、circCAPG能够翻译成一个新的多肽,该多肽促进TNBC恶性进展
研究发现了circCAPG编码一个未知多肽,新多肽CAPG-171aa而不是环状RNA-circCAPG促进TNBC恶性进展,抑制该多肽可降低TNBC的恶性程度。
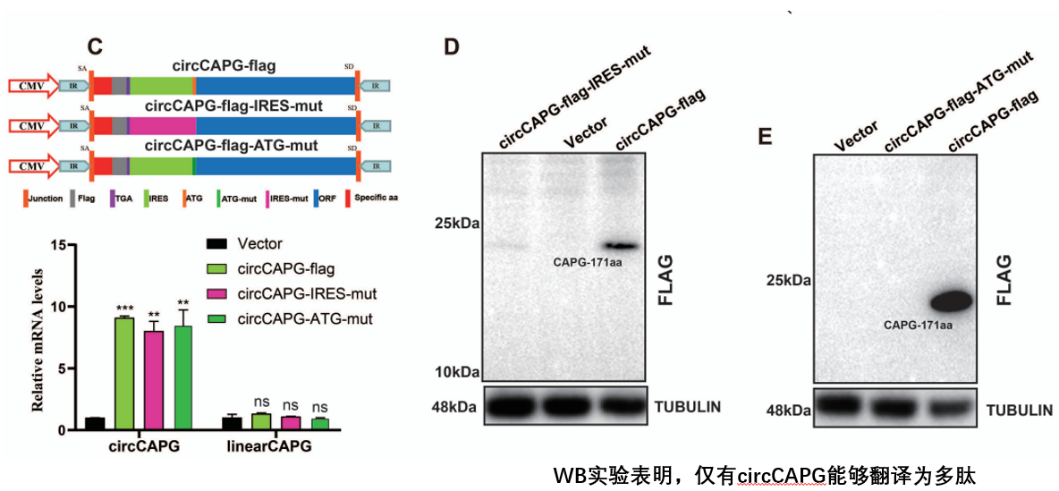 图5 circCAPG能够翻译成一个新的多肽
图5 circCAPG能够翻译成一个新的多肽
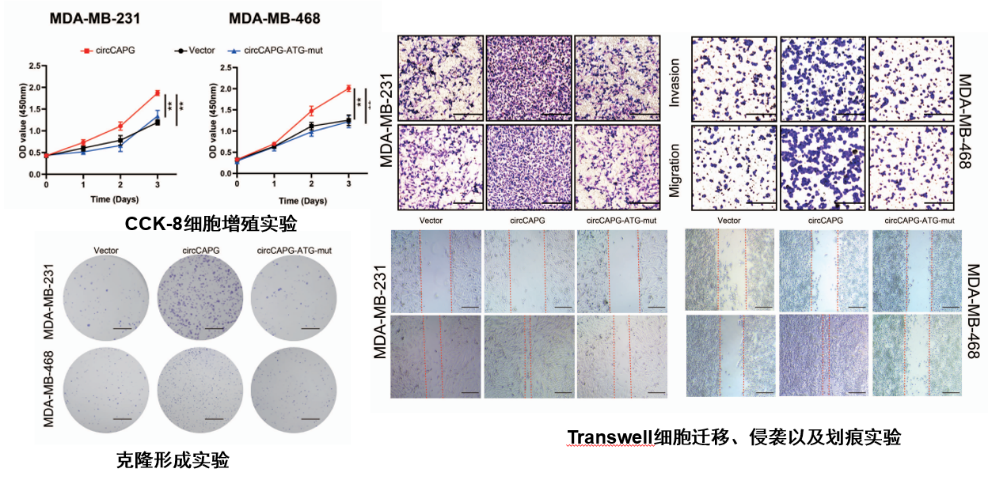 图6 新多肽CAPG-171aa促进TNBC恶性进展
图6 新多肽CAPG-171aa促进TNBC恶性进展
4、TNBC细胞中新多肽CAPG-171aa与STK38互作
通过蛋白质质谱分析和蛋白互作实验发现,新多肽CAPG-171aa与STK38互作。
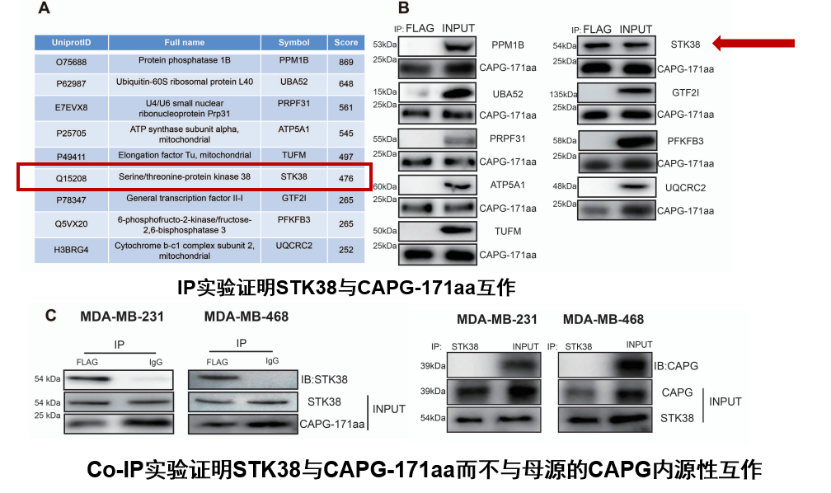
图7 TNBC细胞中新多肽CAPG-171aa与STK38互作
5、多肽CAPG-171aa通过降低STK38与SMURF1的结合减弱MEKK2的泛素化
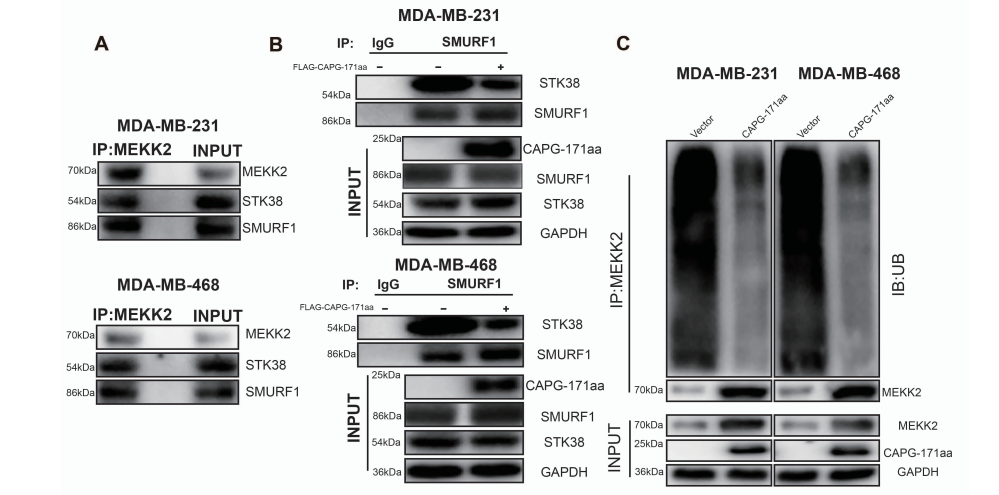 图8 多肽CAPG-171aa降低STK38与SMURF1的结合减弱MEKK2的泛素化
图8 多肽CAPG-171aa降低STK38与SMURF1的结合减弱MEKK2的泛素化
6、通过在病人来源的类器官上的机理验证
通过在3例病人来源TNBC肿瘤类器官上敲降circCAPG,观察到TNBC肿瘤明显缩小。
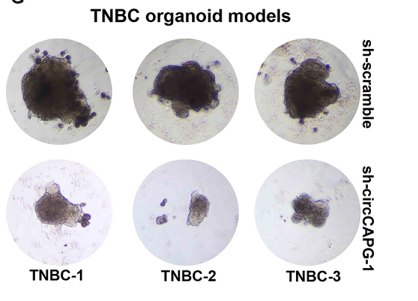 图9 敲降circCAPG在HCC类器官模型的表型
图9 敲降circCAPG在HCC类器官模型的表型
小结
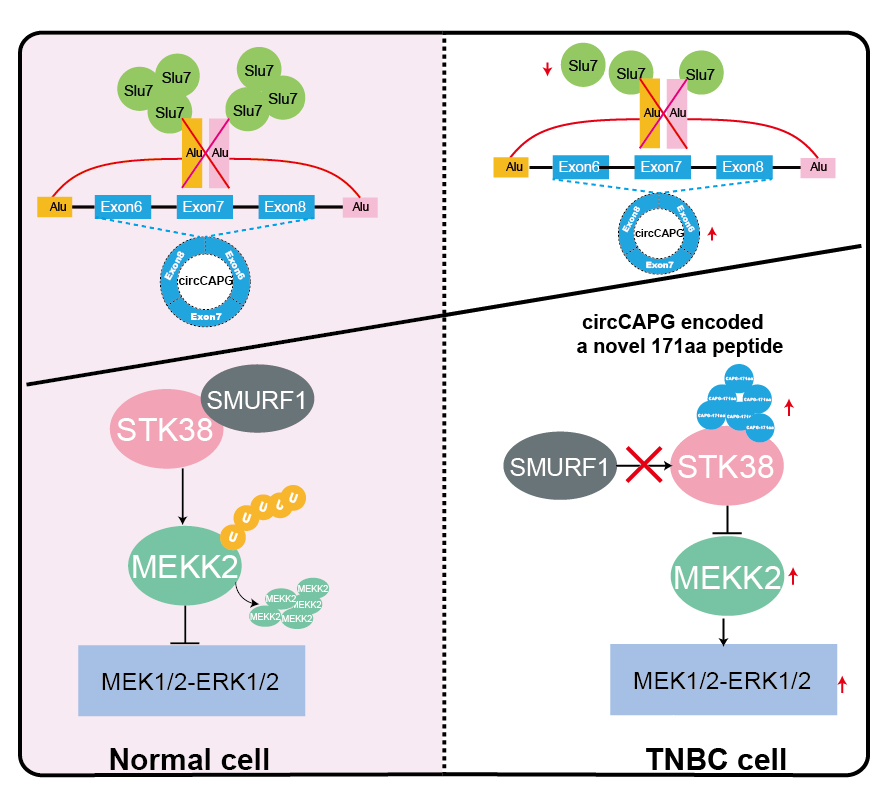 机理图:CAPG-171aa促进STK38与MEKK2的互作以促进TNBC的恶性进展
机理图:CAPG-171aa促进STK38与MEKK2的互作以促进TNBC的恶性进展

.png)
