外泌体circRNA作为一种新的遗传信息分子,促进肿瘤细胞和微环境细胞(如免疫细胞、成纤维细胞等)之间的交流,从而调节癌症进展的关键方面,包括免疫逃逸、肿瘤血管生成、耐药性、增殖和转移。鉴于circRNA在外泌体中具有内在稳定性、高表达丰度和分布广泛性的特征,外泌体circRNA可以在液体活检中作为优秀的诊断和预后生物标志物。最近研究发现,体外制备的circRNA能通过纳米颗粒或植物外泌体递送等策略,也为癌症治疗开辟了新的可能性。
2023年6月26日,江苏大学附属澳洋医院许文荣和严永敏教授团队在Journal of Hematology & Oncology(IF=28.5)上发表题为“Exosomal circRNA:emerging insights into cancer progression and clinical application potential”的综述论文。本文综述了肿瘤细胞和非肿瘤细胞来源的外泌体circRNA在肿瘤进展中的功能和潜在机制,特别关注其在肿瘤免疫和代谢中的作用。此外,作者阐述了外泌体circRNA作为诊断生物标志物和治疗靶点的潜能,强调了其在临床上的应用前景。
 1.外泌体与外泌体circRNA
1.外泌体与外泌体circRNA
1.1外泌体的生成
外泌体由跨膜脂质双分子层和各种物质组成,包括蛋白质、脂类、核酸和代谢物,存在于各种体液中(例如:血液、尿液等)。通常,质膜向内生长形成多囊泡小体(MVB),并直接与细胞膜融合,从而生成外泌体,常与多种内吞途径(包括吞噬作用、微胞饮作用等)融合,将蛋白质和核酸输送到受体细胞。
1.2外泌体circRNA作用
circRNA由前体mRNA通过反向剪接形成,重复序列-Alu和RNA结合蛋白-QKI可促进circRNA的生成。circRNA在外泌体中表达丰度高且稳定性强,可以被包装在外泌体中并发挥circRNA独特的功能:miRNA海绵作用、结合蛋白质功能、调节母基因转录水平、作为翻译模板等。例如,circ_0088300可被KHDRBS3驱动并包裹在外泌体中发挥功能。
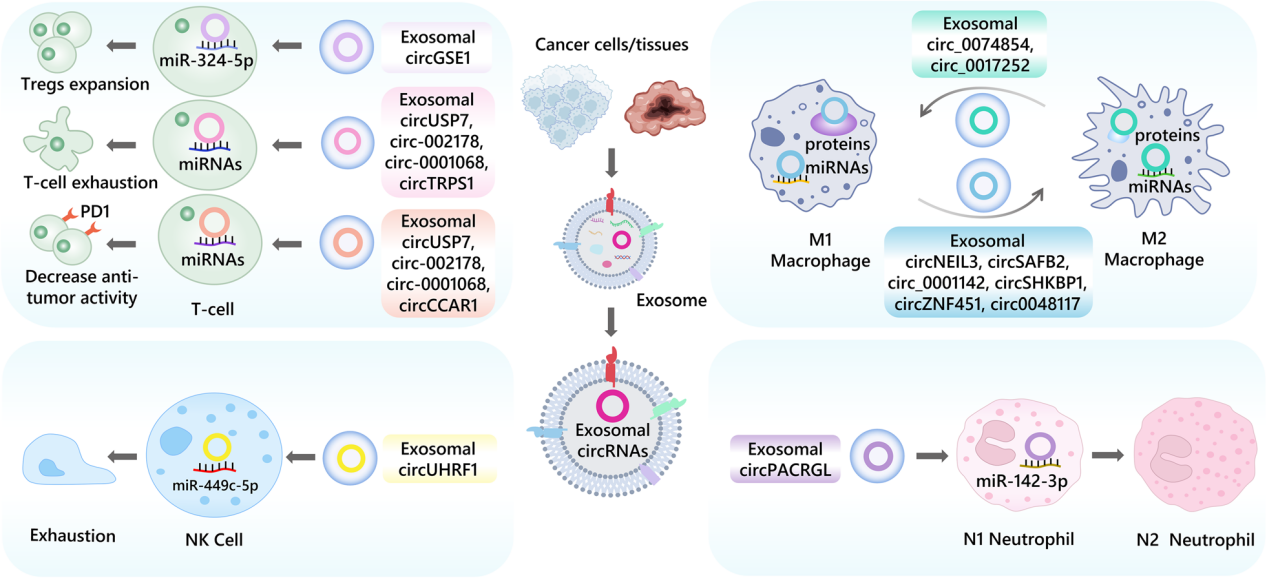 图1 肿瘤来源的外泌体circRNA在T细胞、巨噬细胞、NK细胞和中性粒细胞等免疫细胞中的作用
图1 肿瘤来源的外泌体circRNA在T细胞、巨噬细胞、NK细胞和中性粒细胞等免疫细胞中的作用
2.肿瘤来源的外泌体circRNA与肿瘤进展
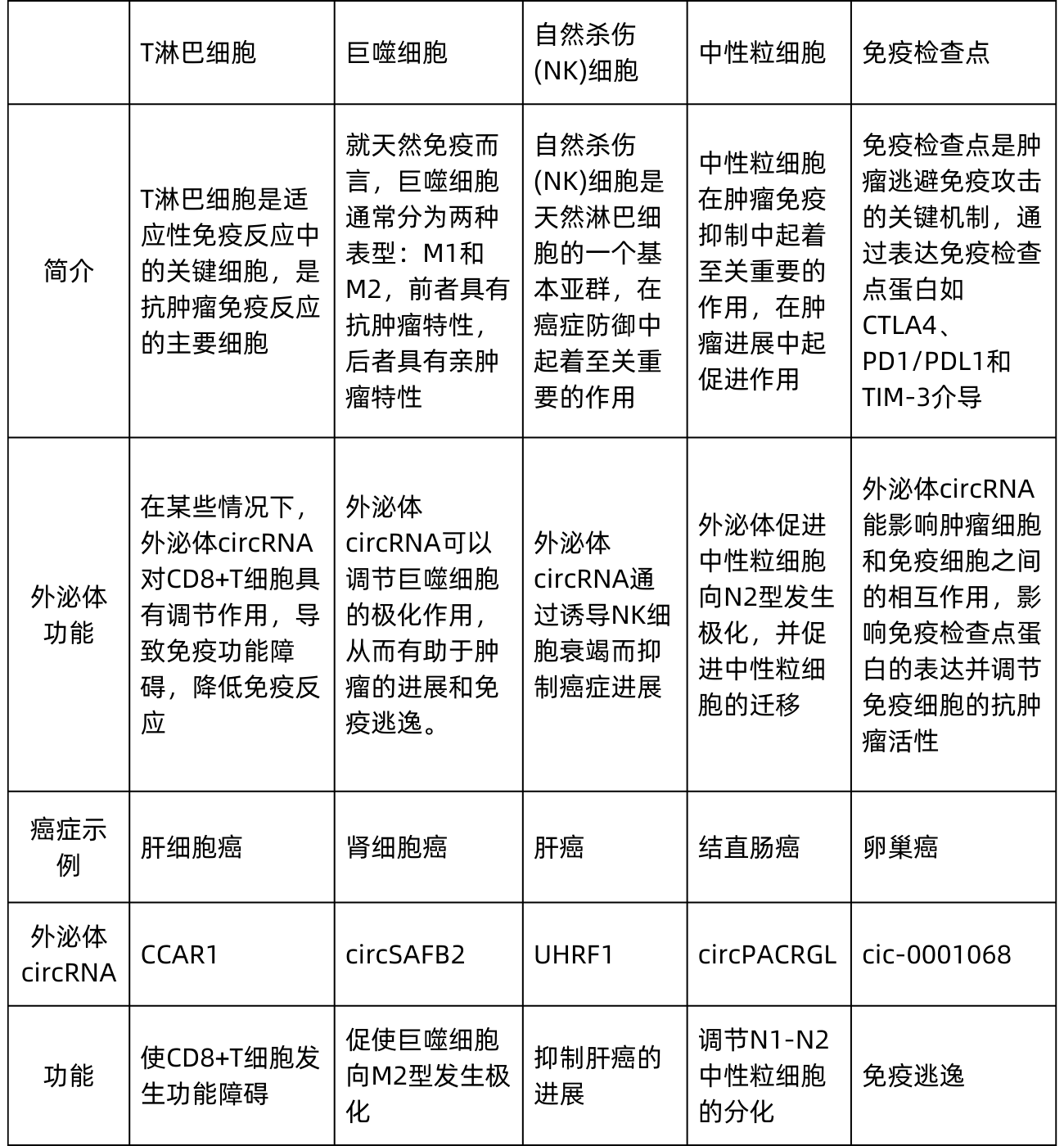
2.1肿瘤免疫
肿瘤免疫过程是一个多维度的动态现象,涉及体内多种免疫细胞和活性分子的参与。在肿瘤组织中,肿瘤细胞和免疫细胞之间通过外泌体进行交流,这一过程促成肿瘤生长环境的形成。目前,关于外泌体circRNA调节肿瘤免疫方面的研究取得了重大进展。
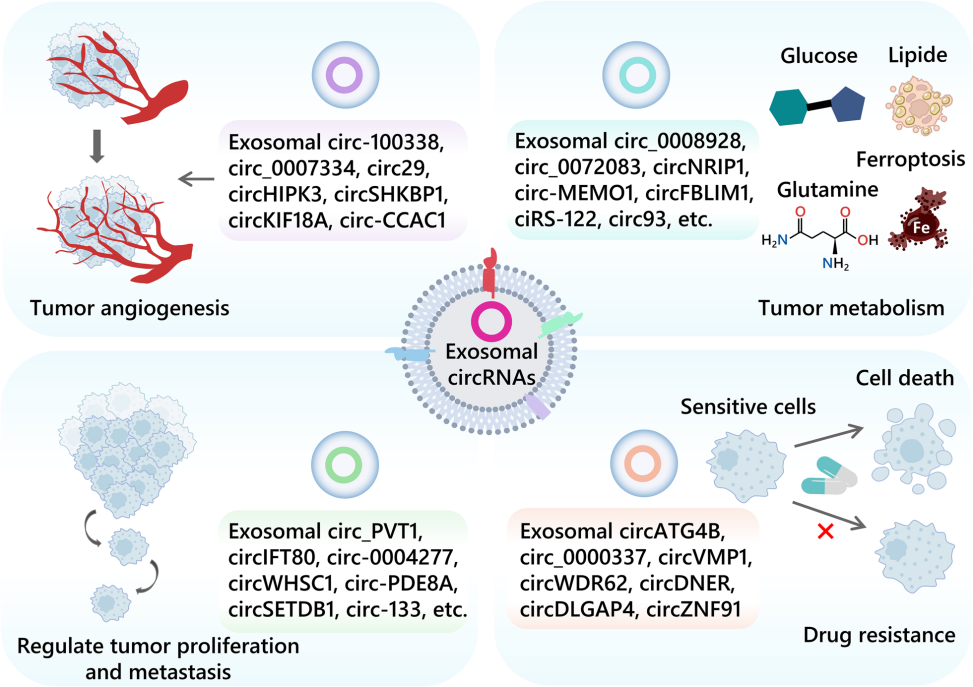
 2.2肿瘤代谢
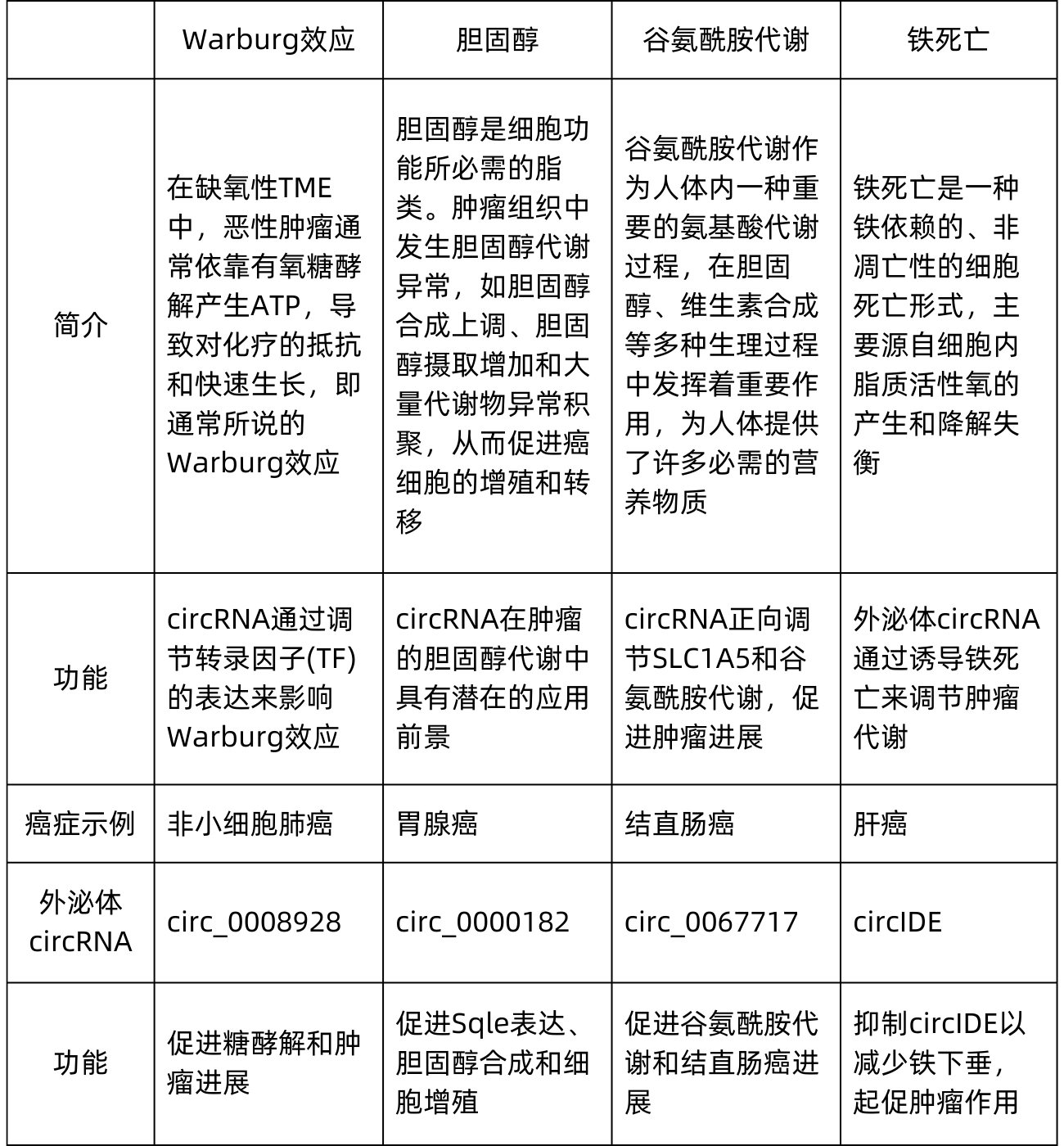
2.2肿瘤代谢
代谢重编程和失调伴随着肿瘤进展,并为肿瘤细胞的生长和分裂提供必要前提。事实上,许多癌症与代谢性疾病有关,而外泌体circRNA参与了癌症的新陈代谢。
 2.3肿瘤的增殖和转移
2.3肿瘤的增殖和转移
 2.4抗药性
2.4抗药性
图2 肿瘤中的外泌体circRNA在肿瘤血管生成、代谢、迁移、转移和耐药中的作用
3.非肿瘤来源的外泌体circRNA与肿瘤进展
肿瘤微环境中的细胞成分通过外泌体与肿瘤细胞沟通,并通过释放外泌体circRNA影响肿瘤进展。
3.1免疫细胞衍生的胞外circRNA与肿瘤进展
由于肿瘤相关巨噬细胞(TAM)具有抗肿瘤(M1)和促肿瘤(M2)两种表型,其释放的外泌体circRNA在肿瘤进展中也起着不同的作用。例如,在M2-TAM分泌的外泌体中,circ_0020256通过靶向miR-432-5p/E2F3轴来调节肝内胆管癌细胞的增殖、迁移和侵袭。另外,源自M1-TAM的外泌体miR-628-5p抑制了circFUT8的m6A修饰,从而减缓了肝细胞癌的进展。这揭示了免疫细胞来源的外泌体物质能调节肿瘤细胞中circRNA及其下游分子的作用机制,为肝癌治疗提供了新的潜在治疗靶点。
3.2肿瘤进展中非免疫细胞来源的外泌体circRNA
肿瘤微环境的一个关键组成部分是肿瘤相关成纤维细胞(CAF),是一类分布广泛的基质细胞,在调节肿瘤生长、转移、血管生成和耐药性方面发挥重要作用。例如,低氧诱导的CAF释放外泌体circEIF3K,通过靶向miR-214/PDL1来促进结直肠癌的增殖和侵袭,可能为结直肠癌提供新的治疗靶点。外泌体circRNA在肿瘤细胞与微环境细胞之间的传递引起了人们对肿瘤治疗和机制研究的极大兴趣。非肿瘤细胞来源的外泌体circRNA可能是癌症干预和治疗的新型靶点。
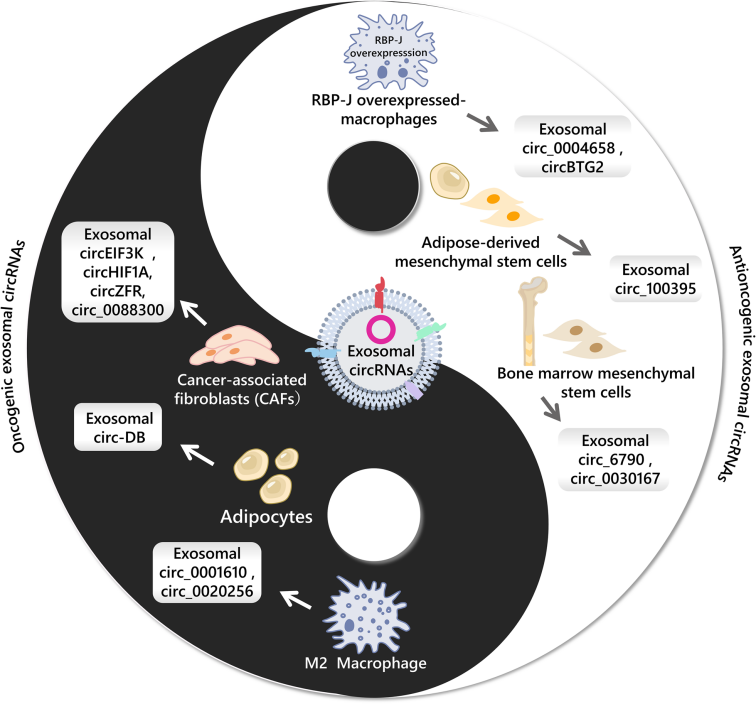 图3 非肿瘤来源的外泌体circRNA在肿瘤进展中的作用
图3 非肿瘤来源的外泌体circRNA在肿瘤进展中的作用
4.临床意义
外泌体circRNA具有许多优点,如高稳定性、高丰度和长半衰期等,而且存在于人体体液中(包括血浆、血清和尿液)。外泌体circRNA在肿瘤组织中异常表达,已被证明与各种癌症的进展和临床特征有关,可以作为癌症的早期诊断和预后标志物。
4.1外泌体circRNA作为临床生物标志物
越来越多证据表明,外泌体circRNA可以作为各类型肿瘤的诊断和预后生物标记物。最近研究发现,鼻咽癌患者血清中circMYC的高表达与肿瘤大小、淋巴结转移、TNM分期、生存率和疾病复发有关,但是需要更严格的实验数据和大量的临床样本去验证外泌体circRNA作为生物标记物的临床实用性。目前,由于缺乏高特异性和敏感性的生物标记物,外泌体circRNAs与CEA和CA19-9等传统生物标记物相结合可能会产生更好的诊断效果。外泌体circRNA将成为非常有前景,且十分可靠的肿瘤生物标志物,并最终进入临床应用。
4.2基于外泌体circRNA的治疗策略
外泌体circRNA与癌症相关,靶向其调控机制是癌症治疗的新策略。作者在图4中描述了直接靶向circRNA的治疗策略和局限性,并介绍了纳米颗粒和基于外泌体的circRNA递送系统的现状和前景。
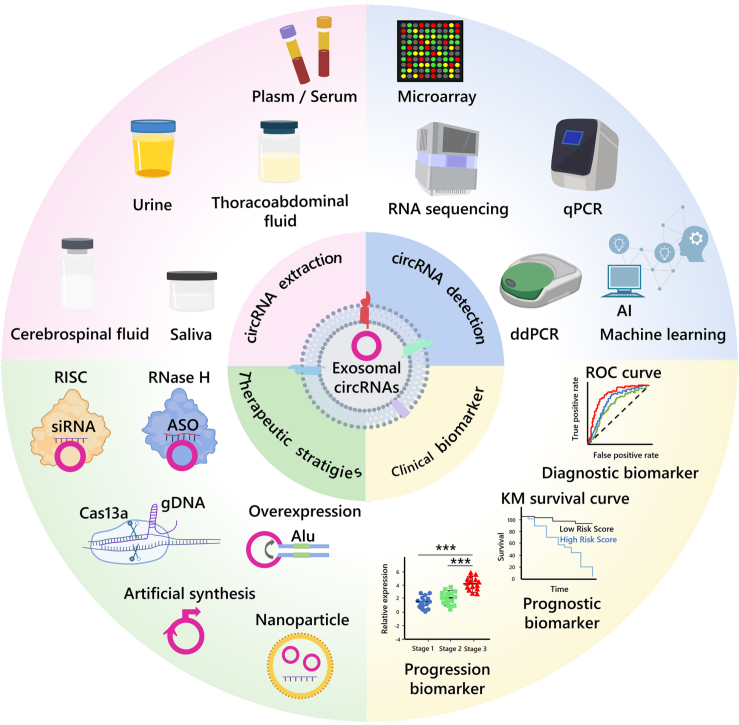 图4 circRNA和外泌体circRNA在肿瘤中的临床应用
图4 circRNA和外泌体circRNA在肿瘤中的临床应用
4.3靶向circRNA的治疗策略
小干扰RNA(siRNA)、反义寡核苷酸(ASO)等技术已经被设计用于靶向致癌circRNA。已有研究在患者来源的肿瘤异种移植(PDX)小鼠中使用circNRIP1 siRNA进行体内治疗,显著减少了肿瘤的重量和体积。相反,过表达载体已被用来促进肿瘤抑制因子circRNA的产生,如circFNDC3B抑制肿瘤血管生成和结直肠癌进展。此外,越来越多研究表明circRNA可以编码功能蛋白并参与癌症进展。研究人员正在努力人工合成circRNA,以规避mRNA的局限性。通过比较不同体外合成方法制备circRNA的效率和免疫原性,有学者发现由T4 RNA连接酶合成的circRNA具有较低的免疫原性,这是体外制备circRNA用于基因治疗的重要基础。此外,工程circRNA的产生、纯化、一级序列、二级结构和RNA修饰都是影响其免疫原性的重要因素。
4.4利用纳米颗粒递送circRNA的治疗策略
虽然大多数研究使用腺相关病毒和慢病毒载体作为针对circRNA的病毒传递系统,但存在成本高昂和潜在生物安全等问题,且其携带基因的能力有限。纳米粒子是在10~1000 nm之间的一种材料,与病毒载体相比具有成本低、制备容易等优点,在药物传递等方面发挥着重要作用,基于纳米颗粒的circRNA递送系统是一种非常有前景的治疗策略。为体外和体内递送circRNA而开发的脂质纳米颗粒(LNP)系统可触发适应性免疫,并在多种小鼠肿瘤模型中显示出良好的抗肿瘤效果,为癌症RNA疫苗的开发提供了新途径。魏文胜老师团队利用内含子I型法和T4-RNA连接酶法在体外合成了具有SARS-CoV-2-RB抗原性的circRNA-RBD,并证明了SARS-CoV-2 circRNA-RBD疫苗通过LNP递送系统在小鼠和恒河猴体内持续诱导了体液免疫应答,表现出比mRNA疫苗更高水平和更持久的抗原表达效果。
4.5利用外泌体递送circRNA的治疗策略
外泌体是30-150 nm的胞外囊泡,平均大小为100 nm,具有稳定性好、体积小和毒性低的特点,是理想的药物载体。与脂质体、纳米颗粒等合成载体相比,外泌体具有生物相容性强、免疫原性低、化学稳定性高等优点,近年来备受关注。基于外泌体的工程疗法已被开发用于各种疾病(包括癌症),已有多种外泌体递送疫苗进入临床试验阶段。综上所述,基于外泌体circRNA的治疗方法前景广阔,需要更多研究来探索其作为癌症治疗策略的潜力。
5.结论
外泌体circRNA参与肿瘤的免疫逃逸、血管生成、代谢、耐药、增殖和转移等过程,已成为研究的热点。肿瘤和非肿瘤来源的外泌体circRNA通过miRNA海绵或结合靶蛋白等机制,在肿瘤进展中是一把双刃剑,为癌症的发病机制和治疗提供了新见解。此外,外泌体circRNA有可能成为癌症诊断和预后的生物标志物,特别是与传统的肿瘤标志物相结合,能显著提高诊断和疗效分析的敏感性和特异性。总之,外泌体circRNA作为新的潜在生物标志物和治疗靶点的具有广阔的临床应用前景。
原文链接:
https://doi.org/10.1186/s13045-023-01452-2
.png)