环状RNA(circRNA)是一种多功能分子,参与调控转录和转录后的基因表达,并在多种正常和疾病(包括癌症)相关的不同组织和发育时期表现出特异性表达的特征。circRNA的内在稳定性高且对核糖核酸酶具有抗性,在癌症诊断、治疗和预防中作为可靠的诊断和预后生物标志物而备受关注。目前,研究人员已经鉴定出数千个高保守性、高丰度的环状单链RNA分子。然而,circRNA在临床中的效用和一些关键的注意事项尚不明确,缺乏完整的功能说明,使其生物检测方法建立和临床医学应用仍然具有很大的挑战。
2023年8月16日,德克萨斯大学MD安德森癌症中心George A Calin教授和巴斯大学Giuseppina Pisignano博士在Oncogene (IF=8.0)发表了综述文章【Going circular: history, present, and future of circRNAs in cancer】。文章回顾并综述了circRNA的生物发生及其生物学功能,总结并展望了circRNA在肿瘤发生中的作用和在癌症靶向治疗中的潜在用途。
circRNA的发现、研究和发展
circRNA的发现可以追溯到40多年前,在小鼠仙台病毒和被称为类病毒的植物致病病毒中被首次发现。1979年,科学家通过电子显微镜在真核细胞(HeLa)细胞质中观察到RNA以环状的形式存在。在20世纪90年代末到21世纪初,多项研究表明,产生circRNA的基因在从苍蝇到人类等真核细胞中广泛存在。2012年可谓是circRNA元年,随着高通量测序技术的发展,在人体内发现了大量circRNA;自此,circRNA研究逐渐火热。越来越多研究表明,circRNA在动物体内比相关mRNA具有更高的稳定性。目前,人们已经发现数千个circRNA存在于多种生物中,它们的表达与发育时期、生理条件和包括癌症在内的疾病有关,从而开辟了一个全新的研究领域。
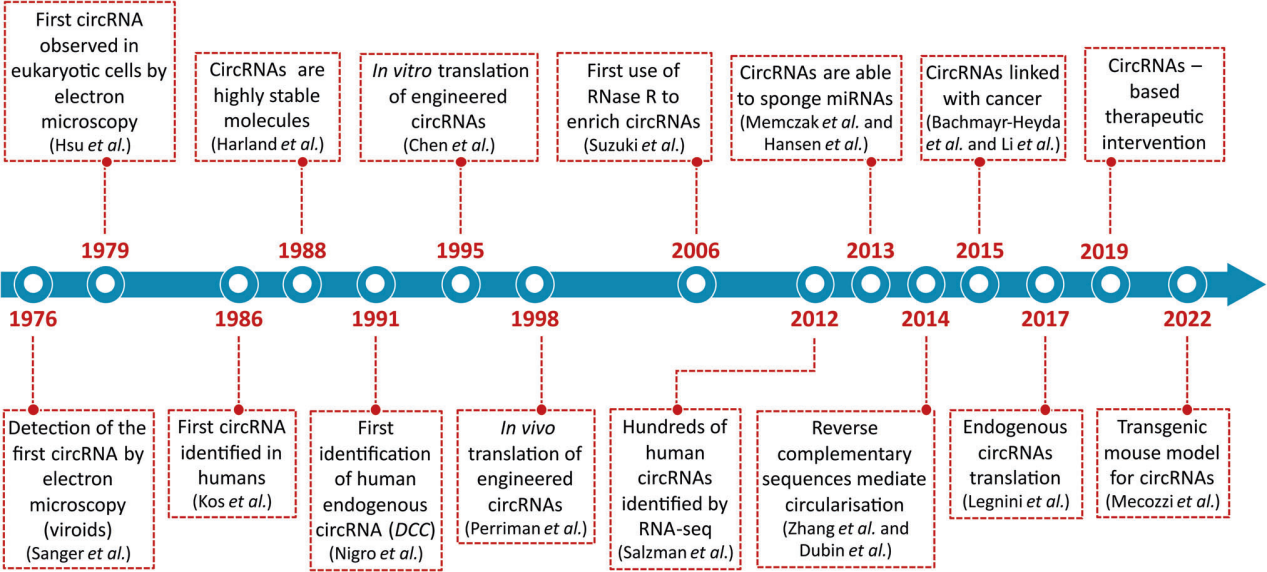 图1 circRNA研究的里程碑事件
图1 circRNA研究的里程碑事件
circRNA在正常或病理环境中的生物发生
circRNA的不同类型及其来源
众所周知,前体mRNA(pre-mRNA)剪接方式是一种与转录紧密结合的机制。在该过程中,pre-mRNA的内含子被去除,外显子被共价连接,形成线性mRNA,再被翻译成蛋白质。相反,反向剪接是通过下游剪接位点和上游剪接位点共价连接闭合,由此产生的circRNA没有5’帽子结构和3’聚腺苷酸化尾巴,核酸外切酶不易接近,比线性RNA更稳定。
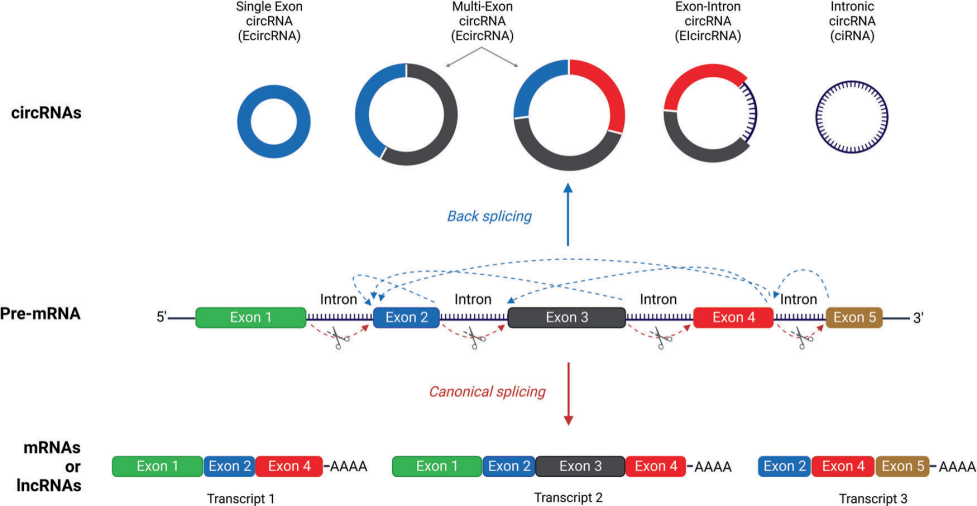 图2 pre-mRNA的经典剪接和反向剪接
图2 pre-mRNA的经典剪接和反向剪接
circRNA的生物发生机制
circRNA可以由多个外显子组合而成,有些甚至保留内含子部分。通常存在三种机制,包括套索驱动的环化(外显子跳跃)、内含子配对驱动的环化和RNA结合蛋白质(RBP)驱动的环化。
circRNA在病理过程中的生物发生
不同的病理环境(包括癌症)会产生不同类型的circRNA:
(1)因转录终止失败而过度转录下游基因,再进行反向剪接,产生read-through circRNA(rt circRNA);
(2)来自癌症相关的染色体易位会产生融合circRNA(f-circRNA);
(3)mRNA中未被甲基化的外显子可能会形成m6A修饰的circRNA,对circRNA的生成、定位和降解有一定影响。
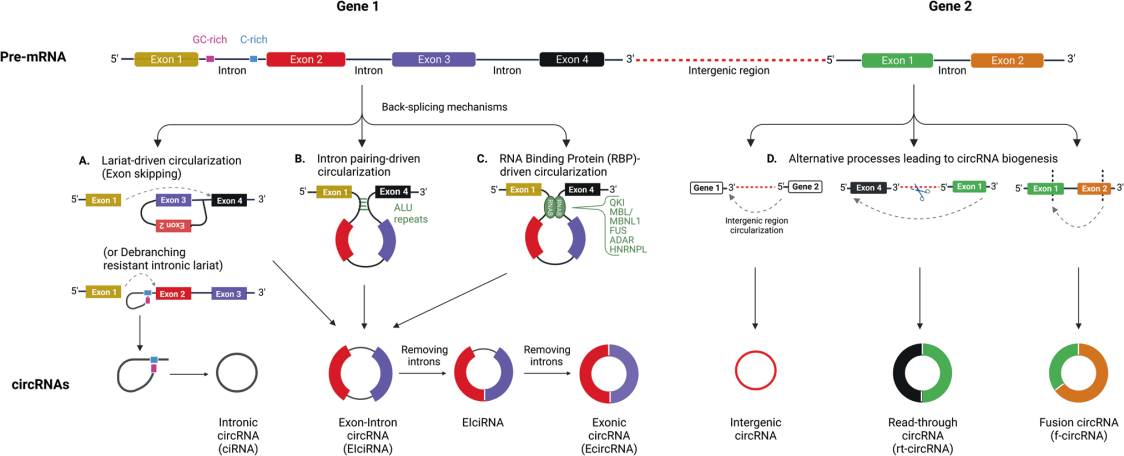 图3 circRNA的发生机制
图3 circRNA的发生机制
circRNA的生物学功能
circRNA作为转录调控因子
除了对pre-mRNA选择性剪接具有调节作用外,circRNA还可以作为亲本基因的转录调节因子,激活其亲本基因。位于细胞核中的circRNA(如由外显子和内含子组成的EIciRNA),可以通过碱基配对与U1-snRNP结合,在亲本基因启动子处与RNA Pol II相互作用,从而增强其表达。类似地,circRNA在其亲本基因的转录位点积累,并通过连接延伸RNA Pol II复合物而调节其延伸活性,以此来提高亲本基因的转录率。
circRNA作为miRNA的海绵
功能性circRNA最初被证实为有效的miRNA海绵,能够特异性吸附miRNA,在转录后调节其下游靶基因的活性。在癌细胞中,circHIPK3通过吸收肿瘤抑制因子miR-124来调节细胞生长,而circITCH通过吸收miR-7、miR-17和miR-214来发挥癌症抑制剂的作用。
circRNA作为RNA稳定性的调节剂
circRNA可以影响其他RNA分子的稳定性,包括lncRNA和mRNA。RNA分子的稳定性也可以与蛋白质协同进行。例如,circZNF609促进蛋白质ELAV1(也称为HuR)的募集,其相互作用增强了一系列mRNA的稳定性和翻译;circXPO1通过募集IGF2BP1来增强CTNNB1 mRNA的稳定性,从而促进肺腺癌进展。
circRNA与RBP相互作用
circRNA在细胞质内可以螯合胞浆蛋白并阻止其进入细胞核,充当RBP诱饵以调节其功能或充当复合物组装的支架分子。例如,在NSCLC中,对肿瘤生长和转移的抑制作用是由circNDUFB2的支架作用引起的,circNDUBB2与TRIM25和IGF2BPs形成三元复合物,促进IGF2BPs的泛素化和降解,并最终激活抗肿瘤免疫反应。
circRNA具有翻译功能
尽管大多数circRNA是非编码基因,但是有些circRNA可以与核糖体结合并翻译成蛋白质。
目前的研究表明,circRNA在以下2种情况下具有翻译功能:
(1)circRNA同时承载开放阅读框(ORF)和内部核糖体进入序列(IRES);
(2)在circRNA的5’UTR中结合m6A修饰。
此外,致癌病毒衍生的circRNA也可以翻译成蛋白质。例如,人类乳头瘤病毒衍生的circE7在宫颈癌和头颈癌中表现出致癌活性,并被转化为E7癌蛋白。
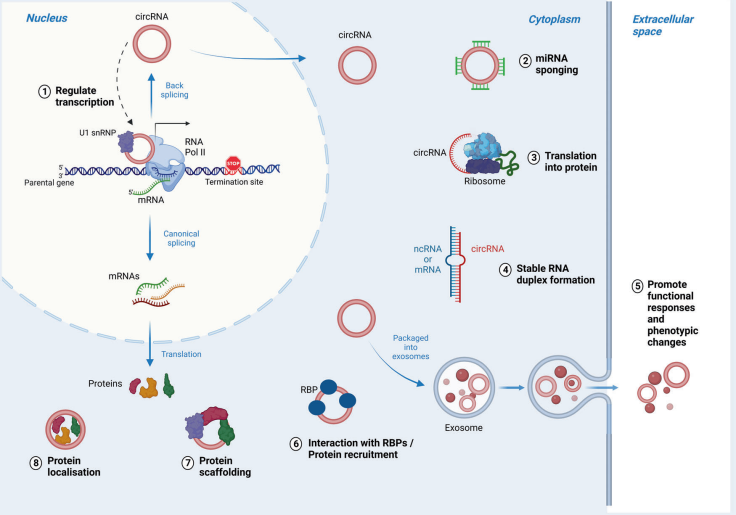 图4 circRNA作为CRC诊断和治疗的潜在生物标志物
图4 circRNA作为CRC诊断和治疗的潜在生物标志物
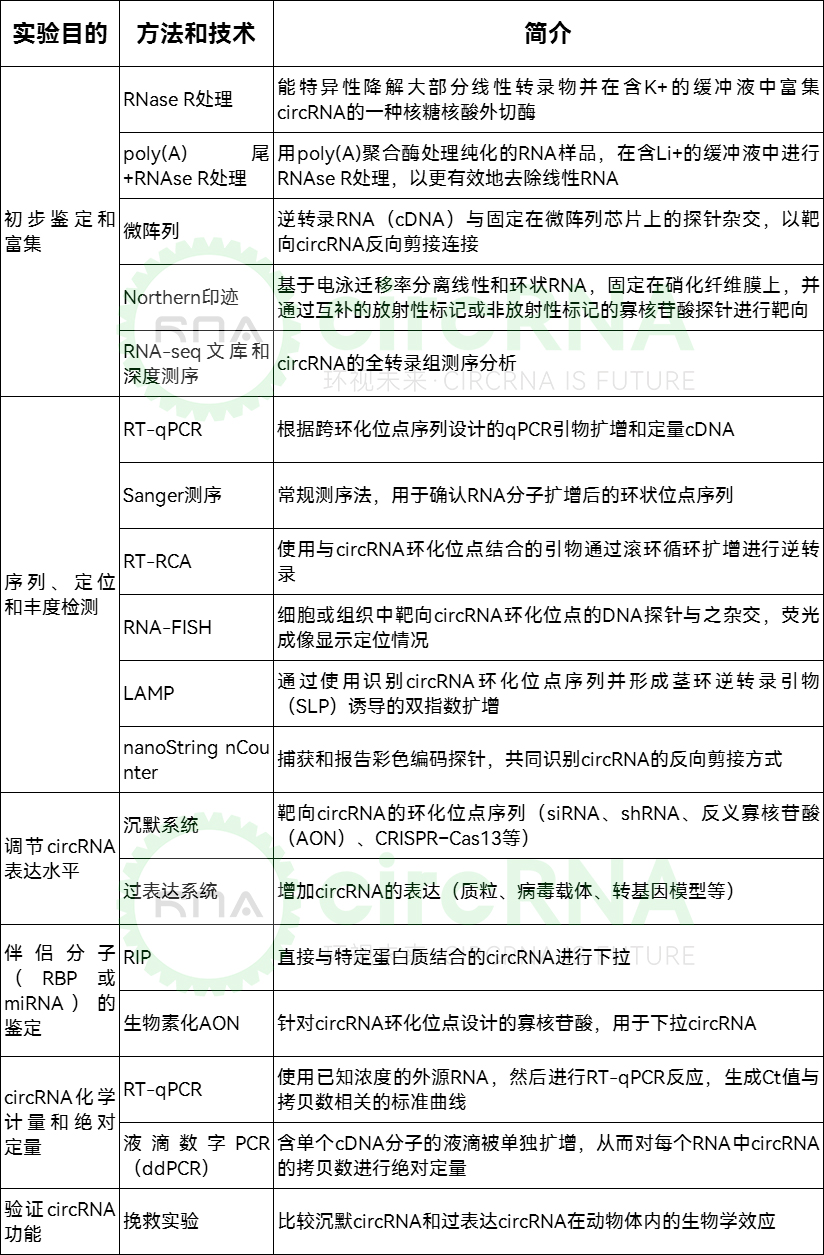
circRNA的检测和研究方法
从circRNA的发现、鉴定到功能研究,不同的方法有其自身的优势和局限性,将多种方法相结合可以提高circRNA检测和验证的可靠性和准确性。
circRNA作为癌症的生物标志物和治疗靶点
circRNA与多种生理条件和细胞生物学特征(包括干细胞和多能性细胞)有关,可能与诱导和维持癌症进展有关。此外,circRNA与一些临床特征相关,如肿瘤分级、大小、转移和侵袭性。越来越多研究表明,circRNA可作为早期癌症检测、临床诊断和预后的潜在生物标志物,甚至可用于监测治疗反应。circRNA具有独特的表达模式、分子稳定性、特异性和在人体内的广泛分布特性,因此能够通过体液(包括血液、唾液和尿液)中的液体活检对其进行检测和定量,液体活检便于重复采样、侵袭性较小和可行性较高,比组织活检便捷高效。
circRNA的失调可以驱动各种癌症的肿瘤发生和转移,使其成为癌症治疗的有效靶点。目前的研究旨在通过调节circRNA的表达水平而进行治疗,使用动物模型进行临床前研究主要运用过表达或敲低circRNA使其获得或丧失功能的策略。
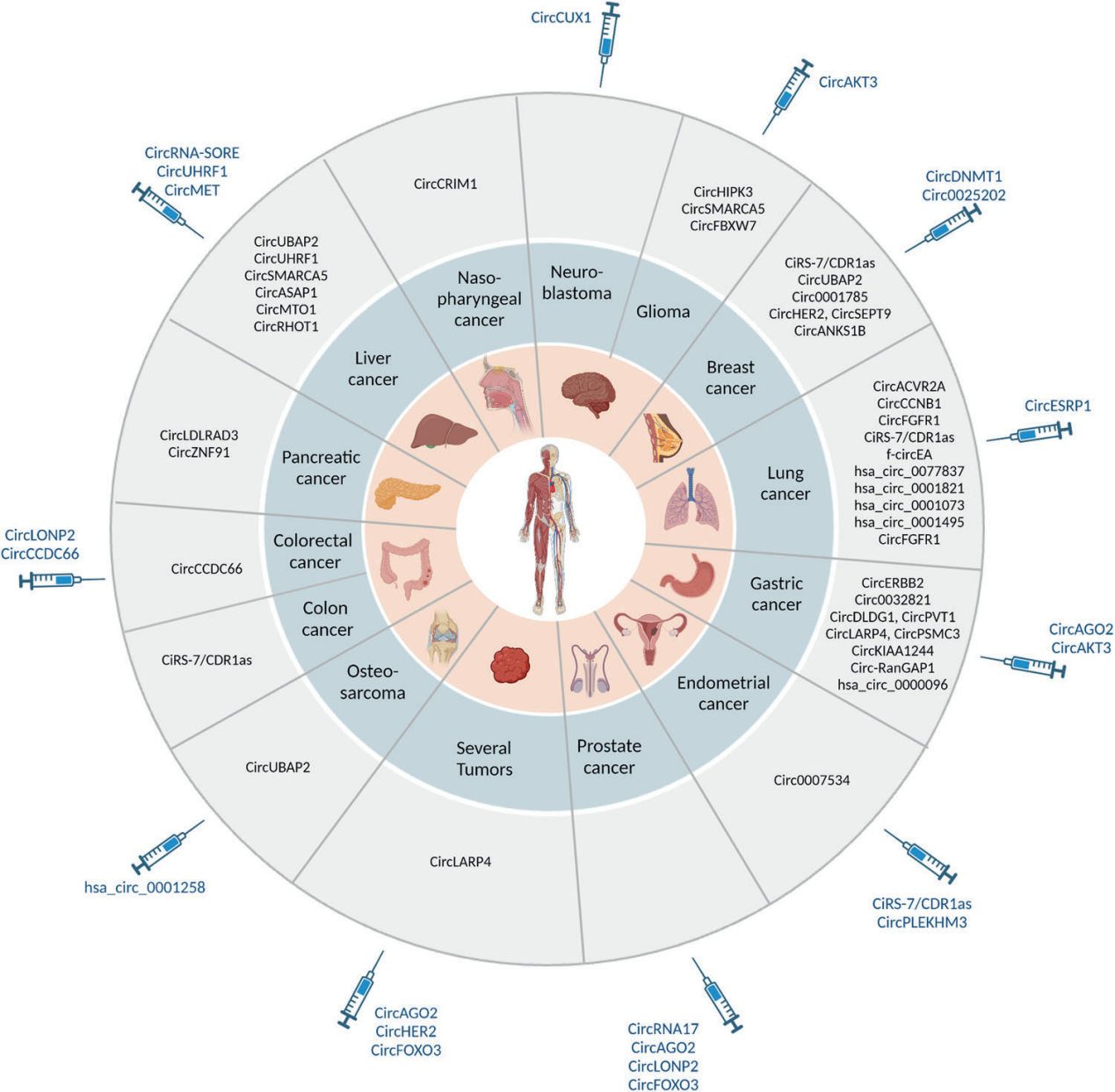 图5 circRNA作为人类癌症的生物标志物和治疗靶点
图5 circRNA作为人类癌症的生物标志物和治疗靶点
总结
circRNA在不同癌症组织和疾病中参与多种分子机制,从临床角度来看,circRNA的出现为癌症研究开辟了新天地,可以作为早期癌症检测、诊断、预后甚至预测治疗反应的有效生物标志物。然而,circRNA对癌症的诊断和治疗有何影响仍然存在争议,有时甚至相互矛盾,将来需要在临床研究的背景下对患者样本进行更详细的生物学验证。一旦对circRNA的功能生物学有了更全面的了解,就有可能在临床上充分利用circRNA的潜力。
原文链接:
https://doi.org/10.1038/s41388-023-02780-w

.png)