电离辐射(IR)是疾病诊断和治疗必不可少的一部分。流行病学和实验研究表明,电离辐射的广泛应用引起了人们对其有害健康方面的担忧。尽管电离辐射治疗可以治愈50%的癌症患者,但辐射毒性、辐射耐受性和癌症复发的挑战仍然存在。例如,在对电离辐射的反应中,癌细胞可能通过增强DNA损伤修复(DDR)、抑制凋亡、自噬或增强上皮-间充质转化(EMT),导致癌细胞对电离辐射具有耐受性,从而发展免疫逃逸机制和维持其基因组完整性的能力。
环状RNA是在真核生物中通过非典型反向剪接产生的共价闭合RNA分子,不存在5‘帽子和3’poly-A尾巴,从而赋予环状RNA对外切酶的抗性和比线性RNA更高的稳定性。越来越多的研究表明,环状RNA可以作为生物标记物,对疾病诊断、预后和治疗具有重要临床意义。目前已知,表达水平失调的环状RNA可以通过作为miRNA海绵和调控信号通路参与癌症的发病机制,而进一步研究环状RNA的功能有助于解析肺癌对电离辐射耐受性的潜在分子作用机制。
2023年8月2日,中南大学湘雅公共卫生学院黄瑞雪教授以及北京放射医学研究所周平坤教授以共同通讯作者在Journal of Advanced Research(IF=10.7)发表文章“P53-response circRNA_0006420 aggravates lung cancer radiotherapy resistance by promoting formation of HUR/PTBP1 complex”。研究结果表明,依赖于p53的circRNA_0006420(IRSenss)可以调节细胞周期阻滞和电离辐射诱导的EMT进展,影响A549细胞对电离辐射的敏感性。当p53存在时,经辐射后,IRSense的过表达促进了辐射耐受性;然而,当p53被敲掉时,辐射后IRSense的表达被抑制,则显示辐射敏感性。此外,作者也证明IRSense可以作为促进HUR/PTBP1复合物形成的支架。从机制上来讲,当p53存在时,IRSenss在电离辐射后定位于细胞核,并与RNA结合蛋白HUR相互作用,以阻止宿主PTBP1 mRNA的核输出,随后抑制其表达以促进辐射敏感性。本研究进一步阐述了circRNA在调节电离辐射效果中的作用,为临床肺癌治疗提供了新途径。

电离辐射后p53会调控IRSense的表达
首先作者将A549细胞分为p53-wt、p53-KO、p53-wt-IR和p53-KO-IR,探索响应p53的circRNA,并且使用RNA-seq对circRNA进行测序验证。通过差异比对分析,发现IRSense是在电离辐射后表达水平上升最多的circRNA。在电离辐射后,IRSense在p53-wt细胞中表达水平上调,而在p53-KO细胞内表达水平没有发生变化;同时,在A549细胞中过表达野生型的p53或使用阿霉素激活DDR,两种方式均会增加IRSense的表达水平。结果表明p53会调控电离辐射后IRSense的表达(如图1)。
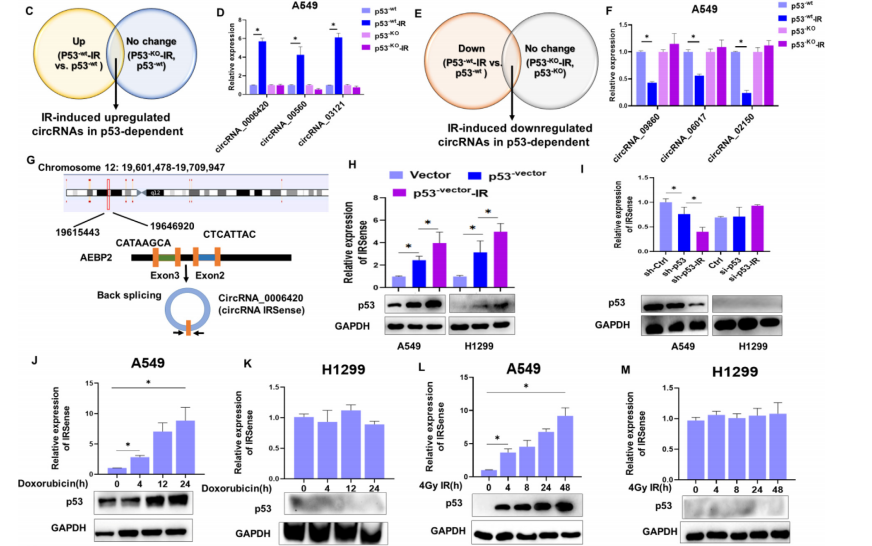 图1 沉默p53可以抑制电离辐射后IRSense表达的上调
图1 沉默p53可以抑制电离辐射后IRSense表达的上调
电离辐射后IRSense上调,促进了肺癌细胞辐射耐受性
随后作者评估了IRSense在有无p53情况下的细胞增殖和针对电离辐射敏感性中的作用。实验结果显示,当p53存在时,过表达IRSense增加了p53-wt细胞的增殖,而IRSense基因的下调则相反。集落形成实验显示,IRSenss的敲低降低了p53-wt A549细胞的集落面积,但没有降低p53-KO A549细胞的集落面积。细胞周期分析实验显示,与p53-KO A549细胞相比,p53-wt A549细胞中IRSense敲低影响了细胞周期。凋亡实验显示,与p53-KO A549细胞相比,IRSense的下调显著提高了p53-wt A549细胞的凋亡率。这些结果表明,p53存在的情况下,辐射后IRSense的表达增加,导致G2/M阻滞并抑制细胞凋亡,从而导致肺癌细胞出现辐射耐受性(如图2)。
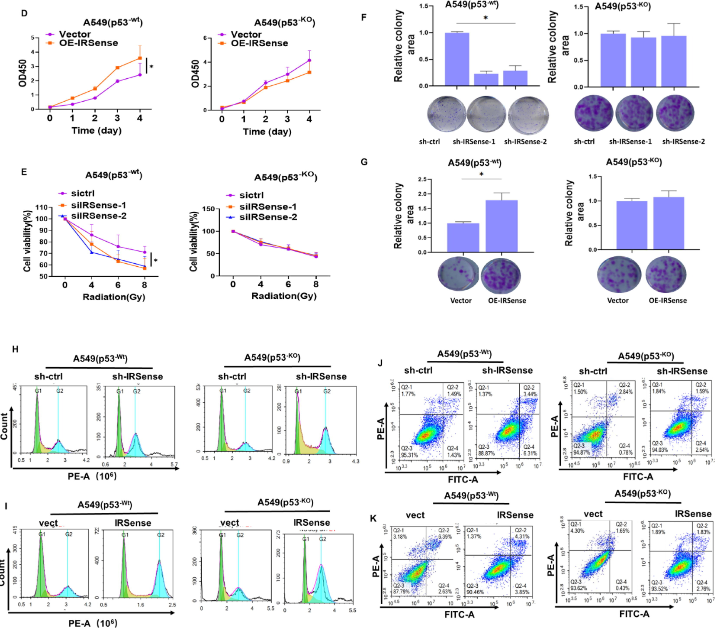 图2 辐射后IRSense以依赖于p53的方式促进电离辐射耐受性
图2 辐射后IRSense以依赖于p53的方式促进电离辐射耐受性
IRSense与电离辐射诱导的DDR和EMT进程密切相关
接着,作者验证了在p53存在的情况下,辐射后IRSense的上调与DDR通路相关蛋白的关系。实验结果显示,在4 Gy辐射下,A549细胞中ATM、CKH2和p-cdc25c水平升高,cdc2水平下降,且呈时间依赖性。结果表明,IRSense以p53响应的方式调节DDR相关蛋白以应对辐射损伤。此外,作者研究了IRSense和EMT的关系。WB实验显示在4Gy辐射处理后,与p53-KO A549细胞相比,IRSense的下调增加了p53-wt A549细胞中的E-cadherin表达水平,但降低了N-cadherin和viment的表达,且呈时间依赖性。肺组织的H&E染色显示,注射siIRSense的p53-wt-siIRSense-IR小鼠的炎症浸润和胶原纤维沉积减少。这些结果表明,在p53存在的情况下,IRSense的过表达促进了电离辐射诱导的EMT(如图3)。
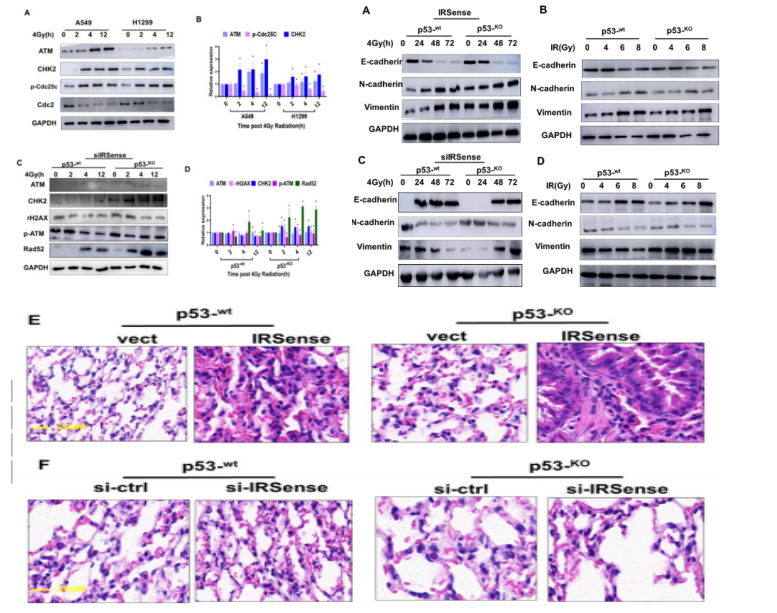 图3 IRSense调节DDR相关蛋白的表达以及电离辐射诱导的EMT
图3 IRSense调节DDR相关蛋白的表达以及电离辐射诱导的EMT
IRSense在电离辐射后定位在细胞核内,与HUR蛋白相互作用
作者上述探讨了IRSense介导的辐射诱导细胞G2/M阻滞和EMT的分子机制。作者通过RNA-FISH发现,IRSense定位于细胞质,在4 Gy辐射后转移到细胞核,并与p53共定位。通过生信分析,作者预测了IRSense的结构;发现IRSense可以形成RNA蛋白复合物,IRSense可能会与HuR蛋白结合。通过RIP联合LC/MS分析显示IRSense在A549细胞中和HUR会相互作用。此外,作者通过RNA pull-down实验证明RPD-1是最有可能的HUR结合位点。这些结果表明,在p53存在的情况下,IRSense在电离辐射后从细胞质转移到细胞核,并与HUR相互作用(如图4)。
 图4 电离辐射治疗后,IRSense与肺癌细胞核中的HUR相互作用
图4 电离辐射治疗后,IRSense与肺癌细胞核中的HUR相互作用
p53促进IRSense/HUR/PTBP1复合物的形成,抑制PTBP1 mRNA的核输出
此外,作者通过生信分析推测IRSense/HUR/PTBP1复合物具有调控功能。通过RNA-FISH分析表明p53-wt A549细胞经4 Gy辐射处理后,敲低IRSense会抑制HUR从细胞质向细胞核转移。辐射处理后,IRSense的敲低不影响PTBP1的表达。PTBP1是一个与mRNA输出相关的剪接因子。因此,作者推测IRSense/HUR复合物会调控PTBP1 mRNA的输出。通过WB以及qPCR检测表明,在过表达IRSense的细胞内,细胞核内HUR蛋白和mRNA表达水平升高。RIP实验证明HUR在A549细胞中与IRSense和PTBP1 mRNA相互作用。这些结果表明,在p53存在的情况下,经过辐射处理后,过表达IRSense会促进HUR和PTBP1停留在细胞核内(如图5)。
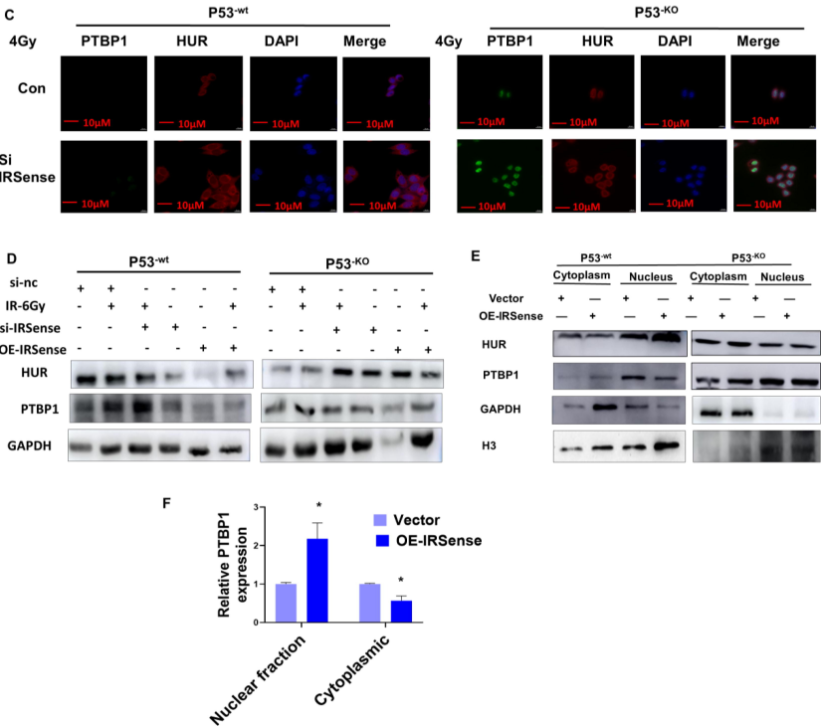 图5 P53促进IRSense/HUR/PTBP1复合物的形成
图5 P53促进IRSense/HUR/PTBP1复合物的形成
总结
综上所述,作者发现在电离辐射后,IRSense在p53-wt细胞中表达上调,但在p53-KO细胞内没有发生变化,说明p53会调控IRSense的表达。在p53存在时,辐射后IRSense的上调通过调节DDR通路相关蛋白诱导G2/M阻滞;同时,辐射后IRSense的上调也会促进辐射诱导EMT。本研究进一步加深了对circRNA在调节电离辐射效果中的作用,为有效的临床肺癌治疗提供了新的途径。
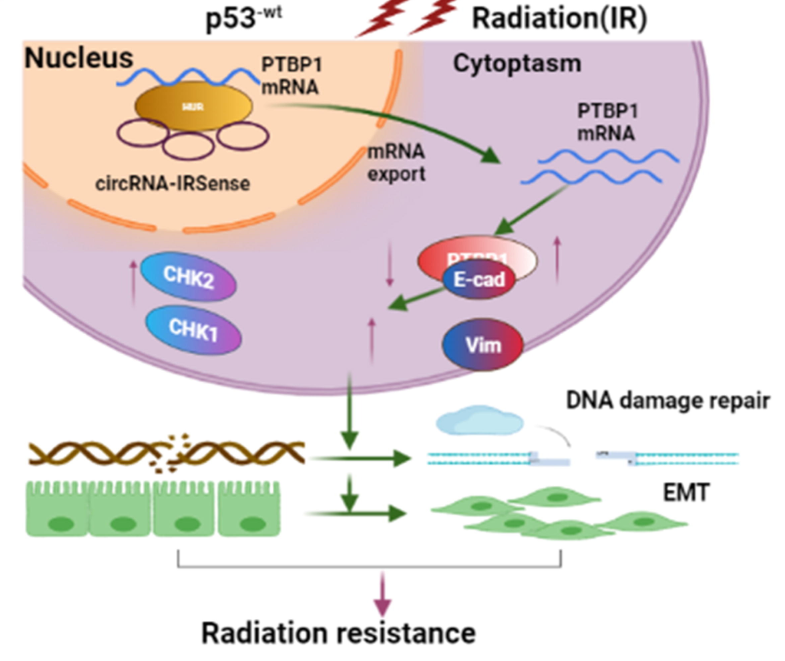
图6 IRSense通过促进HUR/PTBP1复合物的形成从而增强肺癌电离辐射耐受性示意图
原文链接:
https://doi.org/10.1016/j.jare.2023.07.011
.png)