本期特邀湖南大学彭友松教授团队分享解读,感谢对circRNA平台的关注!
病毒是一类微小而具有传染性的病原体,其基因组相对于真核生物的基因组来说异常微小。正是这种微小的基因组使得病毒circRNA长期以来鲜为人知。与线性RNA不同,circRNA具备独特的封闭环结构,这一特性使其极其稳定,能够抵抗核酸外切酶的降解作用。同时,circRNA广泛分布于各类生物体中,包括植物、动物和病毒。近年来,高通量测序技术和生物信息学工具的发展,使得研究人员能够更全面地识别和分析circRNA。
有研究表明,病毒circRNA在宿主的多种关键生命活动中发挥重要作用,包括调节宿主基因表达、与细胞成分相互作用以及影响宿主免疫反应等方面的影响。比如Sekiba等人发现乙型肝炎病毒(HBV)产生的circRNA与人类DExH-Box螺旋酶9(DHX9)相互作用,参与针对DNA病毒的先天性免疫反应;Liu等人发现,人类γ疱疹病毒4(HHV4)编码的名为circRPMS1的环状RNA可作为miRNA海绵,促进HHV4相关上皮肿瘤的发展。然而,这些病毒环状RNA研究比较零散,且只揭示了少数的病毒环状RNA分子。为了系统地研究病毒circRNA分子,我们之前的工作中建立了首个病毒circRNA数据库VirusCircBase(http://www.computationalbiology.cn/ViruscircBase/home.html)。该数据库近三年来已经被来自全球60个主要国家和地区的用户使用,促进了病毒环状RNA分子的研究。
2023年9月19日,湖南大学彭友松教授研究团队在Emerging Microbes & Infections(IF=13.2)在线发表了的最新研究成果,题为“An updated database of virus circular RNAs provides new insights into the biogenesis mechanism of the molecule”。在先前的研究中,我们建立了首个病毒circRNA数据库VirusCircBase,并在该领域得到了广泛应用。在更新版本的数据库–VirusCircBase 2.0(http://computationalbiology.cn/VirusCircBase2/#/home)中,我们不仅显著增加了数据库中的数据量和功能,还为病毒circRNA的生成机制提供了新的见解。
亮点
1. VirusCircBase 2.0在数据量和功能上都有了显著的提升,包含来自43个病毒物种的60,859个circRNA,为研究人员提供了全面的资源。
2. 病毒circRNA表现出普遍的低表达和较强的组织异质性。
3. 病毒circRNA展示了与动植物不同的独特剪接信号特征。
4. 揭示了与病毒circRNA形成相关的人类基因,为病毒circRNA的生物合成机制提供了启示。
研究结果
01 数据库更新情况:
与前一版本相比,VirusCircBase 2.0在数据量和数据库功能方面都有所更新(表1)。
在数据方面,VirucCircBase 2.0中病毒circRNA的数量从 46440 个增加到 60859 个。具体来说,病毒种、宿主、组织或细胞类型、样本量、病毒circRNAs与宿主miRNAs之间相互作用的数量分别从23、9、46、337、30818增加到43、22、83、566、72157。此外,新增了1902个全长病毒circRNA。
在数据库功能方面,VirusCircBase 2.0提供了三个新功能:i)以热图形式显示病毒circRNA在样本中的表达水平;ii)以基因组浏览器形式显示病毒circRNA在病毒基因组上的表达情况;iii)按宿主浏览病毒circRNA(图1)。
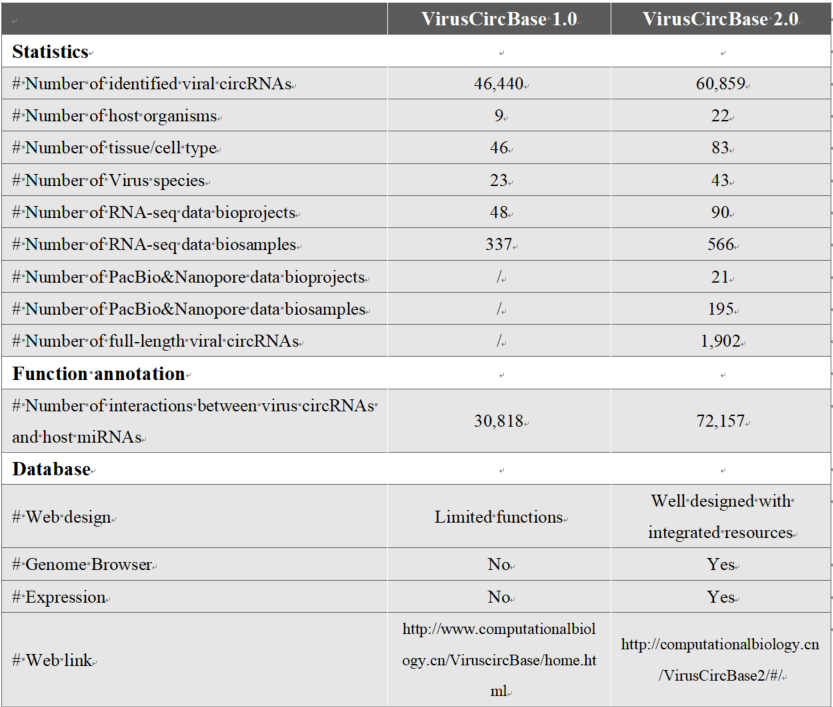 表1. VirusCircBase 1.0和VirusCircBase 2.0的比较
表1. VirusCircBase 1.0和VirusCircBase 2.0的比较
 图1. VirusCircBase 2.0的首页截图
图1. VirusCircBase 2.0的首页截图
该数据库的网址为:
http://computationalbiology.cn/VirusCircBase2/#/home
02 VirusCircBase 2.0包含的数据情况:
我们在6个巴尔的摩分类、25个病毒科和43种病毒中鉴定到了病毒circRNA(如图2所示)。大多数病毒circRNA来自正义单链RNA(ssRNA(+))病毒(占67.3%)和双链DNA(dsDNA)病毒(占30.6%)。另外,在VirusCircBase 2.0中新增了35种病毒的circRNA,其中20种是之前没有的病毒。其中SARS-CoV和HHV1的circRNA数量增加最为显著,分别从4157个增至9324个和从379个增至2721个。有趣的是,Mammalian orthoreovirus(MRV1)编码了125个circRNA,是目前为止是唯一已知具备编码circRNA能力的dsRNA病毒。此外,我们还发现了两种噬菌体,即假单胞菌病毒PhiKZ(PhiKZ)和埃希氏菌病毒P1(PhageP1),它们分别编码了249个和178个circRNA。
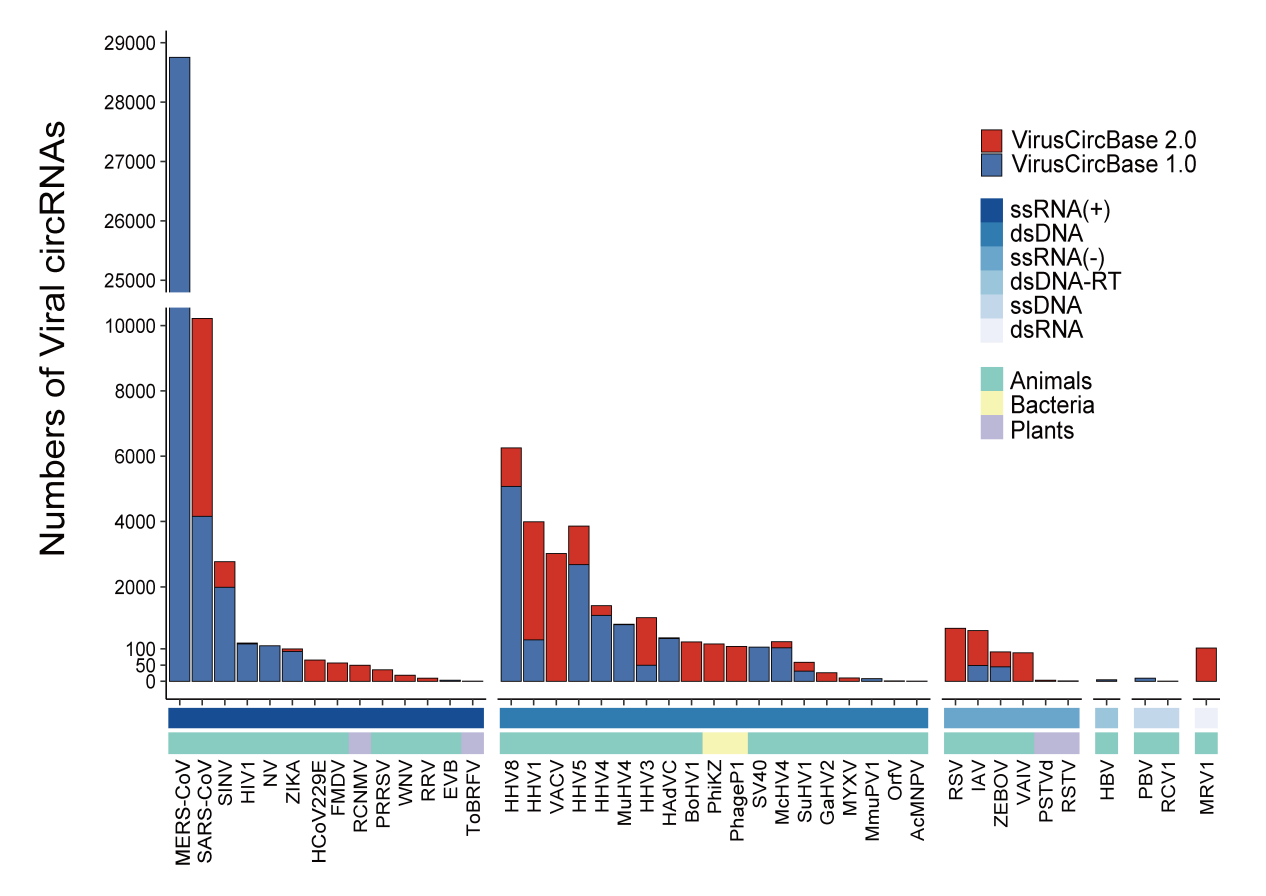
图2. VirusCircBase 2.0中每种病毒中检测到的病毒circRNA数量
03 病毒circRNA在不同细胞或组织中的表达量情况:
由于数据有限,大多数病毒只在少数细胞或组织中表达circRNA。此外,它们在这些细胞或组织中的表达量也很低。病毒circRNA在不同细胞或组织中的表达量差异很大,例如,HHV8在大多数细胞中的丰度较低(lg RPM:2.16-3.79),但在TREx-BCBL1RTA和iSLK-BAC16细胞中的丰度较高(lg RPM分别为4.59和4.97)。有趣的是,一些病毒,如鼠乳头瘤病毒1型(MmuPV1)只有尾部组织中才有高表达的circRNA(lg RPM:6.0),这表明病毒circRNA在MmuPV1尾部组织的慢性感染中起着重要作用。
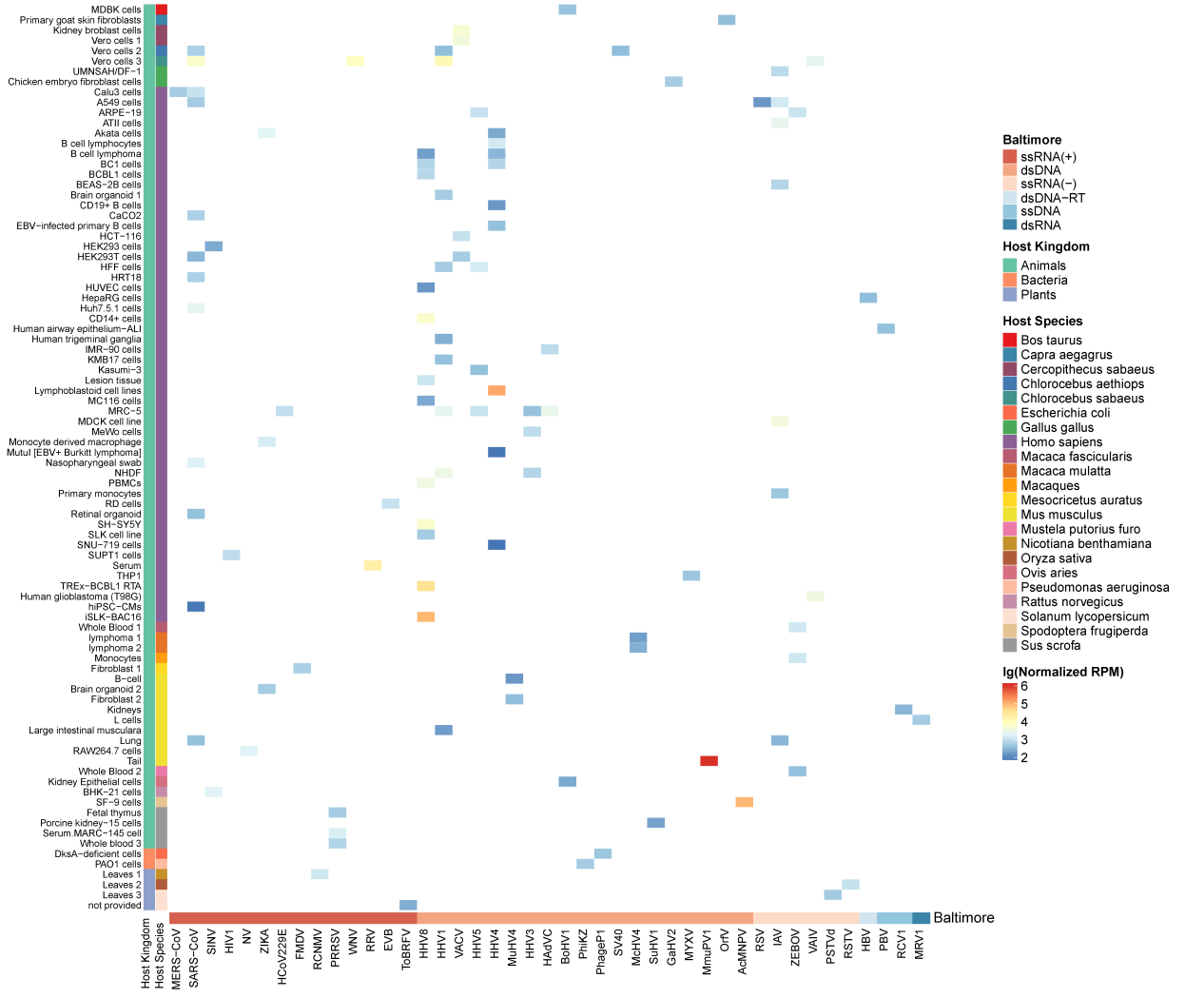 图3. 病毒circRNA在不同宿主的不同组织或细胞中的表达
图3. 病毒circRNA在不同宿主的不同组织或细胞中的表达
04 病毒circRNA的形成机制分析:
如图4A所示,70%的病毒circRNA使用GT/AG剪接信号,这也是动物和植物中使用的主要信号。然而,与非规范剪接信号所占比例低于1%的动物和植物相比,病毒circRNA表现出更高的非规范剪接信号比例。例如,GC/AG信号是病毒circRNA中最丰富的非规范信号,占总数的7.1%,远高于哺乳动物(0.7%)。
对病毒circRNA的剪接类型的分析发现,病毒circRNA中最常见的是A5SS类型(55.9%),其次是ES(22.0%)和A3SS(15.7%)(图4B)。而在人类中,ES是最常见的剪接类型,其次是A3SS和A5SS。
对病毒circRNA的异构体数量的分析发现,大多数病毒circRNA只有一种或两种异构体(69.9%)(图4C)。只有很小一部分病毒circRNA有五个及以上异构体。而在哺乳动物和植物中,circRNA通常有两种或两种以上的异构体。
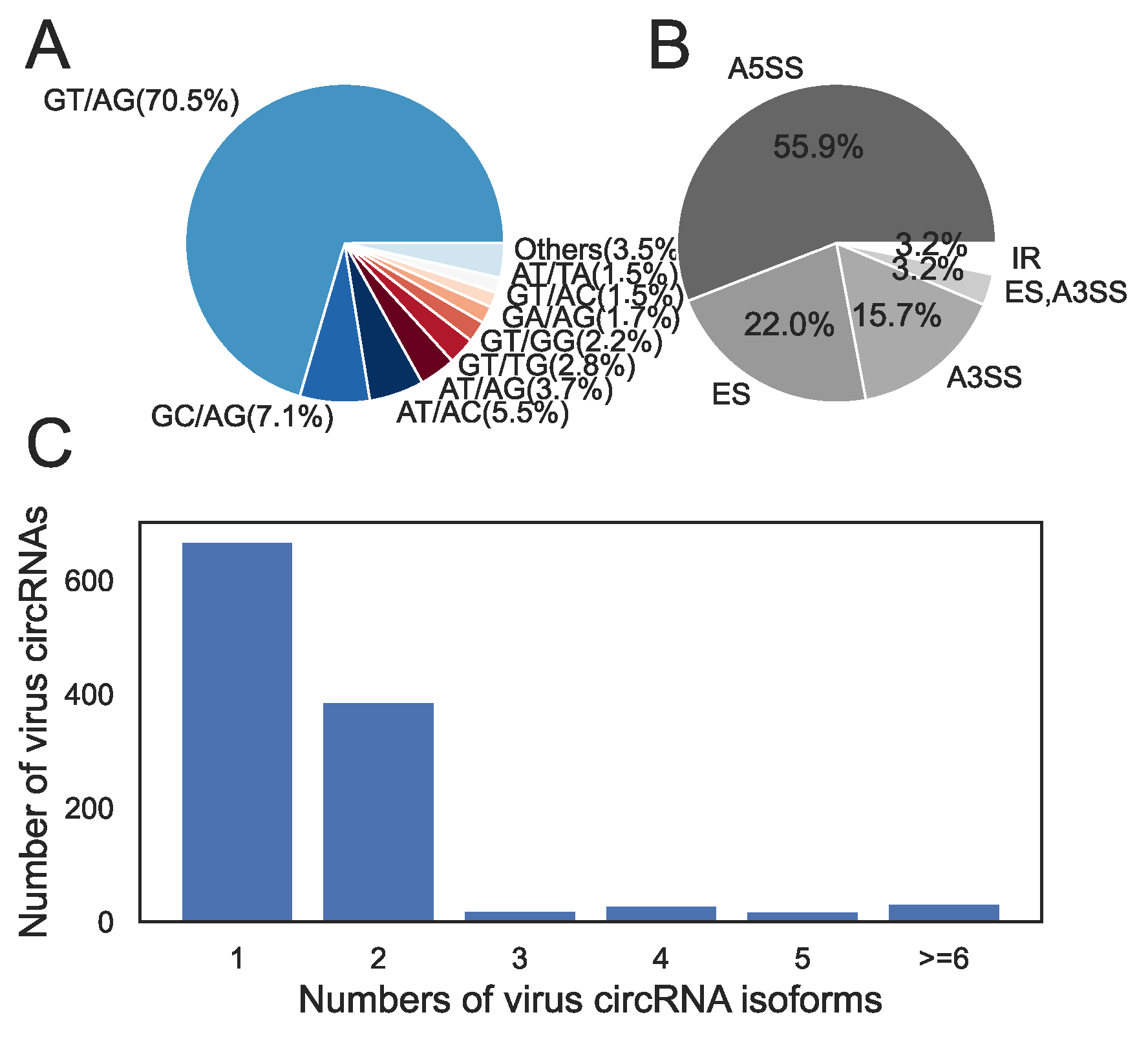 图4. 病毒环状RNA形成机制分析
图4. 病毒环状RNA形成机制分析
05 影响病毒circRNA产生的宿主基因
我们通过计算病毒circRNA的丰度与人类基因表达水平之间的相关性,发现分别有411和755个人类基因与病毒circRNA的产生呈中度正相关或负相关(定义为SCC的绝对值大于或等于0.3)。先前的研究表明,RBPs经常参与circRNA的产生。它们既能促进也能抑制病毒circRNA的生物生成。有趣的是,43个RBP编码基因与病毒circRNA的产生呈中度相关,其中大部分(42/43)呈显著负相关。
功能分析显示,正相关基因富集于有限的功能中,如腺体发育和伤口愈合的生物过程、受体活性和细胞外基质的分子功能。因此,我们重点研究了与病毒circRNA生成负相关的755个基因的功能。这些基因中分别富集了细胞组分(CC)、生物过程(BP)和分子功能(MF)的85、264和26个GO术语,以及14个KEGG通路。CC主要与纺锤体、染色体区、剪接体复合物和核糖体有关(图5A);BP主要与细胞周期和RNA处理有关(图5B);MF主要与催化活性、核酸酶活性、微管蛋白和微管结合有关(图5C);富集的KEGG通路主要与细胞周期、核糖体、COVID-19、剪接体、卵母细胞减数分裂、RNA降解等有关(图5D)。
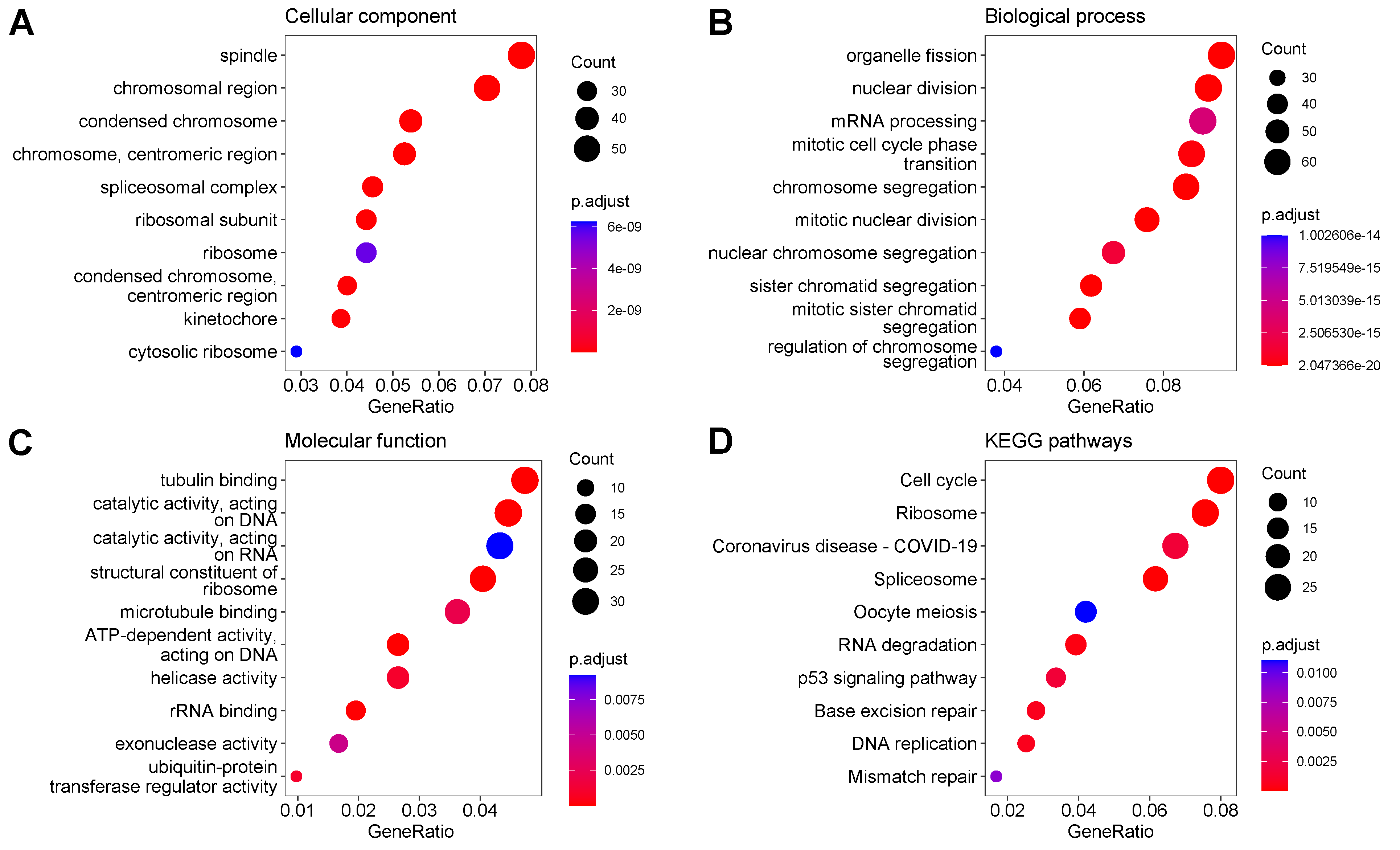 图5. 与病毒circRNA产生呈中等负相关的人类基因富集的结果
图5. 与病毒circRNA产生呈中等负相关的人类基因富集的结果
结论
本研究显著提高了数据库的数据量和功能,从而将数据库重建为VirusCircBase 2.0(http://computationalbiology.cn/VirusCircBase2/#/home)。病毒circRNA的表达分析显示,它们在大多数细胞或组织中的表达水平较低,表现出较强的表达异质性。病毒circRNA的剪接分析显示,它们与动植物相比,使用了更高比例的非经典反向剪接信号,并主要使用了A5SS。大多数病毒circRNA没有超过两个异构体。最后,对与病毒circRNA产生相关的人类基因进行研究发现超过1000个人类基因与病毒circRNA的表达呈中等相关性。其中大多数显示出负相关性,包括42个编码RNA结合蛋白的基因。它们在与细胞周期和RNA加工相关的生物过程中显著富集。总的来说,该研究为进一步研究病毒circRNA提供了有价值的资源,也为病毒circRNA的生物合成机制提供了新的见解。
原文链接:
https://doi.org/10.1080/22221751.2023.2261558
.png)

