环状RNA(circRNA)由一种非经典剪接方式——反向剪接产生,反向剪接位点(BSJ)连接首尾两端成环,与其对应的线性mRNA区分开来。在免疫信号传导、炎症反应和病毒感染期间,circRNA表达模式会发生改变,但其在免疫功能和病毒感染中的调节作用却鲜为人知。目前,circRNA在HIV-1复制中的分子作用机制仍然是一大未解之谜。
牛津纳米孔技术(ONT)测序平台可以实现直接RNA测序(DRS),但目前仅用于捕获聚腺苷酸化转录本。因此,长读长测序技术仅应用于来自逆转录产物的circRNA,而逆转过程的反向剪接和外显子重复会给circRNA表达分析带来复杂性[1]。在病毒感染的背景下,病毒转录本的丰度、融合转录本的产生以及RNA代谢的整体失调可能会掩盖由宿主编码的且丰度较低的RNA,使这类RNA的作用和意义被忽视。所以,探索检测病毒感染期间低丰度RNA(例如circRNA)的新方法十分有必要,为研究病毒感染机制提供新思路。
2023年9月6日,印度科学教育研究所(IISER)生物科学系分子病毒学实验室Ajit Chande博士在Science Advances(IF=13.6)发表文章“HIV-1 Vpr induces ciTRAN to prevent transcriptional repression of the provirus”。作者使用Nanopore测序平台实现DRS,从HIV-1感染的T细胞中捕获circRNA并鉴定了一种调节HIV-1转录的circRNA——ciTRAN。研究发现,HIV-1感染会诱导ciTRAN以Vpr依赖方式进行表达,且ciTRAN与SRSF1相互作用。HIV-1通过ciTRAN从病毒转录复合物中剔除SRSF1,从而促进病毒的有效转录。综上表明,宿主circRNA表达对HIV-1复制的影响是灵长类慢病毒克服传播瓶颈的潜在因素。

直接RNA纳米孔测序检测病毒感染诱导的circRNA
首先,作者通过迭代耗尽线性RNA来去除非circRNA,以富集circRNA至50-86倍,再将poly-A尾巴添加到富集的circRNA中,从而实现DRS。纳米孔DRS不仅能获得circRNA的全长序列,还可以同时检测m6A修饰,以此预测除了IRES外的蛋白质编码circRNA。此外,作者将circDR-seq与CIRI-long和circNICK-LRS进行了比较,证明circDR-seq检测到的circRNA数量相当可观,以天然形式检测到1017个circRNA(其中对照组有831个,病毒感染组有186个),并且还评估了其同时捕获RNA修饰和具备编码潜力的可能性。
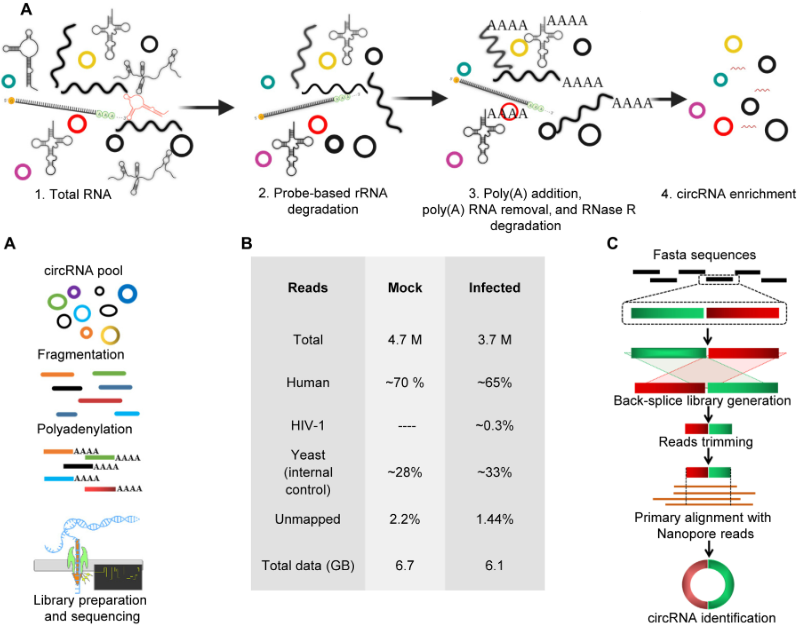 图1 纳米孔DRS解析病毒感染诱导的circRNA
图1 纳米孔DRS解析病毒感染诱导的circRNA
ciTRAN缓解病毒基因表达的整合后阻滞,影响病毒感染性
作者筛选出10种在感染细胞中的表达上调的circRNA,并运用CRISPR-CasRx技术在T细胞中对其进行敲除。实验发现,敲除ciRAN(circSMARCA5)后的细胞在感染HIV-1时其病毒编码的荧光素酶的表达量明显下降,而同源的线性RNA及其蛋白水平在该条件下不受影响。接着,作者从感染细胞中收集亚细胞组分来确定ciTRAN靶向的病毒生命周期阶段,发现敲降ciTRAN对逆转录的HIV cDNA的数量没有变化,整合的前病毒数量也没有变化,而细胞质中病毒mRNA表达水平减少,导致细胞内病毒Gag积累减少。以上表明,ciTRAN耗竭会抑制病毒感染性,对病毒基因表达并整合到宿主基因组的过程有影响。
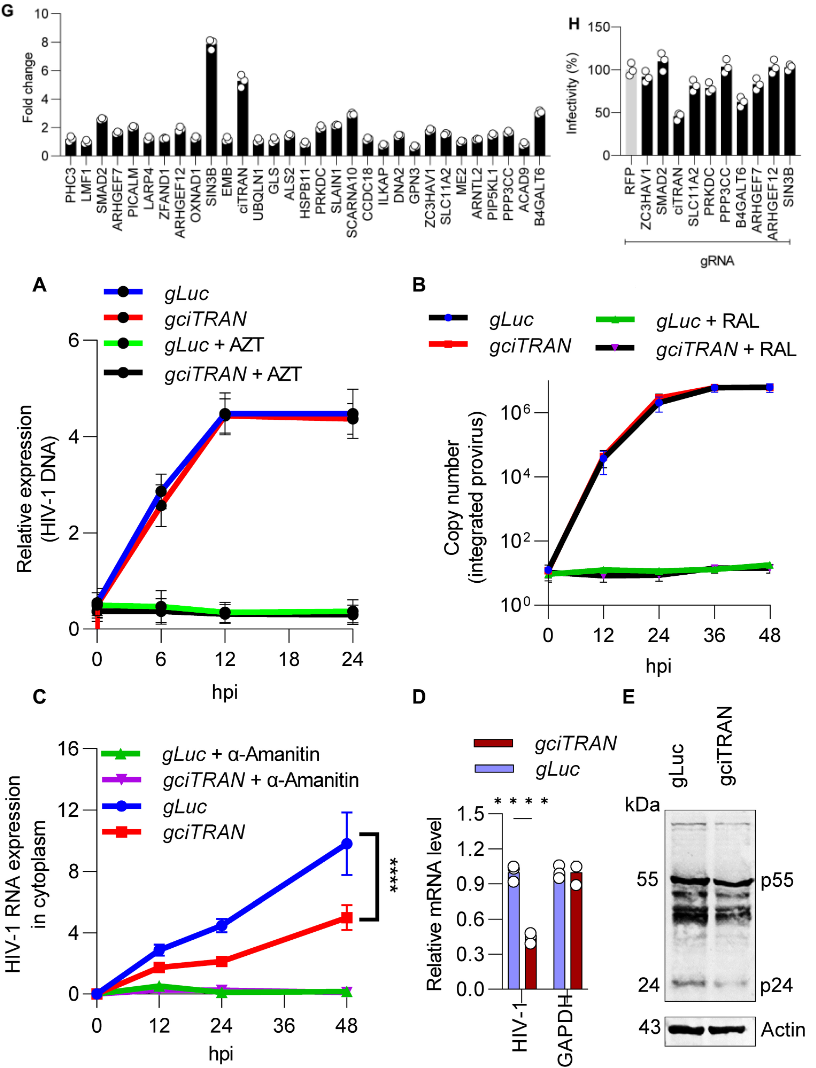 图2 ciTRAN靶向病毒基因表达及整合到宿主基因组的过程
图2 ciTRAN靶向病毒基因表达及整合到宿主基因组的过程
ciTRAN与HIV转录的负调节因子结合
作者运用CARPID和质谱技术,发现SRSF1是ciTRAN的最佳互作分子;通过PAR-CLIP检测与SRSF1互作的circRNA,发现ciTRAN的富集倍数最高,表明ciTRAN可能通过与宿主蛋白SRSF1的相互作用来调节HIV-1转录。接着,评估SRSF1对JTAg靶细胞HIV-1感染性的影响发现,SRSF1异位表达引起的表型和敲除ciTRAN的作用效果一致。通过GFP荧光蛋白测定病毒对细胞感染性,发现SRSF1表达减少会使子代病毒粒子的数量也相应地减少,表明SRSF1在病毒生物发生和随后的子代病毒粒子感染性期间存在影响。综上说明,ciTRAN与HIV-1感染性的负调节因子SRSF1具有相互作用。
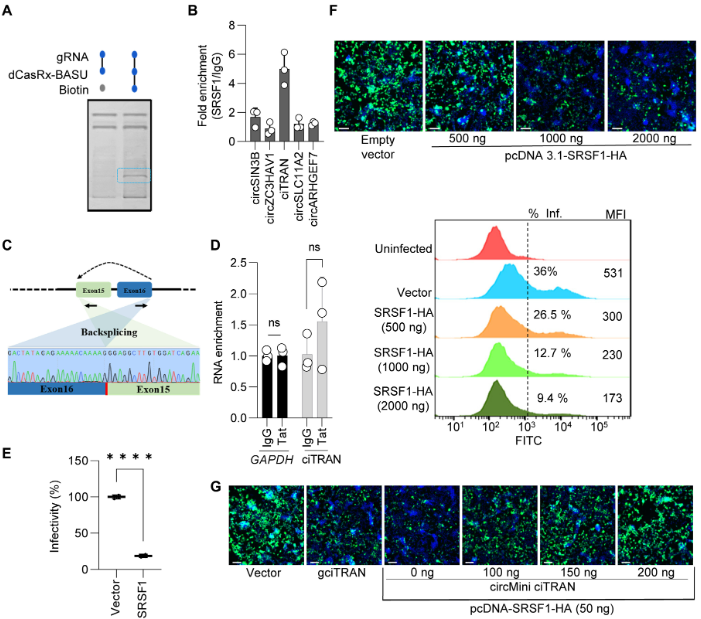 图3 ciTRAN与HIV-1转录的负调节因子相互作用
图3 ciTRAN与HIV-1转录的负调节因子相互作用
ciTRAN通过阻断SRSF1以促进病毒感染性
作者进行了染色质免疫沉淀(ChIP)实验,发现敲降ciTRAN增强了SRSF1与TAR位点的相互作用,这种互作可以将Pol-II从病毒启动子中剔除,表明ciTRAN通过阻断SRSF1来促进病毒启动子的主动转录。接着,作者运用PAR-CLIP技术评估多个SRSF1片段缺失突变体与ciTRAN的相互作用,发现当SRSF2的RRM1区域被删除时,ciTRAN不再有任何富集,而且ciTRAN和ΔRRM2突变体之间丧失相互作用,病毒感染性增加。
作者通过细胞穿膜肽(CPP)融合的RRM2-HA检测特定SRSF1蛋白结构域的作用,证明了SRSF1-RRM2与TAR基因座和ciTRAN的结合作用,并因此抑制病毒复制,而SRSF1-RRM1无该作用。综上表明,SRSF1的RRM2区域识别ciTRAN并与之互作,以抑制病毒复制。
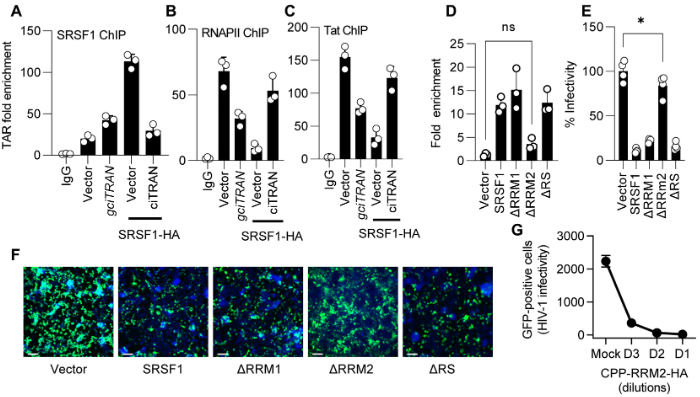 图4 ciTRAN通过阻断SRSF1来促进HIV-1转录
图4 ciTRAN通过阻断SRSF1来促进HIV-1转录
HIV-1 Vpr诱导ciTRAN表达
作者使用RT-qPCR对健康供体和艾滋病毒感染者的全血检测ciTRAN水平,发现自然感染的平均ciTRAN诱导率为5.6倍,而病毒诱导ciTRAN的表达水平高达10倍。而且,只有HIV-1病毒能诱导ciTRAN上调,小鼠白血病病毒MLV则诱导无效。通过RT-qPCR检测缺乏特定病毒基因对ciTRAN表达水平的影响,发现ciTRAN水平在病毒缺乏Vpr时明显降低,而在其他条件下几乎没有变化;在原代CD4细胞中重复该实验,进一步证实了病毒编码的Vpr蛋白对ciTRAN的表达具有诱导作用。
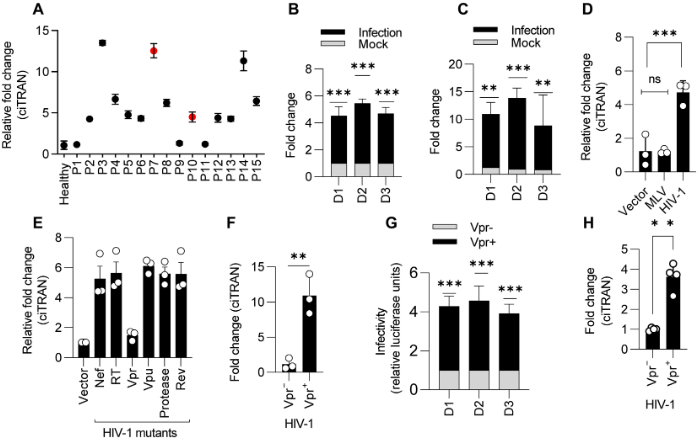 图5 HIV-1 Vpr诱导ciTRAN表达
图5 HIV-1 Vpr诱导ciTRAN表达
Vpr对ciTRAN的诱导作用具有保守性
作者分别转染了NL4-3、CH040和REJO病毒中编码代表性Vpr等位基因的pCDNA后,发现均能显著诱导ciTRAN表达,而来自HIV-2的Vpx却不能诱导ciTRAN表达。此外,Vpr诱导ciTRAN有助于增强感染性,还可以增强巨噬细胞中的病毒复制。病毒粒子包装的Vpr也可以诱导ciTRAN表达,且呈剂量依赖性。这些结果表明,HIV-1 Vpr是诱导ciTRAN表达所必需的。
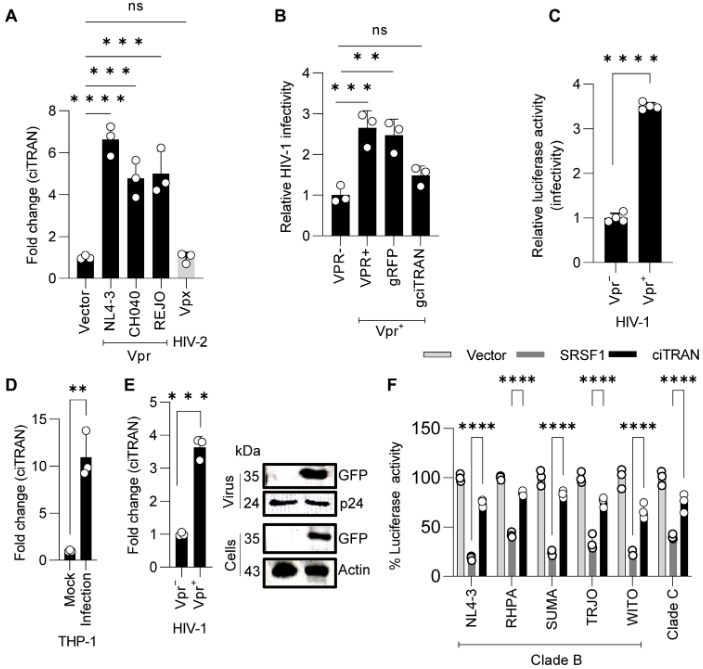 图6 HIV-1 Vpr在诱导ciTRAN表达中具有保守性
图6 HIV-1 Vpr在诱导ciTRAN表达中具有保守性
Ajit Chande博士
“我们的研究结果表明,HIV-1病毒劫持了这种宿主编码的ciTRAN,使其能够有效地繁殖。这一发现揭示了HIV-1等病毒如何克服传播障碍的未知方面。”
IISER Bhopal主任Gobardhan Das教授
“这项工作开辟了新的研究领域,可能为宿主导向治疗提供新的线索。”
这项研究的另一个重要结果是,研究人员开发了一种小分子蛋白,可以在病毒诱导的ciTRAN中抑制病毒转录。通过展示ciTRAN如何促进病毒有效繁殖的能力,这项研究为开发新的治疗干预措施提供了有希望的途径。此外,能够抑制病毒转录的分子的产生,代表了我们对抗HIV-1和潜在的其他病毒的理解的重大飞跃。
小结:
本文为我们提供了一种纳米孔测序检测环状RNA的新策略,使用特定算法实现对长测序片段中的circRNA序列进行识别和全长重构,进而解析circRNA的功能作用。更多策略可以参考之前的文章:环状RNA十周年丨测序技术篇
原文链接:
https://www.science.org/doi/10.1126/sciadv.adh9170
参考文献:
[1] J. Zhang, L. Hou, Z. Zuo, et al., Comprehensive profiling of circular RNAs with nanopore sequencing and CIRI-long. Nat. Biotechnol. 39, 836–845 (2021).
.png)
