RNA治疗是一种基于RNA分子治疗或预防疾病的有效方法。目前,最常见的RNA治疗方法是将修饰后的mRNA引入细胞,mRNA被翻译成蛋白质并发挥作用。虽然mRNA疗法的治疗效果非常强,但它的线性结构使其非常不稳定,容易降解。最近的研究表明,一种更稳定的RNA分子环状RNA(circRNA)可以编码蛋白质,这无疑为RNA治疗提供了更好的选择。
近年来,circRNA被发现可以编码功能性小蛋白并发挥一定的功能。如circSHPRH被发现编码146个氨基酸的蛋白,保护SHPRH蛋白不被泛素蛋白酶降解[1]。此外,一种由AKT3环状RNA编码的新型肿瘤抑制蛋白(AKT3-174aa)可抑制胶质母细胞瘤的致瘤性[2]。circRNA的稳定结构及其编码功能蛋白的能力无疑可以在RNA治疗中替代线性mRNA的地位。
2023年8月31日,上海海洋大学徐田军教授团队在Cell Death & Disease(IF=9.0)发表文章“CircMIB2 therapy can effectively treat pathogenic infection by encoding a novel protein”。作者发现circMIB2可以通过m6A修饰来翻译蛋白质MIB2-134aa。MIB2-134aa可以与MIB2竞争结合TRAF6,从而减弱MIB2对TRAF6的降解作用,增强先天免疫应答,显著抑制鳗弧菌(V. anguillarum)在斑马鱼体内的定殖。与mRNA治疗相比,circRNA治疗具有免疫原性低、稳定性高、疗效持续时间长等优点。作者的研究首次为circRNA疗法在经济鱼致病性疾病治疗中的应用提供了参考。
circMIB2的表征
首先,作者将SCRV病毒转导进鮸鱼体内,通过RNA-seq分析发现,与未处理组相比,circMIB2差异表达并具有编码潜力。同时,作者也发现经SCRV病毒和鳗弧菌处理的鮸鱼脾脏组织中,circMIB2和MIB2的表达水平均显著上调。通过琼脂糖电泳以及RNase R进一步验证了circMIB2的环状结构。然后作者发现circMIB2的表达量在MSpC细胞中最高,在MIC细胞中最低。RNA FISH检测发现circMIB2主要分布在细胞质中,且被鳗弧菌感染后,circMIB2的含量显著增加。这些结果表明circMIB2是一种稳定的circRNA,主要表达并分布于细胞质中(如图1)。
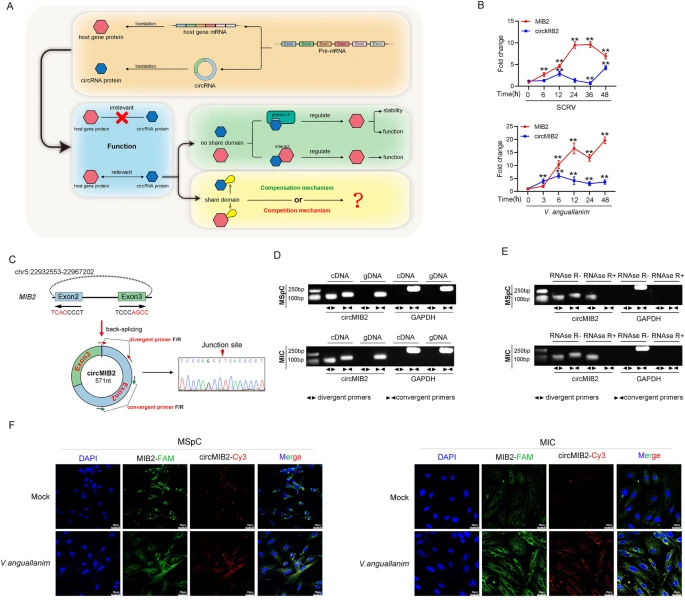 图1 circMIB2的表征
图1 circMIB2的表征
circMIB2编码一个134个氨基酸(aa)的新蛋白MIB2-134aa
作者通过ORF预测发现circMIB2可以编码一个134aa的蛋白,并且有一个m6A修饰位点。将野生型和m6A位点突变的circMIB2质粒分别转染到MSpC细胞中,发现野生型质粒表达的MIB2-134aa蛋白显著高于突变型质粒,说明circMIB2上可能确实存在m6A修饰。为了进一步验证circMIB2可以编码蛋白,作者将过表达circMIB2的质粒和体外制备合成的circMIB2分别转染到MIC细胞内,通过LC-MS分析和WB检测证明circMIB2可以编码MIB2-134aa蛋白;且IF结果显示MIB2-134aa蛋白主要分布在细胞质中。此外,作者还发现MSpC细胞在感染SCRV或鳗弧菌的情况下,MIB2-134aa蛋白的表达会显著增加。上述结果表明circMIB2编码MIB2-134aa蛋白,该蛋白在SCRV或鳗弧菌感染宿主过程中发挥了非常重要的作用(如图2)。
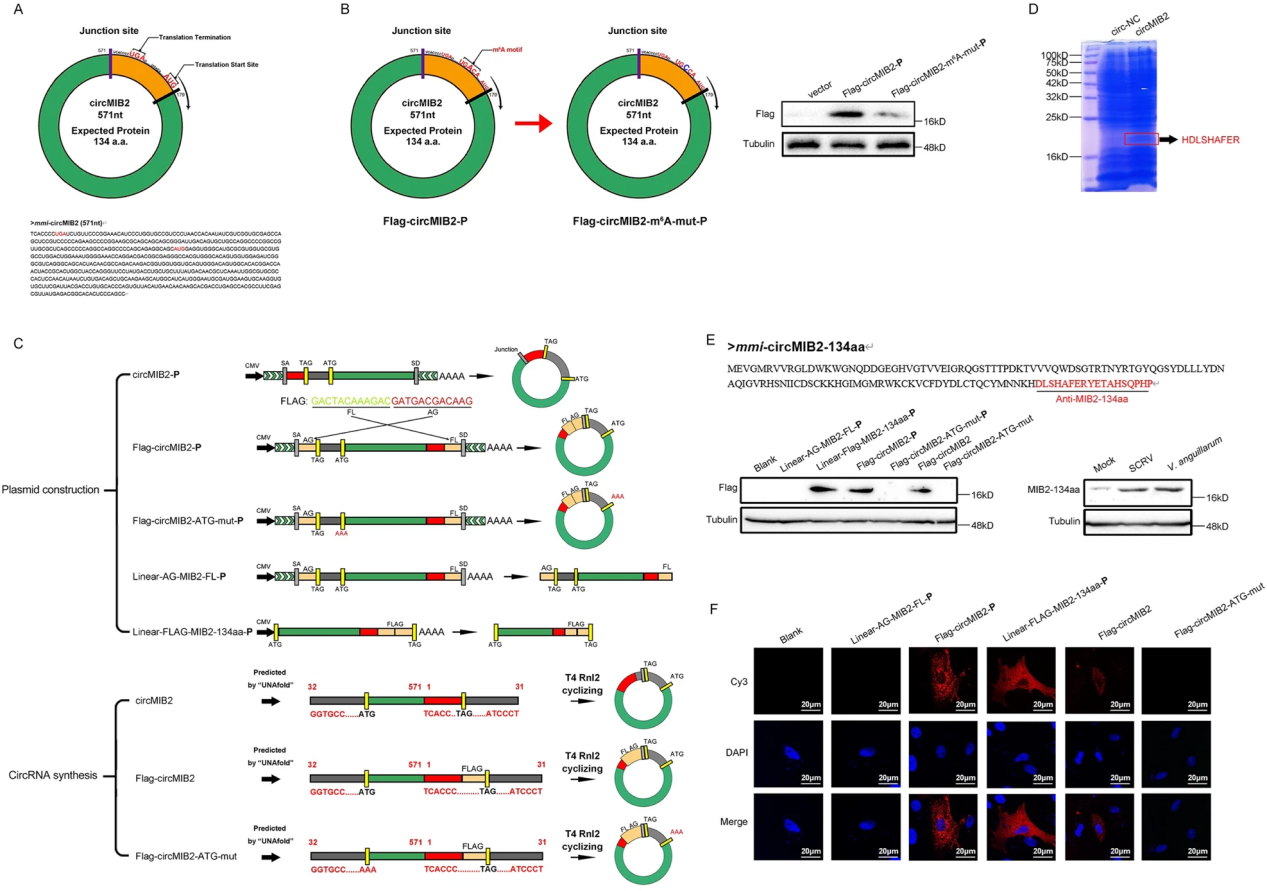 图2 circMIB2编码一个134个氨基酸(aa)的蛋白MIB2-134aa
图2 circMIB2编码一个134个氨基酸(aa)的蛋白MIB2-134aa
circMIB2和MIB2-134aa促进宿主先天免疫
接着,作者设计了靶向circMIB2的siRNA并转染到MSpC细胞内,结果显示siRNA可以明显降低circMIB2的表达水平,但是不会影响MIB2 mRNA的表达。通过qPCR分析发现过表达circMIB2会显著提高ISG15,TNFα和IL-8的表达水平。结果表明circMIB2参与了SCRV或鳗弧菌引起的先天免疫应答。此外,作者发现circMIB2的沉默显著促进了SCRV的复制。采用平板计数法进一步证实circMIB2可以显著抑制鳗弧菌侵袭MIC细胞。随后作者通过双荧光素酶报告系统检测了鱼类抗病毒和抗菌信号通路的主要基因,结果表明,MIB2-134aa主要通过影响TRAF6的活性来促进IRF3、ISRE、NF-κB等基因的活性。作者还发现在转染circMIB2后,SCFV感染后CPE(细胞病变效应)显著降低。综上所述,MIB2-134aa可通过靶向TRAF6蛋白促进TRAF6介导的先天免疫应答(如图3)。
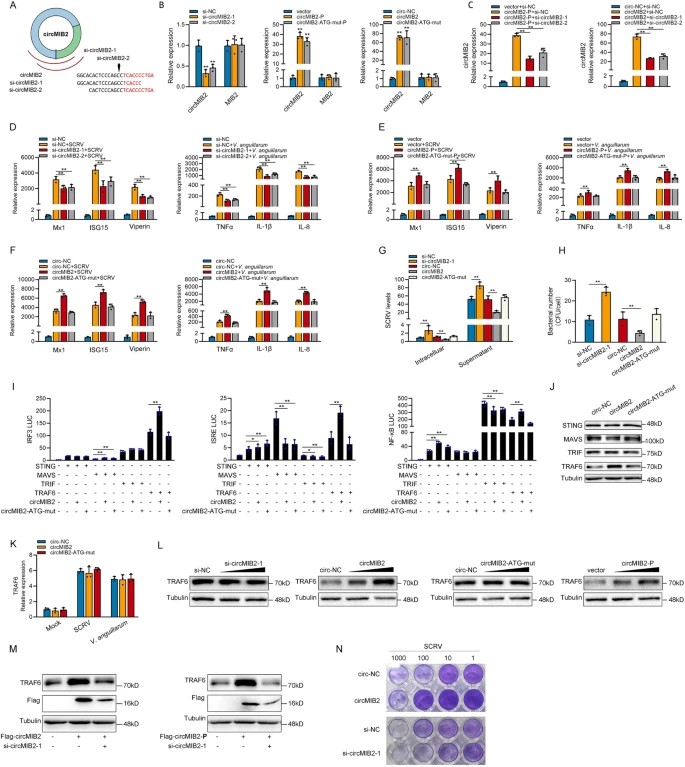
图3 MIB2-134aa促进宿主先天免疫
宿主基因MIB2抑制宿主先天免疫
由于MIB2-134aa和MIB2蛋白有两个相同的结构域,因此作者认为两者之间存在一定的联系。作者设计了针对MIB2的siRNA,WB和qPCR检测发现si-MIB2明显降低了MSpC细胞中MIB2蛋白水平和mRNA水平,并显著提高TRAF6蛋白表达水平。qPCR检测发现过表达circMIB2会显著抑制ISG15,TNFα和IL-8的表达水平。接着作者通过双荧光素酶报告实验证实MIB2主要通过影响TRAF6的表达来抑制IRF3、ISRE、NF-κB、IL-1β等基因的活性。此外,MIB2的过表达显著促进了SCRV的复制。且在SCRV感染条件下,敲除MIB2后,CPE显著降低,而转染circMIB2则导致CPE显著升高。综上所述,MIB2可以通过促进TRAF6蛋白的降解来抑制TRAF6介导的先天免疫反应,而MIB2-134aa与MIB2具有相反的功能(如图4)。
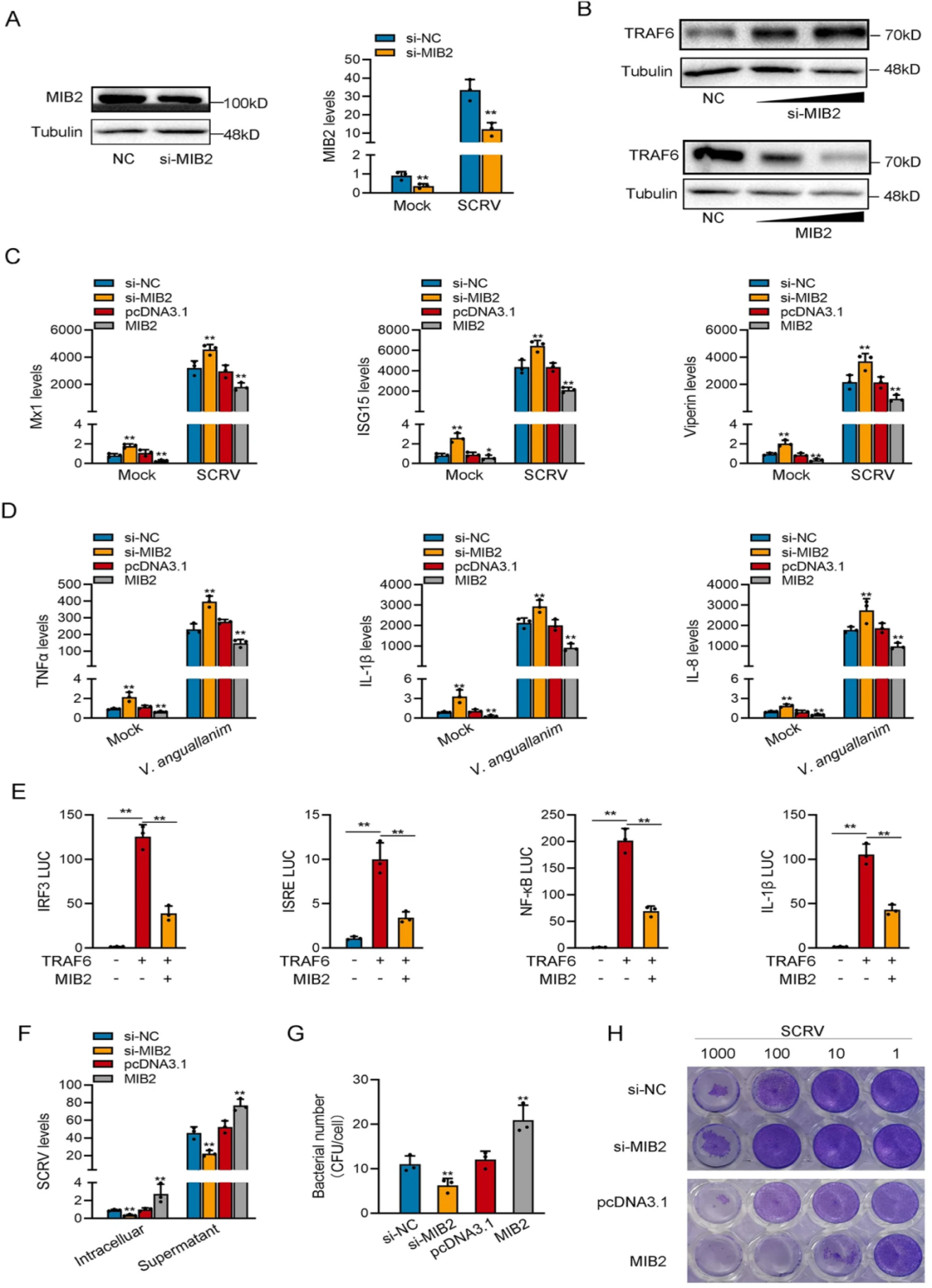 图4 MIB2抑制宿主先天免疫
图4 MIB2抑制宿主先天免疫
MIB2-134aa与MIB2竞争结合TRAF6来调控泛素化
为了确定MIB2-134aa和MIB2通过什么途径调控TRAF6降解。作者通过WB发现过表达MIB2会削弱TRAF6蛋白的稳定性,而MIB2-134aa的作用正好相反。作者发现MIB2-134aa与TRAF6以及MIB2与TRAF6之间在细胞内的共定位程度非常高。由此构建了MIB2缺失1-132aa质粒,转染后发现TRAF6与MIB2的结合能力在该结构域被删除后显著下降。随后免疫沉淀证明MIB2与TRAF6或circMIB2与TRAF6均会发生相互作用。此外,作者将Flag-MIB2和MIB2-134aa质粒共转染到细胞内,发现MIB2-134aa和MIB2可以竞争结合TRAF6蛋白。最后,作者发现在泛素(ubiquitin)野生型和泛素(ubiquitin-K11)突变型质粒转染细胞后,MIB2介导的TRAF6泛素化显著增加。综上所述,MIB2介导k11连接的泛素化,这两个结构域是MIB2与TRAF6相互作用的关键(如图5)。
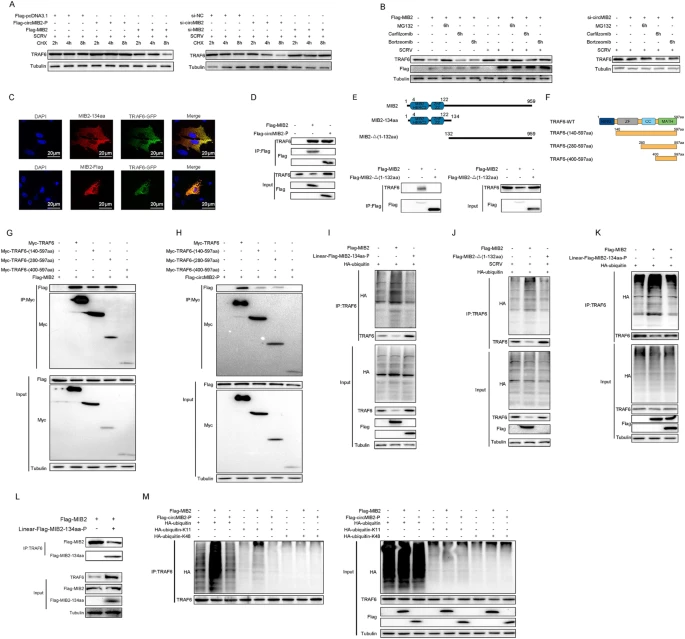
图5 MIB2-134aa与MIB2竞争结合TRAF6来调节泛素化
m6A修饰介导circMIB2翻译蛋白
通过生信预测,作者发现circMIB2上不存在IRES序列,只有一个m6A修饰位点。通过共转染实验,结果表明促甲基化酶修饰相关基因METTL14、METTL16、YTHDF1和YTHDF3能够显著提高MIB2-134aa蛋白的表达;而去甲基化酶修饰基因ALKBH5可以显著降低MIB2-134aa蛋白的表达。MeRIP-qPCR实验表明过表达METTL14和METTL16均显著增加了circMIB2 mRNA的m6A水平。pull down和RIP实验发现circMIB2可以富集YTHDF1、YTHDF3蛋白,YTHDF1和YTHDF3也能显著富集circMIB2,但m6A位点突变体circMIB2不能富集YTHDF1、YTHDF3蛋白。综上所述,circMIB2可以通过m6A修饰介导蛋白质的翻译(如图6)。
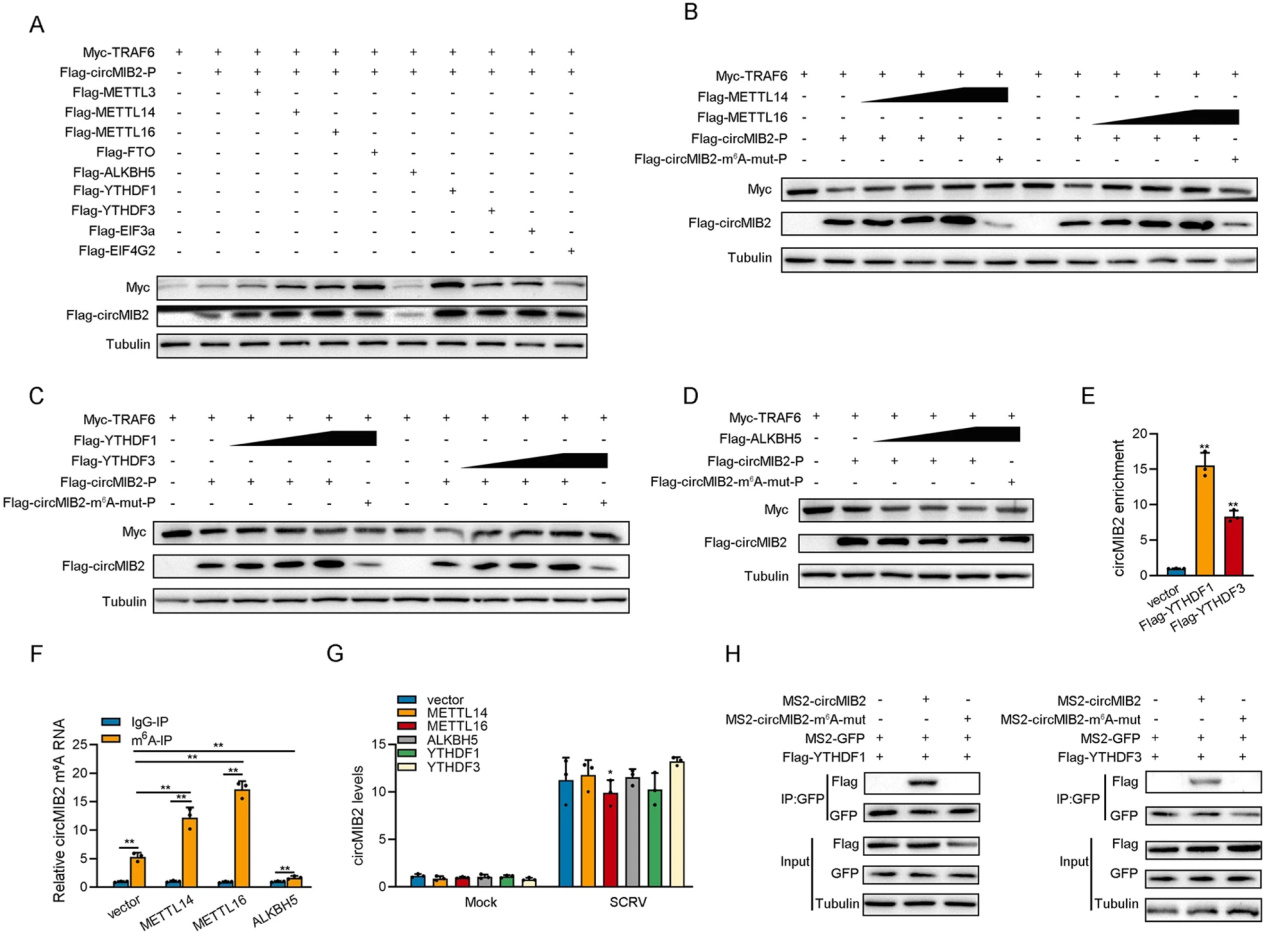 图6 N6-甲基腺苷修饰介导circMIB2翻译蛋白
图6 N6-甲基腺苷修饰介导circMIB2翻译蛋白
circMIB2可促进斑马鱼的先天免疫反应并抑制鳗弧菌的定植
作者选择斑马鱼来验证circMIB2的先天免疫应答是否在鱼类中具有普适性。将表达circMIB2的质粒经脂质体包裹后注射到斑马鱼腹腔内,发现在斑马鱼的肝脏、脾脏和肾脏中成功表达了MIB2-134aa蛋白;并且在注射24h后感染鳗弧菌,circMIB2的表达量显著增加。同时,circMIB2可以显著促进鳗弧菌感染的斑马鱼细胞中IL-6、IL-1β、TNFα的表达。此外,作者发现circMIB2能显著抑制鳗弧菌在肝脏和脾脏上的定殖。而注射circMIB2的斑马鱼能有效抵抗鳗弧菌的入侵。综上所述,circMIB2的circRNA治疗能显著抑制鳗弧菌对斑马鱼的感染,促进斑马鱼的先天免疫应答(如图7)。
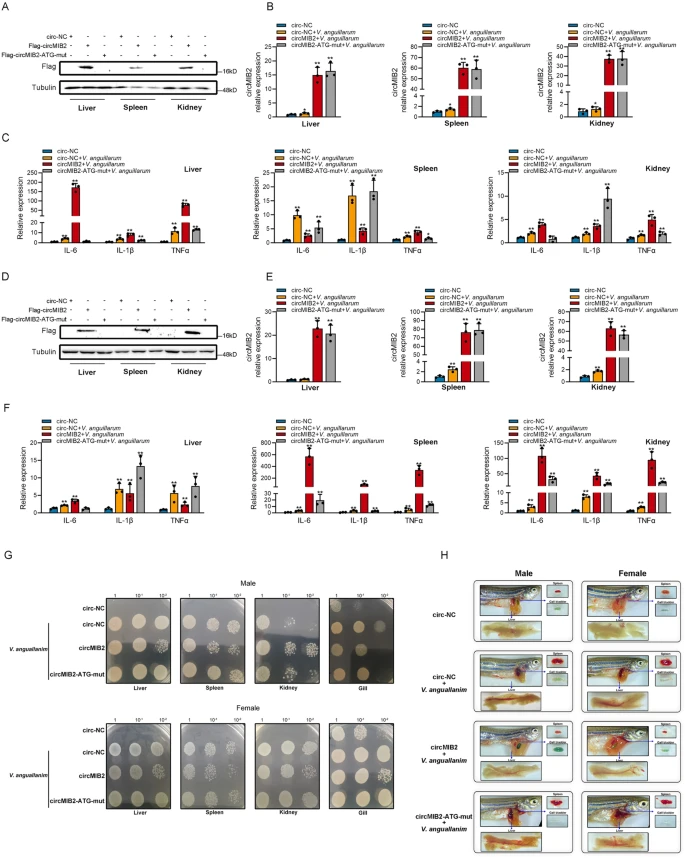
图7 CircRNA治疗circMIB2可促进斑马鱼的先天免疫反应并抑制鳗弧菌的定植
总结
本研究在低等脊椎动物鱼类中发现了一种来源于E3泛素蛋白连接酶MIB2基因的新型环状RNA(circMIB2),该环状RNA可通过m6A修饰转化为134个氨基酸的蛋白(MIB2-134aa),并参与先天免疫。MIB2-134aa与宿主基因MIB2蛋白两个结构域的氨基酸序列完全一致;宿主基因MIB2可以通过这两个结构域靶向TRAF6,通过促进TRAF6的泛素化降解来抑制先天免疫应答,而MIB2-134aa的作用则相反。更重要的是,circMIB2治疗可以显著抑制鳗弧菌在斑马鱼体内的定殖,这为鱼类致病性疾病的治疗提供了新的方向。
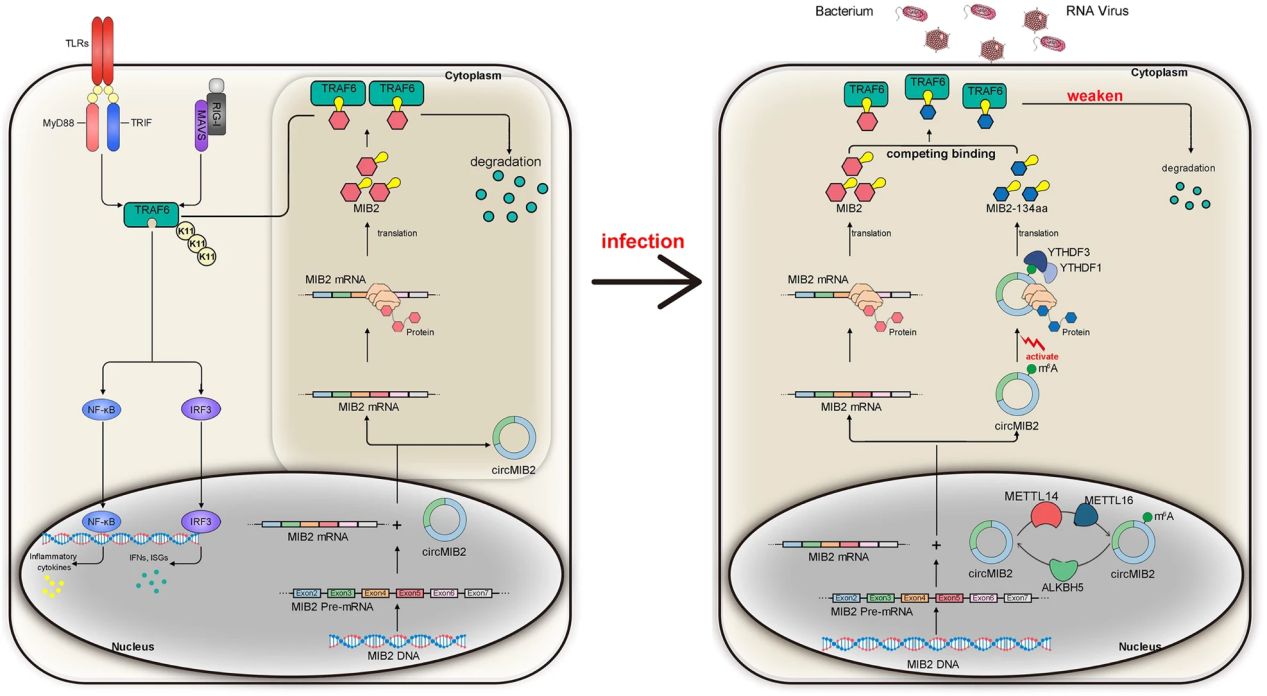 图8 MIB2-134aa与MIB2竞争结合TRAF6调控泛素化的机制示意图
图8 MIB2-134aa与MIB2竞争结合TRAF6调控泛素化的机制示意图
原文链接:
https://doi.org/10.1038/s41419-023-06105-3
参考文献:
[1] Zhang M, Huang N, Yang X, Luo J, Yan S, Xiao F, et al. A novel protein encoded by the circular form of the SHPRH gene suppresses glioma tumorigenesis. Oncogene. 2018;37:1805–14.
[2] Xia X, Li X, Li F, Wu X, Zhang M, Zhou H, et al. A novel tumor suppressor protein encoded by circular AKT3 RNA inhibits glioblastoma tumorigenicity by competing with active phosphoinositide-dependent Kinase-1. Mol Cancer. 2019;18:1–16.
.png)
