本期特邀文章第一作者伍紫娟博士分享解读,感谢对circRNA平台的关注!
慢淋(CLL,chronic lymphocytic leukemia)是一种血液系统恶性肿瘤,具有高度的代谢异质性。虽然已经有报道表明m6A能通过调控环状RNA分子参与代谢通路,但该过程在CLL仍有待进一步研究。
2023年10月11日,南京医科大学第一附属医院李建勇/范磊/金晖教授团队在ADVANCED SCIENCE(IF:15.1)发表了的研究论文“m6A-Modified circTET2 Interacting with HNRNPC Regulates Fatty Acid Oxidation to Promote the Proliferation of Chronic Lymphocytic Leukemia”。
文章第一作者为南京医科大学第一附属医院血液内科伍紫娟博士,部分生物信息学分析和生物实验由吉赛生物提供支持。
文章要点
- 根据53例CLL转录组数据以及临床信息搭建 m6A scoring system,并构建了m6A相关的 circRNA预后Signature;
- CLL患者中高表达circTET2预后差;核质转运受到m6A水平影响;circTET2生物合成受RNA 结合蛋白(RBP)RBMX和YTHDC1调控;
- circTET2通过结合HNRNPC蛋白质调控CPT1A mRNA的稳定性,并且参与CLL细胞的脂肪酸氧化(FAO,fatty acid oxidation)和mTORC1通路介导的细胞增殖过程;
- circTET2临床转化相关探索中,该环状RNA丰度受到剪切体抑制剂CP028影响,其联合mTOR抑制剂Dactolisib和FAO抑制剂Perhexiline具有协同杀伤CLL细胞的效果。

该课题同期在美国举行的第20届国际慢性淋巴细胞白血病研讨会(iwCLL)上由金晖教授进行口头汇报,并获得各专家一致认可。南京医科大学第一附属医院李建勇/范磊/金晖教授团队主要研究方向为淋巴增殖性疾病,包括慢性淋巴细胞白血病诊断、鉴别诊断、预后相关因素、发病机制及临床治疗研究。擅长利用多参数流式细胞术、荧光原位杂交技术及分子生物学技术对恶性血液病诊断分型、预后判断、病情监测,并根据患者的临床生物学特征采取个体化治疗策略,处于国际领先水平。
以下是文章内容的详细解读
1、CLL中m6A修饰相关基因临床意义;根据m6A修饰相关circRNA构建风险模型
为了确定m6A修饰在CLL中的意义,作者对53名初诊CLL患者进行了全转录组测序。
作者首先分析了34个m6A writer、reader和eraser调节因子的转录组图谱,包括m6A调节因子的表达模式及对应关系(图1A~B)。后续基于m6A调控子的表达以及临床特征,作者构建了m6Sig评分(图1C)。m6Sig评分显示出其对预后的潜在预测价值,m6Sig评分低的患者具有显著较好的生存预后(图1D);公共CLL数据集GSE22762亦得到一致结果(图1E)。作者进一步利用m6A相关circRNA构建风险模型,筛选相关系数大于0.5的circRNAs(图1F,G)。CLL患者根据风险评分被分为低风险组和高风险组。最终选择了八个与m6紧密相关的circRNAs(circTET2、circUBE2I、circPRDM2、circMGA、circUSP34、circSIN3A、circSLC39A10和circFTO)(图1H)。我们注意到,与低风险组相比,高风险组的患者OS更短(图1I),CLL患者的风险评分也显示出较高的AUC值(图1J)。
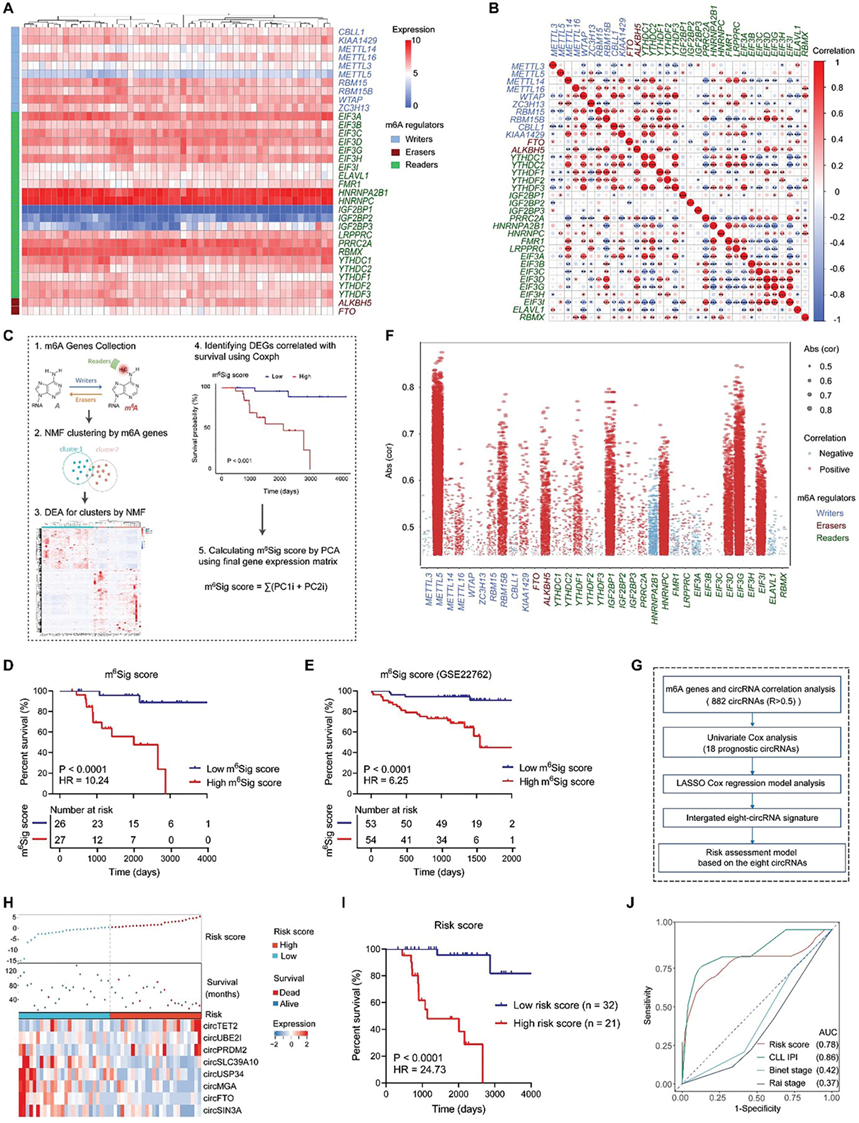 图1. CLL中的m6A修饰和m6A相关circRNA构建的风险模型
图1. CLL中的m6A修饰和m6A相关circRNA构建的风险模型
2、m6A修饰的circTET2与CLL患者预后相关
circTET2的风险评分在模型中排名第一。CircBank数据库显示,circTET2、circPRDM2和circSLC39A10表现出更高的m6A水平(图2A)。利用MeRIP-seq来探索CLL细胞系中m6A的修饰情况。一部分m6A 峰分布在编码序列(CDS)、3′非翻译区(UTR)、5′UTR和ncRNA外显子(图2B)。AAAC被检测为细胞中的主要motif(图2C)和m6A峰富集在CDS,尤其是在起始密码子附近(图2D)。circTET2和circPRDM2的m6A峰在m6A组中比在IgG组中更丰富(图2E)。因此,作者选择了具有最高风险评分circTET2 继续研究,通过RIP-qPCR确认了其存在m6A修饰(图2F)。生存分析显示,circTET2表达较高的患者OS要短得多(图2G)。后续作者总结了患者临床特征,并观察到circTET2的表达与NOTCH1和TP53突变显著相关(图2H)。
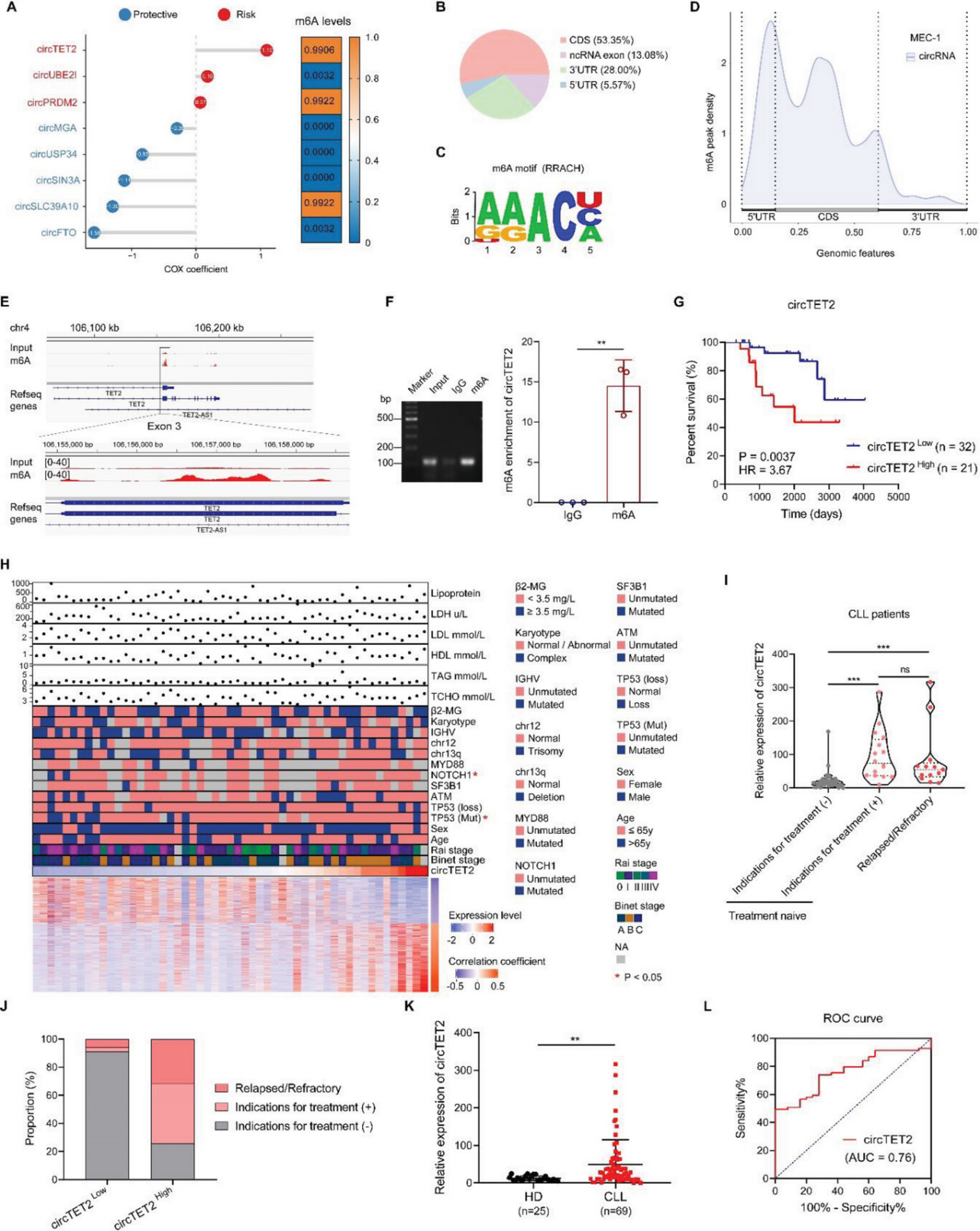 图2. m6A修饰的circTET2在CLL中上调,与患者预后有关
图2. m6A修饰的circTET2在CLL中上调,与患者预后有关
3、circTET2在CLL中的特征刻画
Divergent primer被设计用于扩增位于chr4q24上的circTET2;Sanger测序验证了外显子3的头尾剪接(图3A);Northern印迹(图3B)、RNase R处理(图3C,D)和放线菌素D实验(图3E)证明了circTET2 的环形特征。核质分离(图3F)和FISH(图3G)实验显示circTET2主要位于细胞质中。为了探讨circTET2的表达和定位是否受到m6A修饰的影响,作者用去甲基化酶抑制剂FB23-2处理细胞。FB23-2处理后,细胞中的m6A水平升高,而circTET2表达没有显示出显著变化(图3H,I)。然而,circTET2在细胞核中大量分布(图3J–L)。这些发现表明m6A修饰通过控制circTET2的核质分布进而影响其功能作用。
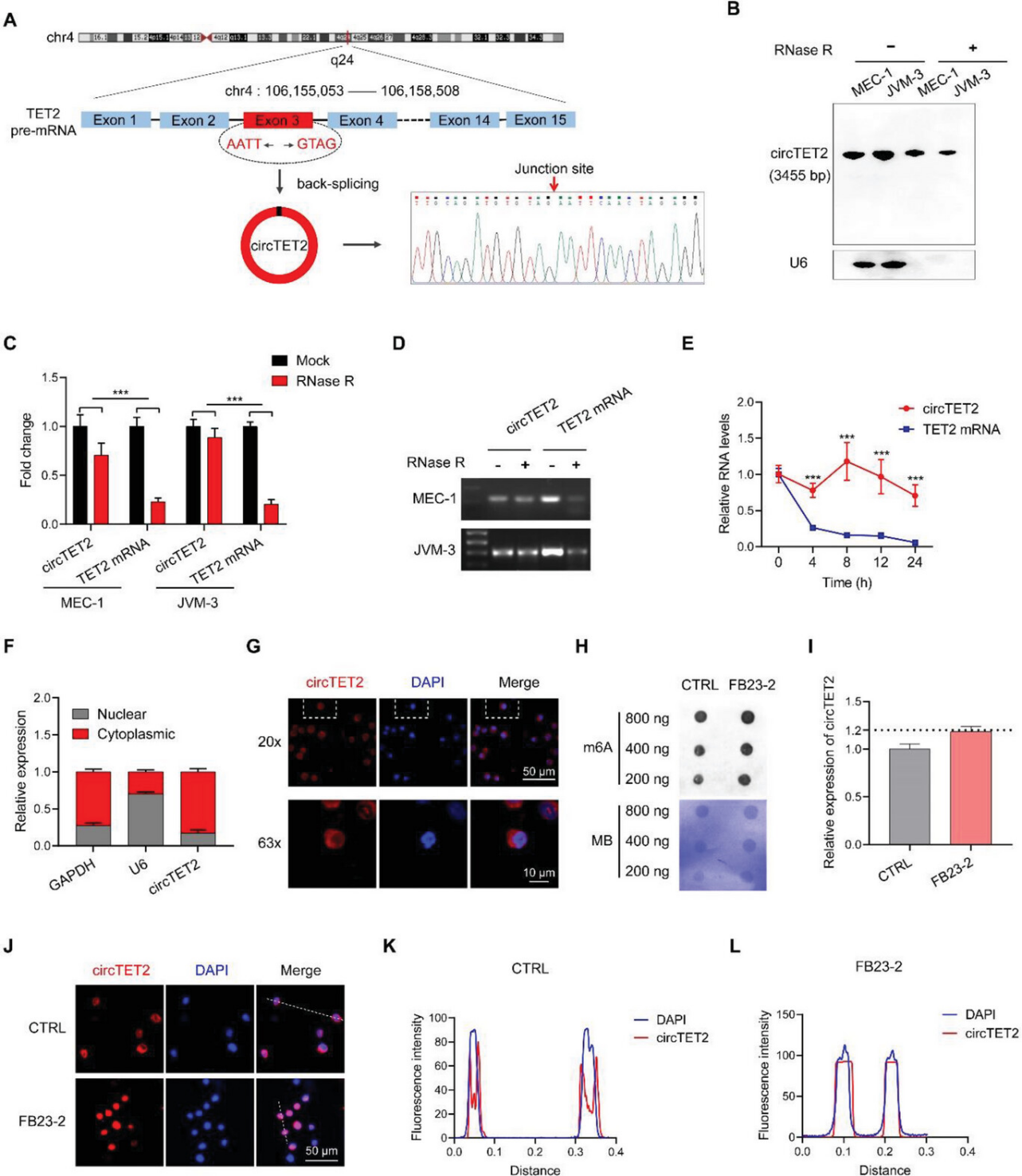 图3. circTET2在CLL中的特征刻画
图3. circTET2在CLL中的特征刻画
4、RBMX和YTHDC1调控circTET2的生物合成
CircRNA被认为是一种非常规的选择性剪接产物,RBPs可以与circRNA的侧翼内含子结合,从而作为剪接因子。为了调查该过程中涉及的潜在RBP,作者使用了catRAPID和RBPBD两个数据库(图4A)。在18个预测的RBPs中,作者发现剪接因子RBMX和YTHDC1与circTET2的侧翼序列结合;通过设计的shRNA来敲低RBMX,显著抑制了circTET2的表达(图4B,C)。通过catRAPID获得RBMX在侧翼内含子上的结合位点(a,b,c,d)(图4D),RIP-qPCR分析显示RBMX主要是在b、c和d位点上结合(图4E)。YTHDC1是RBMX的相互作用伙伴,据报道其可影响甲基化后的mRNA和circRNA的核输出。免疫共沉淀(Co-IP)分析验证了RBMX和YTHDC1之间的相互作用(图4F),YTHDC1沉默削弱了circTET2的表达(图4G,H)。然而,在敲掉YTHDC1后,并没有观察到circTET2位置的变化(图S5)。当评估CLL患者的RBMX和YTHDC1水平时,我们可以观察到YTHDC1与RBMX或circTET2之间以及circTET2 RBMX之间呈正相关(图4I,K)。
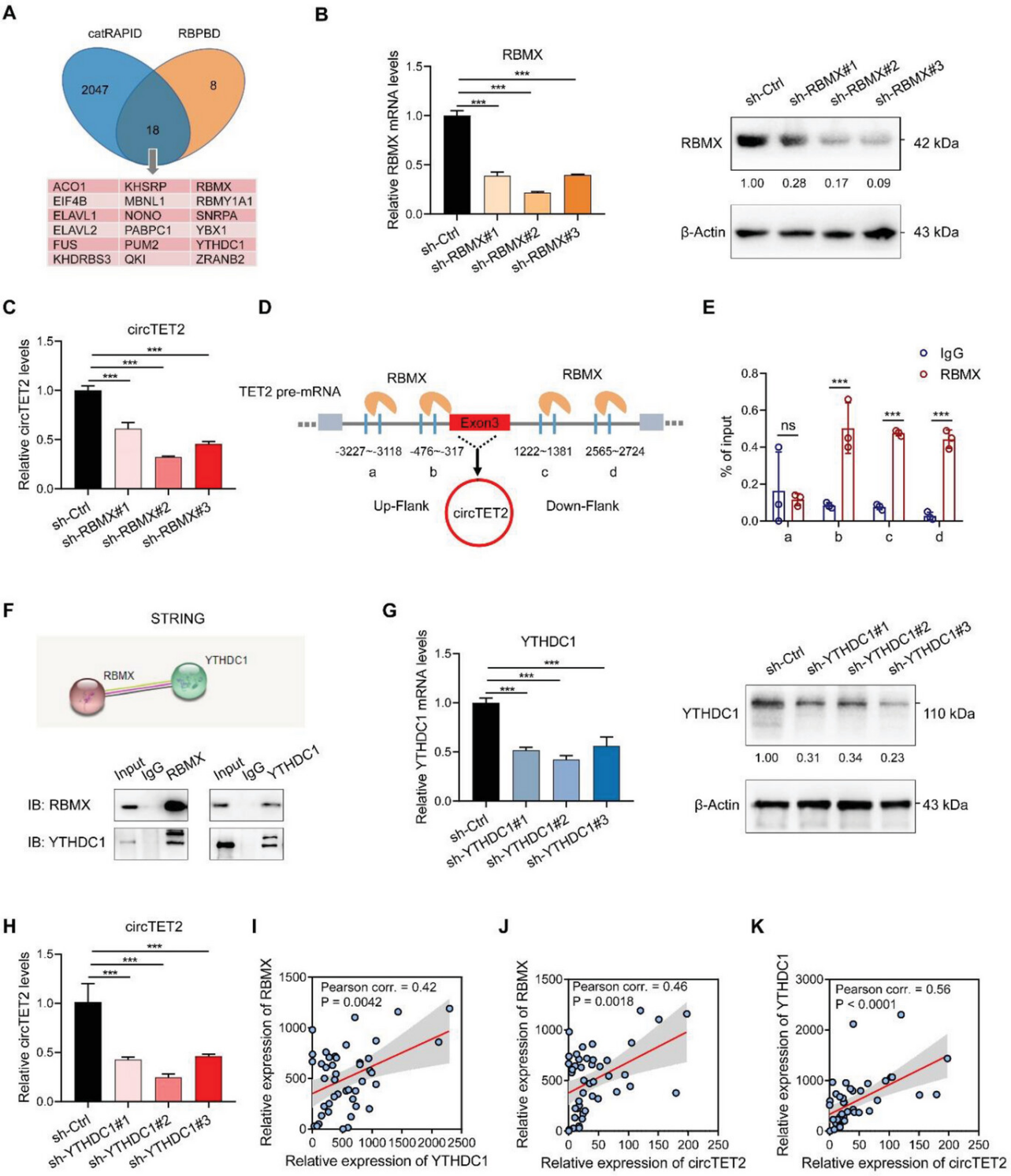 图4. RBMX和YTHDC1调控circTET2的生物合成
图4. RBMX和YTHDC1调控circTET2的生物合成
5、促进细胞增殖的circTET2参与mTORC1信号通路和脂质代谢的调节
为了探索circTET2在CLL中的作用,作者对circTET2 相关基因进行了基因集富集分析(GSEA),结果显示circTET2参与PI3K-AKT通路(图5A)和mTORC1信号传导(图5B),以及脂质代谢(图5C)。然后,作者构建了circTET2过表达或沉默的稳定CLL细胞系(图5D)。随后CCK8分析表明circTET2促进了 CLL细胞的增殖(图5E,F)。从这些结果中,我们观察到circTET2的变化不会改变TET2蛋白水平,而circTET2的过表达激活了mTORC1途径并增强了CPT1A和CPT1B的水平,而敲低circTET2则显示出相反的结果(图5G)。Seahorse检测显示,circTET2在 CLL细胞中的过表达导致更高的耗氧率(OCR),代表FAO水平(图5H,I);ATP水平测试显示了一致的结果,表明circTET2促进了FAO(图5J)。随后使用FAO抑制剂(FAOi)Perhexiline maleate与over-circTET2联合进行回复实验进一步明确该环状RNA的表型功能,同时也进一步明确了FAO在维持CLL细胞增殖方面发挥了重要作用。
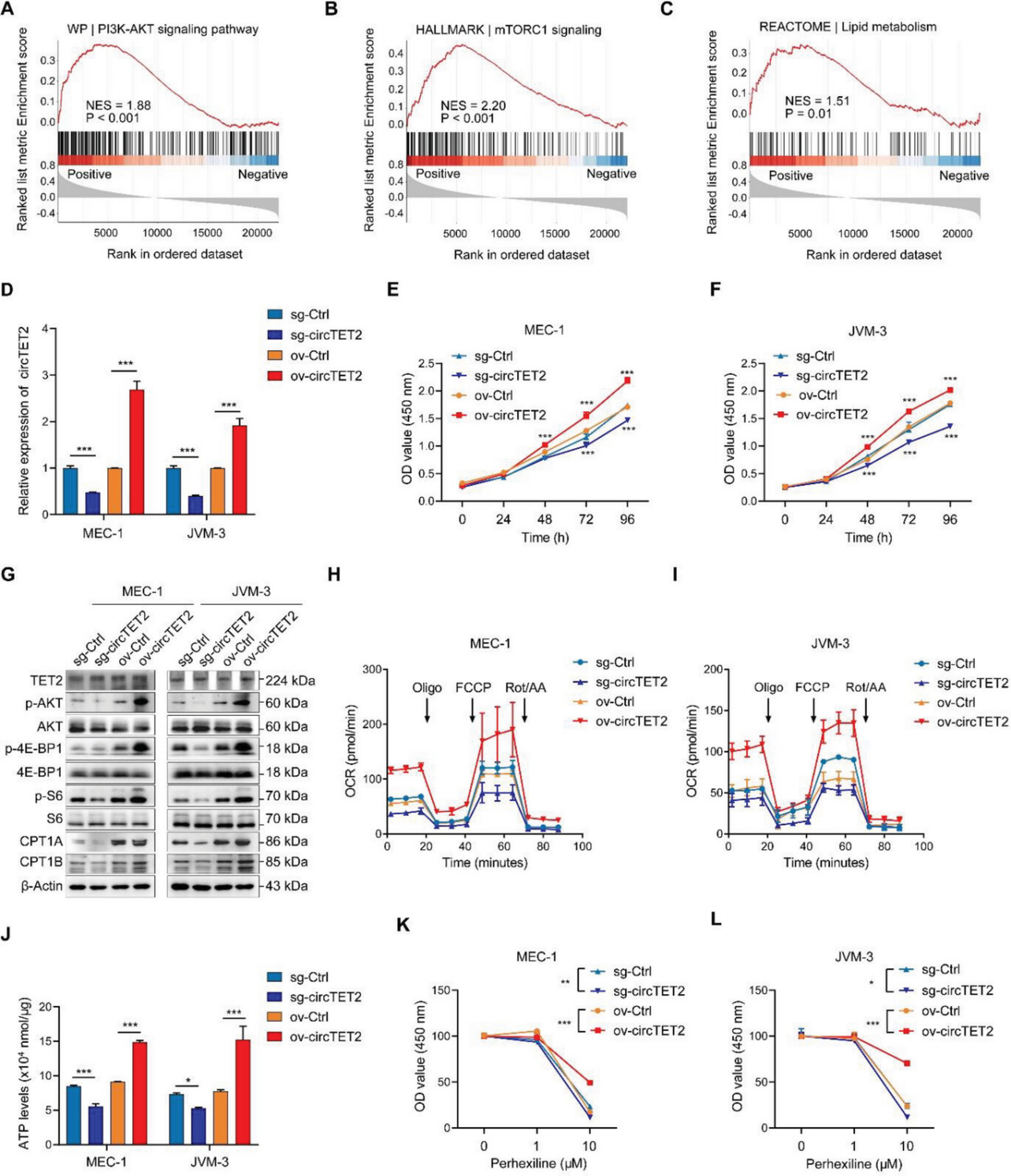 图5. circTET2促进细胞增殖并参与调控mTORC1信号通路和FAO
图5. circTET2促进细胞增殖并参与调控mTORC1信号通路和FAO
6、circTET2以HNRNPC-CPT1A依赖的方式调节CLL细胞表型
越来越多的证据表明,circRNAs通过与RBPs的相互作用发挥功能。为了探索与circTET2结合的潜在RBPs,作者对RNA pull-down的蛋白质进行了质谱分析(图6A);同时,RBPsuit和catRAPID进行了生物信息学分析,以筛选circTET2可能结合的蛋白,最后确定HNRNPC是最有可能的RBP(图6B,C)。随后,RNA pull-down确认了circTET2和 HNRNPC之间的相互作用(图6D)。RIP测定表明,在用抗HNRNPC的抗体沉淀的复合物中,circTET2被富集(图6E)。FISH免疫荧光(FISH-IF)分析也验证了两种分子的共定位(图6F)。虽然彼此物理结合时,作者注意到circTET2和HNRNPC 对它们的相互表达没有影响(图6G–I)。
由于CPT1A和CPT1B可能受到circTET2的调节,作者随后评估了它们在HNRNPC耗竭后的变化,并注意到在HNRNPC敲除后,CPT1A,而非CPT1B的表达下调(图6J,K)。据报道,细胞质HNRNPC能调节靶基因的稳定性。作者利用放线菌素D实验证实了 HNRNPC调节CPT1A的稳定性(图6L)。Starbase 表明HNRNPC在CPT1A的3′UTR中含有潜在的结合位点。RBPmap进一步验证了这一结果(图6M),通过RBPsuit获得了HNRNPC基序(图6N),RIP 测定并确认该预测结果(图6O)。更重要的是,在敲除circTET2后,HNRNPC和CPT1A mRNA之间的相互作用显著减少(图6O)。进一步的结果表明,circTET2对CPT1A的稳定性有影响(图6P)。然后,过表达CPT1A并敲低circTET2,可以观察到升高的CPT1A水平被抑制(图6Q)。为了确认 circTET2是否通过HNRNPC和CPT1A发挥作用,作者进行了CCK8测定,发现circTET2对sh-HNRNPC 诱导的细胞增殖能力降低至关重要(图6R)。此外,CCK8测定还证实,随着circTET2的沉默,CPT1A诱导的细胞活力显著降低(图6S)。随后,进行基于HNRNPC和CPT1A表达的OS曲线被绘制。与预期一致,较高的HNRNPC和CPT1A水平预示着 CLL患者的OS较差(图6T,U)。总之,这些结果表明circTET2以HNRNPC-CPT1A依赖的方式调节CLL 细胞相关表型。
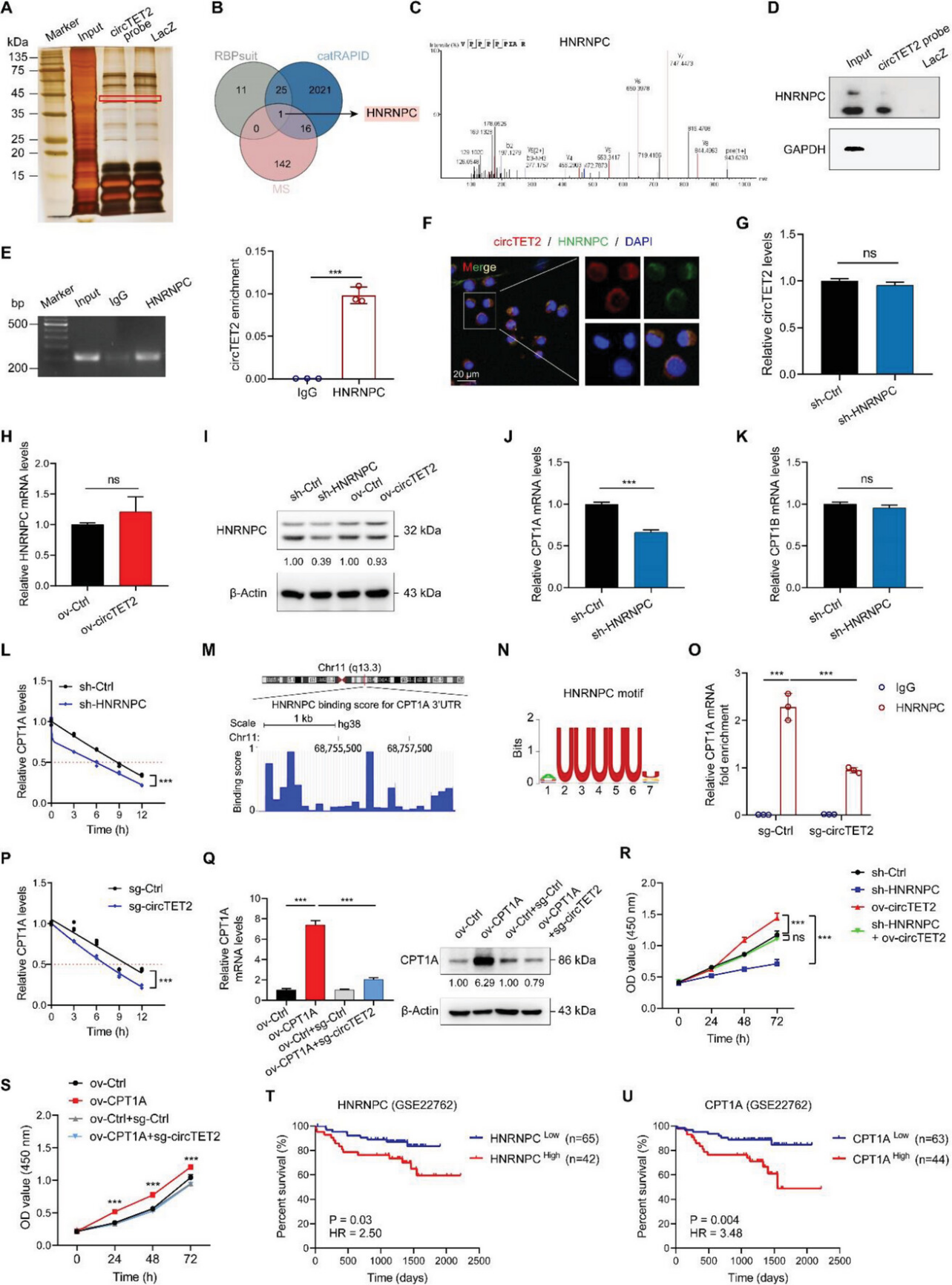 图6. circTET2和HNRNPC相互作用并稳定CPT1A mRNA
图6. circTET2和HNRNPC相互作用并稳定CPT1A mRNA
7、CP028、Dactolisib和Perhexiline对CLL细胞的影响
鉴于circTET2在CLL中的致癌作用,作者认为靶向circTET2可以成为一种潜在的治疗策略。已有研究表明靶向剪接因子是一种新的肿瘤治疗策略,由于circTET2受到剪接过程和RBP的调节,作者试图发现靶向circTET2的剪接因子抑制剂。因此,作者采用了五种抑制剂:Disoulam(通过诱导RBM39降解靶向剪接)、H3B-8800(SF3b复合体的调节剂)以及三种 pre-mRNA剪接抑制剂Isoginkgetin、Madrasin和CP028。其中,CP028显著降低了circTET2的水平(图7A)。此外,在用剪接抑制剂处理后,CP028减弱了RBMX和YTHDC1表达(图7B)。这一结果进一步明确RBMX和YTHDC1是circTET2剪接过程和环化的潜在调节因子。同时,CP028的使用显著抑制了细胞活力并促进了细胞凋亡(图7C,D),而其他四种抑制剂也显示出明显的抑制作用(图S6C)。双ATP竞争性PI3K和mTOR抑制剂Dactolisib也对MEC-1细胞产生显著影响(图7E)。然而,Datolisib下调mTORC1信号的同时,诱导了CPT1A的表达(图7F,G)。用Perhexiline处理则激活了p-4EBP1和p-S6 的磷酸化,这一激活作用可通过沉默circTET2减轻(图7H)。
因此,推测并证实了Dactolisib和Perhexiline可能具有协同作用(图7I,J)。Perhexiline诱导的p-4EBP1和p-S6的增强水平也通过联用Dactolisib而下调(图7K)。流式细胞术分析证实,与单一药物治疗相比,联合用药的细胞凋亡率更显著(图7L)。通过台盼蓝染色,在CLL者的原代细胞中进一步验证了药物的协同作用(图7M),这些结果表明了它们在CLL中的潜在治疗策略。
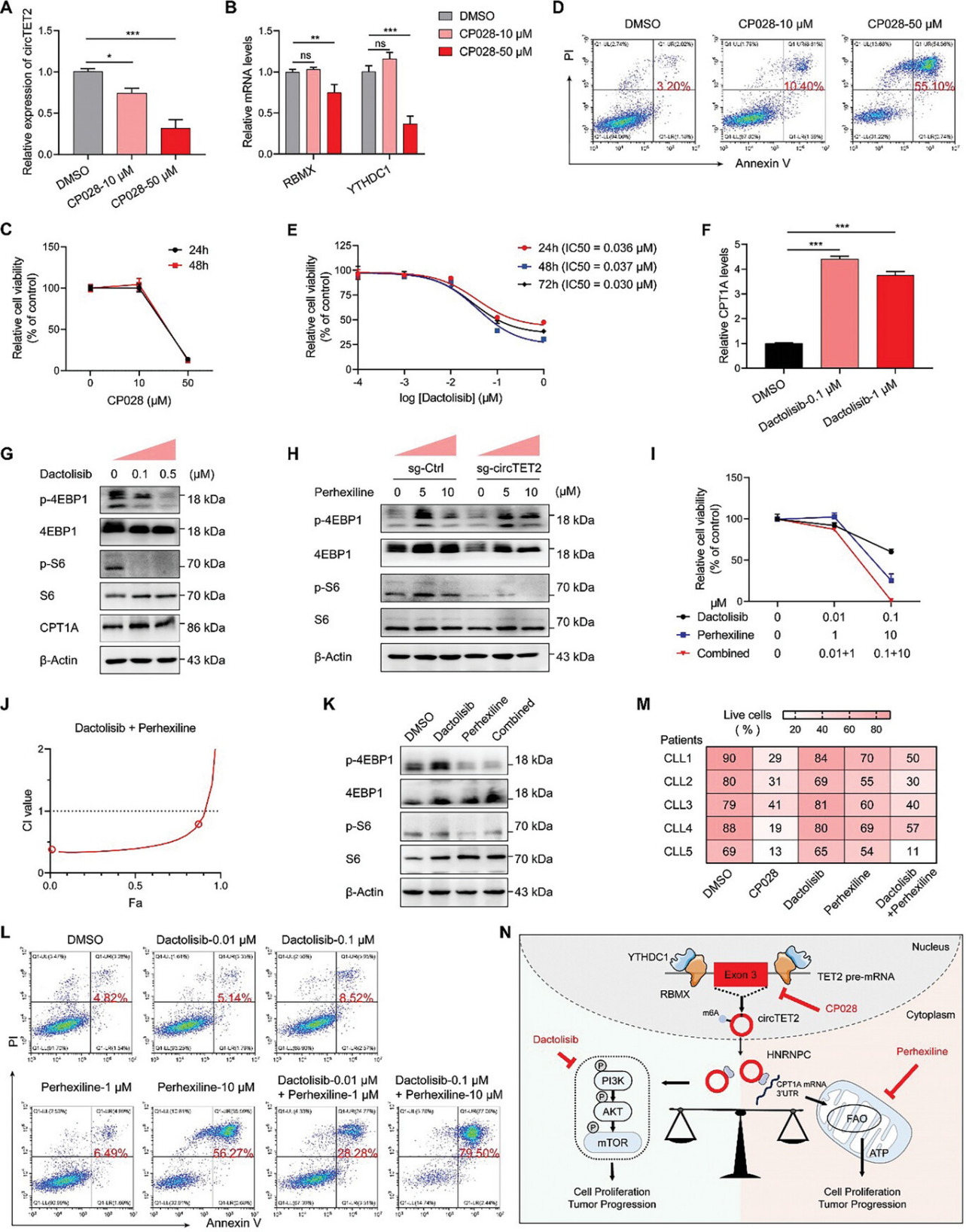 图7. CP028、Dactolisib和Perhexiline对CLL细胞的影响
图7. CP028、Dactolisib和Perhexiline对CLL细胞的影响
本文通过构建m6Sig评分揭示了m6A在CLL中的预后意义,表明m6Sig低的患者具有更长的生存时间。进一步筛选m6A相关的circRNA构建的风险预后评估模型表明circTET2能作为CLL的预后标志物。但由于仅仅研究了53例样品,不同群体可能存在遗传或环境的异质性,因此,circTET2在临床方面的应用仍需进一步研究。
另外,本文研究揭示了circTET2的环化被RBMX和YTHDC1协同调控,虽然之前的研究表明YTHDC1作为m6A reader促进circNSUN2出核,但本文发现m6A修饰会抑制circTET2从核转运到细胞质的过程——这种机制可能是m6A影响了circTET2的空间结构,从而影响了其细胞转导,具体机制仍需进一步研究。
CLL细胞存在代谢重编程,本文研究发现circTET2 参与了CLL的代谢通路。circTET2与HNRNPC相互作用激活了PI3K-AKT-mTORC1信号通路,并通过CPT1A加速了FAO(脂肪酸氧化)的过程。FAO促使ATP产生,从而为CLL细胞增殖提供代谢需求。
已有研究证实FAO的抑制作用可以显著降低CLL细胞的耐药性并改善患者的临床结果,本研究发现FAO 抑制剂Perhexiline确实能削弱CLL细胞的活性;当联用Dactolisib时,CLL杀伤效果得到了增强。
总的来说,本研究证明了m6A在CLL患者中的预后意义,并确定m6A修饰的circTET2是CLL的预后标志物。在CLL中高表达的circTET2由剪接因子RBMX 和YTHDC1调节。circTET2与HNRNPC相互作用,似乎参与了FAO和mTORC1信号通路的调节,以提供能量需求并促进CLL细胞的增殖。mTOR和FAO 的联合抑制显示出增强的效果,这为CLL的治疗提供了一种新的治疗策略。这项研究产生的数据为circRNA在CLL脂质代谢中的作用和潜在机制提供了新的证据,提示了临床治疗中新的潜在治疗靶点。
原文链接:
https://doi.org/10.1002/advs.202304895
.png)
