体外转录(IVT)mRNA在肿瘤免疫和靶向的治疗效果已闻名遐迩。随着纳米递送技术的进步,可以克服治疗性mRNA传递到真核细胞的障碍,COVID-19 IVT mRNA疫苗的大规模临床应用已成为经典案例。
真核生物mRNA翻译主要是甲基鸟苷(m7G)“帽”依赖翻译起始的。而有一种翻译是利用内部核糖体进入位点(IRES)的顺式调节元件来启动翻译,如脊髓灰质炎病毒(PV)等等。
mRNA编码凋亡相关的毒性分子来产生治疗性溶瘤蛋白,如半胱天冬酶、PUMA和MLKL等等。研究发现,溶瘤蛋白具有形成孔的能力,导致膜细胞溶解并引发炎症焦亡,其中以气体D(GSDMD)效果最佳。GSDMDNT作为一种溶解肿瘤细胞的内源性分子,具有独特的优势:
(1)分子量小(31 kDa)和蛋白质构象简单,便于工程修饰和传递;
(2)具有严格的自抑制机制(但一旦激活,GSDMD具有较强的膜裂解能力);
(3) GSDMD具有胞膜内靶向的特异性,即GSDMDNT破裂后不能破坏邻近细胞,从而控制细胞毒性[1]。
如何将新一代技术融合用于解决癌症问题,需要更多人参与。
2023年10月16日,新加坡A*STAR及国立大学陈小元/东南大学及南京医科大学夏洪平/皖南医学院江晓春团队在Nature Cancer(IF=22.7)发表文章“An in vitro-transcribed circular RNA targets the mitochondrial inner membrane cardiolipin to ablate EIF4G2+/PTBP1+ pan-adenocarcinoma”。
本研究利用内含子-外显子(PIE)剪接环化策略和脂质纳米颗粒(LNP)包装方法(二者能降低mRNA的免疫原性),将人鼻病毒2型(HRV2)内部核糖体进入位点(IRESs,可触发序列在癌细胞 (EIF4G2 和 PTBP1高表达)中翻译),hGSDMDc .825 T>A/c.884 A>G-F1LCT突变mRNA序列(具备线粒体内膜心磷脂靶向毒性,触发线粒体吞噬,溶解并杀伤肿瘤细胞),组装成GSDMDENG环状RNA。体内实验结果显示,GSDMDENG环状RNA可抑制EIF4G2+ /PTBP1+泛腺癌的发展。并且,非常值得关注的是,在KRASG12D突变引起EIF4G2和PTBP1异常的肿瘤模型中,GSDMDENG环状RNA可显著抑制胰腺、肺和结肠腺癌的发生,提高了生存率,诱导了KRASG12D肿瘤抗原特异性细胞毒性T淋巴细胞反应。

GSDMDNT IVT mRNA引发心磷脂膜毒性
eIF4G2和PTBP1高表达于肿瘤组织中,其活跃表达可帮助IRES驱动IVT mRNA的表达,以实现肿瘤的基因靶向(图1a,b)。为了鉴定可驱动表达的IRES,作者构建了四种病毒(HRV2、EMCV、PV_type1_Mahoney和PV_type3_Leon)的IRES双反子IVT-mRNA报告系统。最终结果显示,来自HRV2的IRES在eIF4G2+/PTBP1+肿瘤细胞中表现出选择性表达,此IRES选作后续实验(图1d)。
GSDMD的N端可插入内膜,以肌醇和心磷脂为目标,形成孔,从而破裂质膜。为了选择性地诱发癌细胞的膜毒性,作者组装由HRV2 IRES驱动的GSDMDNT IVT mRNA(图1e)。为了消除真核细胞内内源性GSDMD表达和其他IFs/ITAFs的干扰,作者构建了原核细胞表达和纯化系统。通过电转染将GSDMDNT IVT mRNA和过表达质粒pAOX1-EIF4G2和pHT43-PTBP1导入富含心磷脂的枯草芽孢杆菌中。结果显示,eIF4G2+/PTBP1+肿瘤细胞中,HRV2 IRES可以驱动原核细胞中GSDMDNT mRNA的表达,诱导心磷脂膜毒性(图1f-i)。
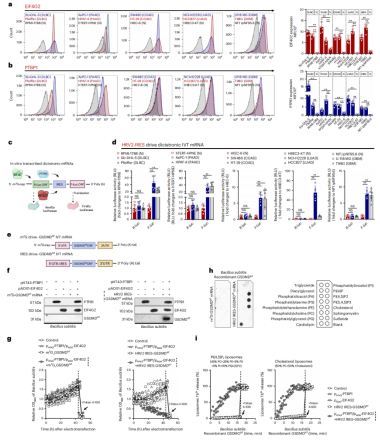 图1 GSDMDNT IVT mRNA构建方案以及对心磷脂膜毒性
图1 GSDMDNT IVT mRNA构建方案以及对心磷脂膜毒性
LNPs将GSDMDNT IVT mRNA传递到eIF4G2+/PTBP1+癌细胞
使用微流控芯片装置,按照DLin-MC3-DMA、DSPC、胆固醇和peg-脂质的标准脂质配方将HRV2 IRES-GSDMDNT mRNA-LNPs封装在LNPs中(平均直径为100nm),随后递送到eIF4G2+/PTBP1+癌细胞系,以诱导GSDMD依赖性的焦亡(图2a-d)。
与m7G的GSDMDNT mRNA相比,HRV2 IRES-GSDMDNT mRNA-LNPs可以有效地、有选择性地转化为GSDMDNT,并且HRV2 IRES-GSDMDNT mRNA-LNPs不足以引发癌细胞毒性,安全性良好(图2e-f)。这可能与ESCRT机制有关,该机制通过质膜修复机制逃避细胞死亡。
为了验证这一假设,递送后,作者观察到了ESCRT-III招募受损癌细胞膜上的CHMP4A和TSG101,这提示转染GSDMDNT mRNA-LNPs启动了ESCRT修复和死亡逃逸(图2h)。作者构建了CHMP4A−/−的癌细胞模型(可消除ESCRT的修复)。但是,较低剂量(-10 ng)的IRES-GSDMDNT mRNA-LNPs即可启动CHMP4A−/−癌细胞的细胞毒性。因此,需要进一步的修饰,以使其适应与ESCRT机制相关的癌细胞死亡逃逸。
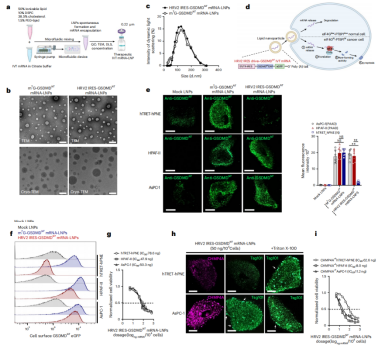 图2 LNPs封装HRV2 IRES-GSDMDNT IVT mRNA,用于真核细胞传递
图2 LNPs封装HRV2 IRES-GSDMDNT IVT mRNA,用于真核细胞传递
线粒体传递以逃避ESCRT介导的死亡
真核细胞的mIM是唯一富含心磷脂的亚细胞细胞器,在mIM中尚未观察到有效的ESCRT修复机制。作者欲将GSDMDNT靶向于线粒体心磷脂,通过线粒体损伤触发细胞死亡。
作者设计三个N端线粒体靶向序列(N/MTSs)来靶向线粒体基质(mM)、mIM和线粒体膜间空间(mIS)。结果显示,mM/MTS和mIS/MTS修饰可使GSDMDNT能够导入线粒体。不过,N/MTS-GSDMDNT并没有表现出心磷脂膜毒性。但是,作者在293T细胞中发现,N/MTS肽与含有L192氨基酸位点的GSDMDNT-α4多肽段有特异性结合。因此,作者猜测N/MTS干扰了GSDMDNT在膜插入和孔形成活性位点(L192/E15)期间的蛋白构象。为了保证GSDMDNT的构象活性,作者决定修改方案为修饰其C端信号肽。
牛痘病毒F1L蛋白的C端包含一个疏水结构域,其两侧是带正电荷的残基(28个氨基酸),有助于将牛痘病毒蛋白靶向到线粒体上。F1LCT肽不与GSDMDNT的活性中心结合。然而,GSDMDNT与F1L的C端连接(GSDMDNT-F1LCT)却能保留GSDMDNT心磷脂膜毒性(图3a-e)。经过设计,最终,在LNP中包裹HRV2 IRES-GSDMDNT-F1LCT mRNA,既能启动GSDMDNT的表达,又能促进其转位到线粒体(图3g)。在转染GSDMDNT-F1LCT mRNA-LNPs的AsPC-1癌细胞中,共聚焦显微镜显示GSDMDNT的线粒体形态和定位。相比之下,在非癌细胞中,线粒体中GSDMDNT的荧光强度较低,线粒体的完整性未受到明显影响,提示HRV2 IRES-GSDMDNT-F1LCT mRNA对线粒体的破坏作用(图3g)。
流式细胞检测线粒体碎片发现GSDMDNT-F1LCT mRNA-LNPs处理后,体积更小(<1μm)(图3h)。从线粒体泄漏的细胞质mtDNA和mtROS分别导致pRIP-MLKL和STING-TBK1-IRF-3信号通路的激活(促进肿瘤消融)(图3i-k),再度提示GSDMDNT-F1LCT mRNA-LNPs抑制肿瘤生长的作用。不过使用Necrox-5(抑制mtROS)和EtBr(抑制mtDNA)可以有效地阻碍这一过程。此外GSDMDNT-F1LCT mRNA-LNPs也可促进LAMP1+溶酶体对AsPC-1细胞线粒体的吞噬,诱导线粒体吞噬。
综上结果表明,GSDMDNT-F1LCT mRNA-LNPs通过形成穿孔损害线粒体,并且通过刺激MLKL信号通路和线粒体自噬,抑制肿瘤生成。
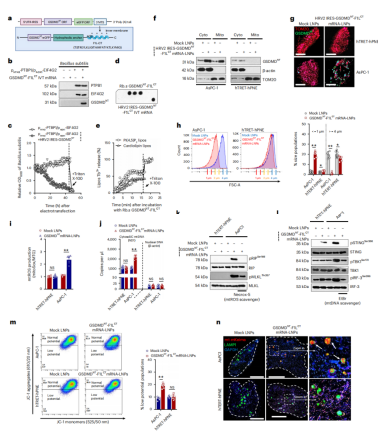 图3 C端F1L肽可将GSDMDNT易位到线粒体中发挥作用
图3 C端F1L肽可将GSDMDNT易位到线粒体中发挥作用
通过GSDMD突变赋予线粒体触发特性
虽然GSDMDNT-F1LCT mRNA-LNPs在非癌细胞系中没有引起严重的线粒体渗漏或质膜毒性,但它们影响了亚细胞,如减少溶酶体和内质网,这可能是磷脂酰肌醇磷酸介导的(图4a,b)。为了减少GSDMD的非特异性亚细胞器膜毒性,作者在其mRNA中引入点突变(hGSDMD),使其在癌细胞中亚细胞器选择性地释放蛋白水解毒性产物。
hGSDMD在细胞质中275处的天冬氨酸残基(D275)处被半胱氨酸/天冬氨酸水解酶切割成GSDMDNT和GSDMDCT。GSDMDCT的独特结构可抑制GSDMDNT在磷脂质膜上的异常成孔活性。作者突变了D275位点(GSDMD p.D275E(c.825 T > A)),剥夺了半胱天冬酶的水解位点,并限制了GSDMD在细胞质中的亚细胞细胞器毒性(图4c)。
线粒体加工肽酶(PMPCB)是位于mM中的一个β亚基,其中包含一个两亲性的α-螺旋底物绑定空腔,可选择性地识别Phe/Leu/Ile-XX-Ser/Thr/Gly-XXXX底物位点,并在Ser位点进行切割,促进线粒体中核编码蛋白的正确折叠和成熟[2]。根据GSDMD33的晶体结构,作者发现GSDMDCT的α1连接螺旋(18个氨基酸)可以转化为PMPCB的裂解结构域,PMPCB由两个四螺旋重复序列组成:-I(α2-α5)和-II(α6-α7,α9-α10)。这个域形成了一个紧凑的球形褶皱,在空间上被PMPCB识别。另一方面,α8结构太短(只有9个氨基酸),无法终止结构自抑制。为了克服这一限制,作者在突变D275位点的基础上,又创建了hGSDMD c.884 A > G突变体(编码p.E295G的突变株)。该突变理论上可以被PMPCB识别,并具有肽酶底物活性(图4c)。双突变体GSDMD p.D275E/p.E295G(GSDMDENG)获得PMPCB水解底物活性,在体外可被重组hPMPCB裂解成GSDMDNT和GSDMDCT(图4d,e)。
被裂解的hGSDMDENG产物具有针对心磷脂膜的毒性作用(图4f,g)。在转染了LNP封装的HRV2 IRES-LNP-F1LCTmRNA的真核肿瘤细胞中显示出线粒体特异性的切割活性,即GSDMDNT只能在癌细胞的线粒体中检测到(图4h)。GSDMDENG不影响非肿瘤细胞系中溶酶体和内质网的数量,但GSDMDENG诱导肿瘤细胞线粒体碎片,并可抵制ESCRT修复(图4i、j)。并且,重要的是,与GSDMDNT mRNA在癌细胞和非癌细胞中的半抑制浓度相比,HRV2 IRES-GSDMDENG-F1LCTmRNA-LNPs在较低剂量下表现出安全的癌细胞抑制活性(图4k,6g)。
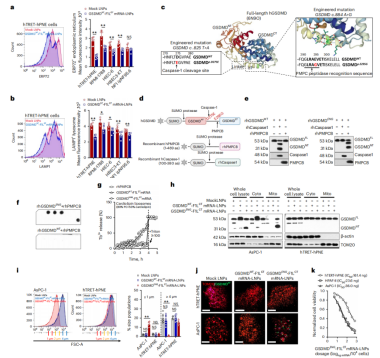 图4 GSDMD碱基修饰可获得线粒体酶水解活性
图4 GSDMD碱基修饰可获得线粒体酶水解活性
转基因IVT mRNA的自剪接内含子环状化
mRNA疗法抗病毒机制会大大降低了mRNA的线性半衰期和翻译效率,可能导致不良影响。环状RNA(circRNA)是提高mRNA稳定性的有效策略。
作者使用内含子-外显子(PIE)剪接策略构建环状RNA。具体方法在于:利用T4噬菌体胸苷酸合成酶基因的I型内含子将其与中间断开,将内含子2和内含子1顺序连接。然后将HRV2 IRES、GSDMDc .825 T>A/c.884 A>G ORF、eGFP ORF和F1LCT依次插入到内含子之间。用IVT合成前体RNA,然后加入Mg2+和GTP进行催化环化(图5a)。然而,PIE环化策略未能产生环化产物(图5b)。
为了提高剪接效率,作者在线性RNA的5‘和3’端添加了互补的配对同源臂序列,使剪接位点在空间上更接近(图5c,d)。为了确保剪接核酶的折叠不受高度结构化的HRV2 IRESs的影响,在3‘PIE剪接内含子和HRV2 IRESs序列之间添加了一个间隔序列,使HRV2 IRES和PIE的剪接位点能够独立折叠成二级结构(图5c,d)。同源臂和间隔区将前体RNA环化效率提高到90%以上,且环化产物耐受RNase R切割(图5e)。RNase H质检环状RNA呈现单一条带,而前体RNA产生两条条带(图5f)。此外,Sanger测序结果证实,该产物为一个完整的环状RNA(图5g)。综上数据表明,GSDMDENG环状RNA成功体外制备。
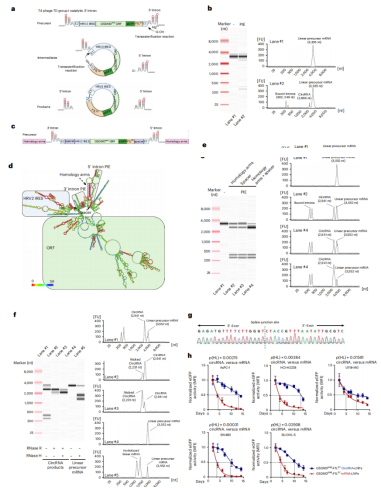 图5 PIE剪接形成环状RNA
图5 PIE剪接形成环状RNA
GSDMDENG 环状RNA-LNPs消融肿瘤和呈递抗原
HRV2 IRES-GSDMDENG-F1LCT IVT 环状RNA-LNPs (GSDMDENG 环状RNA-LNPs)在体内经过实验显示具有良好的安全性(图6a-c)。在肿瘤小鼠模型中,GSDMDENG 环状RNA-LNPs可消融各种腺癌,并抑制胶质瘤和血液瘤生长(图6d);其机制在于,GSDMDENG 环状RNA-LNPs驱动EIF4G2+ /PTBP1+肿瘤中GSDMD的表达(图6e,f),并诱导肿瘤线粒体吞噬和肿瘤抗原呈递,参与肿瘤消融。
线粒体吞噬对于内溶酶体呈递线粒体抗原至关重要。为了确认GSDMDENG 环状RNA-LNPs诱导的线粒体吞噬是否能触发适应性抗肿瘤免疫,作者使用慢病毒构建了AsPCs-mtOVA-msCherry稳转细胞(可编码线粒体定位的OVA和mCherry荧光),经过实验证实了GSDMDENG 环状RNA-LNPs诱导的线粒体吞噬可以触发适应性抗肿瘤免疫。
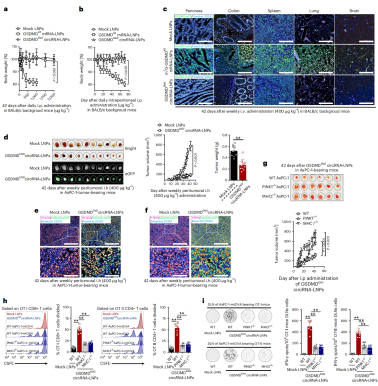 图6 GSDMDENG 环状RNA-LNPs的安全性和有效性
图6 GSDMDENG 环状RNA-LNPs的安全性和有效性
GSDMDENG 环状RNA-LNPs预防KRASG12D腺癌
大约30%的人类肿瘤存在RAS基因突变,其中KRAS是最常见的突变成员。基因分析显示,在弥漫性大b细胞淋巴瘤(DLBC)、胰腺腺癌(PAAD)、结肠腺癌(COAD)、LUAD和多形性胶质母细胞瘤(GBM)中,KRAS与EIF4G2/PTBP1的高表达呈正相关(图7a,b)。KRAS经常在G12处突变,尤其是在手术切除的PAAD、COAD和LUAD癌组织中,特别是KRASG12D突变(图7c,d)。作者亦发现,在KRASG12D突变小鼠的胰腺、肺和结肠中,EIF4G2和PTBP1的表达表现出年龄依赖性的趋势(图7e),这可能是KRAS异常激活Raf-MEK-MAPK信号通路有关[3]。因为有结果显示,CH51226766(Raf-MEK-MAPK信号抑制剂)减弱KRASG12D小鼠中EIF4G2和PTBP1的表达(图7e)。研究表明,激活Raf-MEK-MAPK信号通路有利于HRV2 IRES的启动,使HRV2 IRES驱动的GSDMDENG 环状RNA-LNPs成为肿瘤发生(KRAS突变驱动)的潜在预防性治疗方法。
除此之外,GSDMDENG 环状RNA-LNPs也被证实能够动员抗肿瘤免疫来保护KRASG12D突变诱导的腺癌发生,比如降低肿瘤联合发生率,提高机体生存率,激活树突状细胞和提高细胞毒性T细胞免疫。
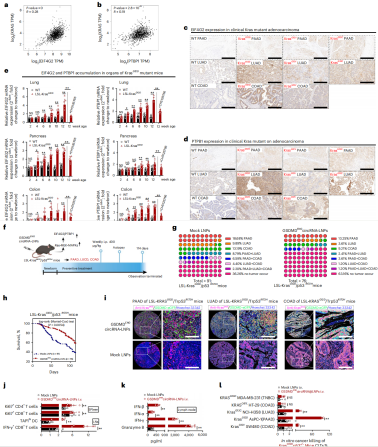 图7 GSDMDENG 环状RNA-LNPs可对KRAS突变引起泛腺癌进行预防性治疗
图7 GSDMDENG 环状RNA-LNPs可对KRAS突变引起泛腺癌进行预防性治疗
小结
作者通过多种设计和传递策略,设计了一个独特的环状RNA——GSDMDENG 环状RNA-LNP,它具有肿瘤特异性表达和条件性激活的双重特性。HRV2-IRES结构确保了其在KRAS突变驱动EIF4G2/PTBP1激活的癌症细胞中的翻译起始,而双突变氨基酸位点和改造C末端信号肽使其具备定位和激活线粒体。环化策略和LNP包封增强其在体内的表达和递送效率,以及减弱免疫。GSDMDENG 环状RNA-LNP可有效消除肿瘤小鼠模型的肿瘤负担,间接赋予KRAS突变小鼠的抗肿瘤免疫。这些综合策略为使用GSDMDENG 环状RNA-LNP治疗和预防KRAS突变诱导的泛腺癌提供了巨大的前景;也为环状RNA替代mRNA靶向肿瘤药物和疫苗再次奠定了研究基础。
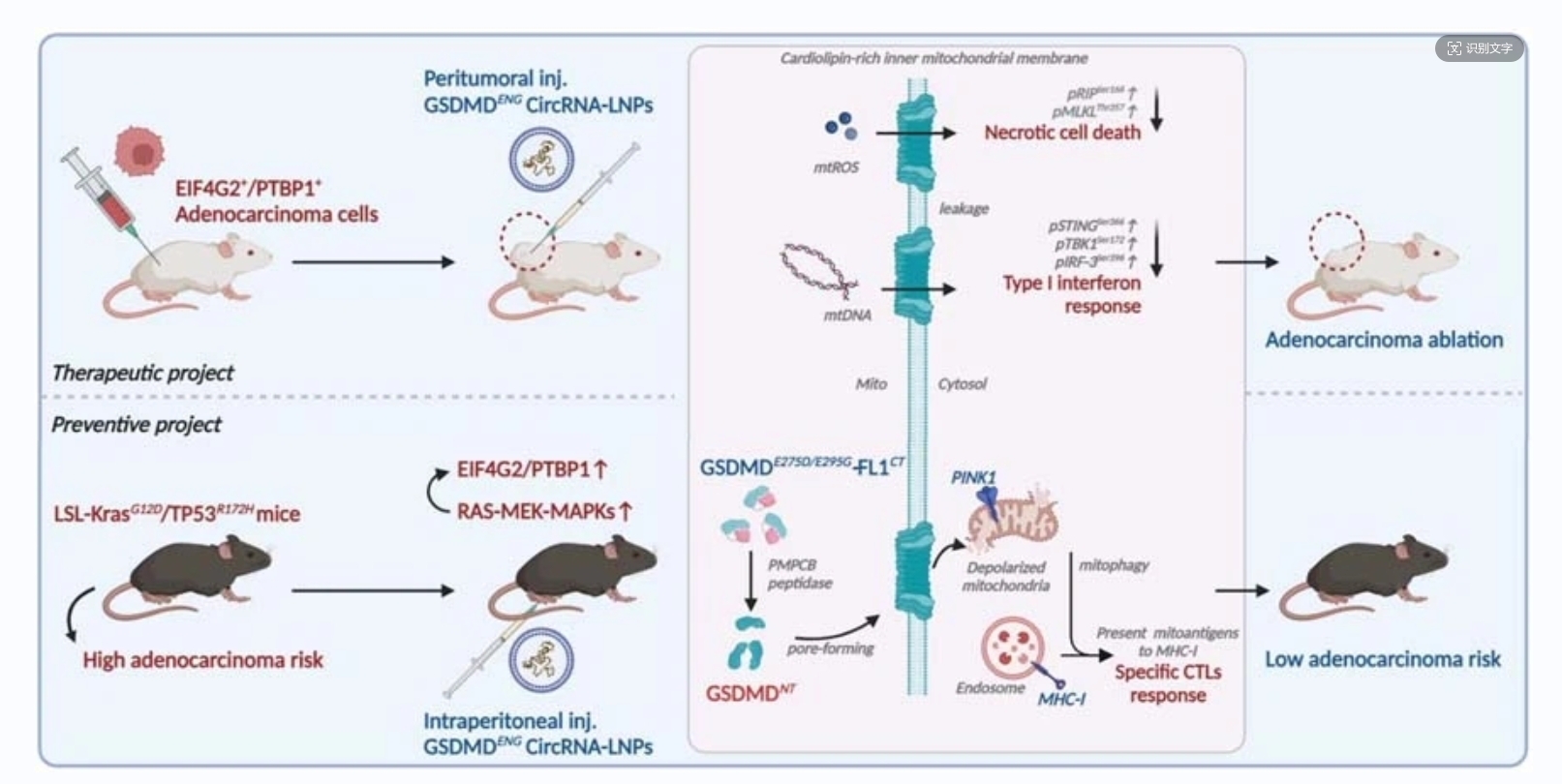 图8 GSDMDENG 环状RNA-LNP的设计和传递策略
图8 GSDMDENG 环状RNA-LNP的设计和传递策略
参考文献:
[1] Ding, J. et al. Pore-forming activity and structural autoinhibition of the gasdermin family. Nature 535, 111–116 (2016).
[2] Taylor, A. B. et al. Crystal structures of mitochondrial processing peptidase reveal the mode for specific cleavage of import signal sequences. Structure. 9, 615–625 (2001).
[3] Yan, L. et al. Targeting glucose metabolism sensitizes pancreatic cancer to MEK inhibition. Cancer Res. 81, 4054–4065 (2021).
原文链接:
https://doi.org/10.1038/s43018-023-00650-8
.png)
