膀胱癌是全球最常见的恶性肿瘤之一,预后较差,在中国泌尿系统中也较为常见。有研究表明,环状RNA通过作为miRNA海绵参与膀胱癌的进展,但是环状RNA的潜在作用和分子机制有待进一步的探索和研究。已有文献表明Hippo通路在人类癌症中的异常状态,促进肿瘤发生、转移进展和代谢转移。那么在膀胱癌发展过程中,环状RNA是否与Hippo通路有关呢?
2023年9月10日,浙江大学医学院附属第一医院泌尿外科王非凡团队在Molecular Cancer(IF=37.3)发表文章“CircXRN2 suppresses tumor progression driven by histone lactylation through activating the Hippo pathway in human bladder cancer”。本研究发现circXRN2通过稳定LATS1激活Hippo通路,进而抑制人类膀胱癌中H3K18乳酸化驱动的肿瘤进展。研究结果提供了一种环状RNA参与膀胱癌发生的分子机制,并拓展了我们对膀胱癌中Hippo通路和组蛋白乳酸化的理解。
LATS1在膀胱癌中表达下调,并与circXRN2相互作用
LATS1是Hippo信号通路中一个重要的促进分子,在多种恶性肿瘤中发挥重要作用。组织芯片和临床样本显示,与邻近正常组织相比,膀胱癌组织中的LATS1异常下调。RIP和高通量测序等方法发现circXRN2(hsa_circ_0001134)对LATS1蛋白的结合效率和亲和力最高。通过qRT-PCR也证实了在临床肿瘤组织中circXRN2的失调。另外,circXRN2在肿瘤细胞系中的表达水平在一定程度上与Hippo通路关键分子TAZ和YAP的激活相关。综上所述,circXRN2可能参与了LATS1和Hippo信号通路的调节。
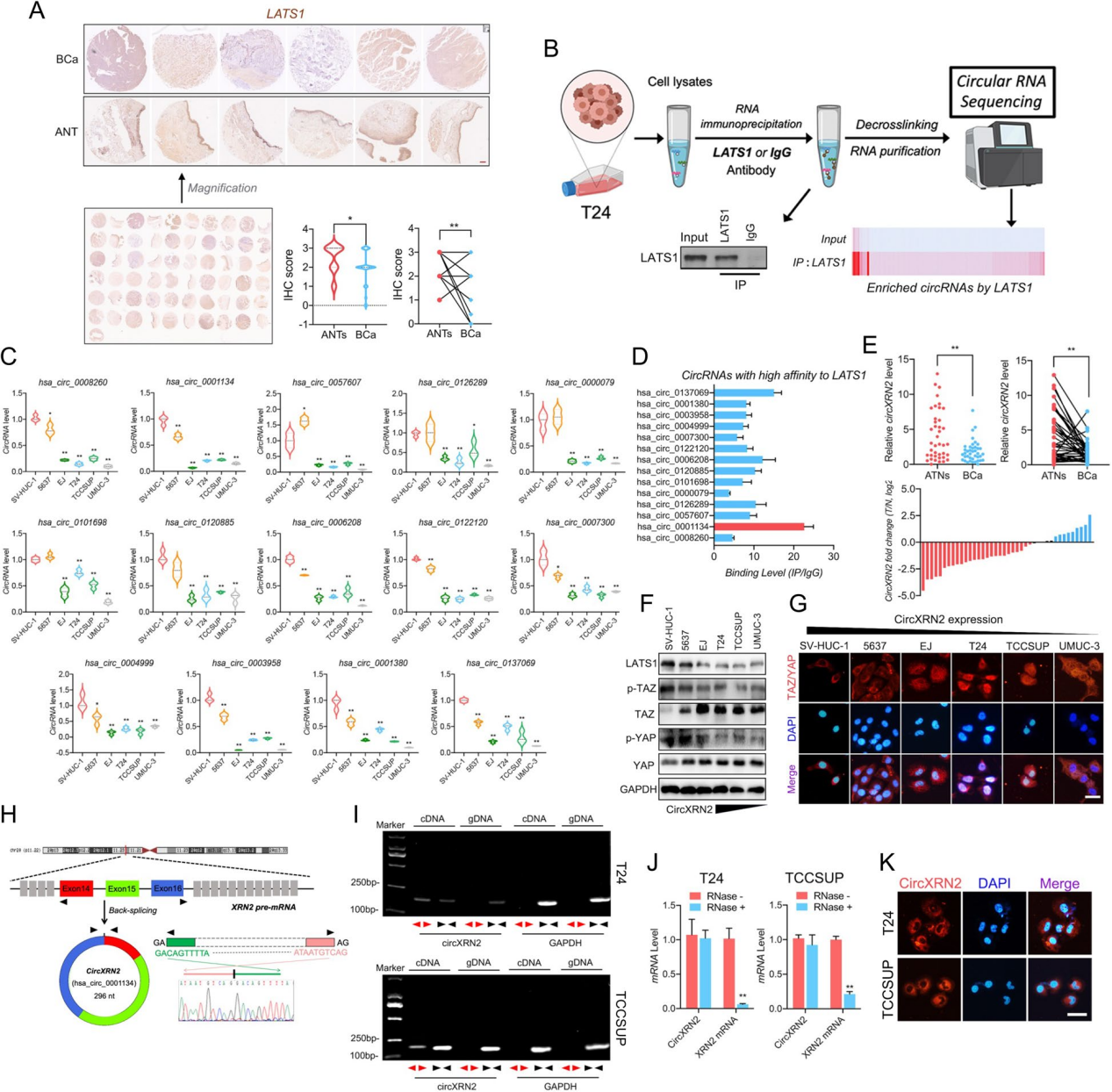 图1 LATS1在膀胱癌中与circXRN2相互作用
图1 LATS1在膀胱癌中与circXRN2相互作用
CircXRN2在体内外均能抑制膀胱癌细胞的增殖和迁移
在体外实验中,CCK8实验结果显示了circXRN2抑制膀胱癌细胞活力,细胞集落形成实验也表现出相同的趋势。此外,过表达circXRN2也会引发细胞凋亡,并降低了细胞的迁移能力。
在体内研究中,作者构建了裸鼠皮下异种移植物肿瘤发生模型和尾静脉肺转移模型。结果表明,circXRN2可以降低皮下肿瘤的生长速率和重量。同样,circXRN2过表达组的转移淋巴结数量远低于阴性对照组。
总的来说,circXRN2在体内外均能抑制膀胱癌细胞的增殖和迁移。
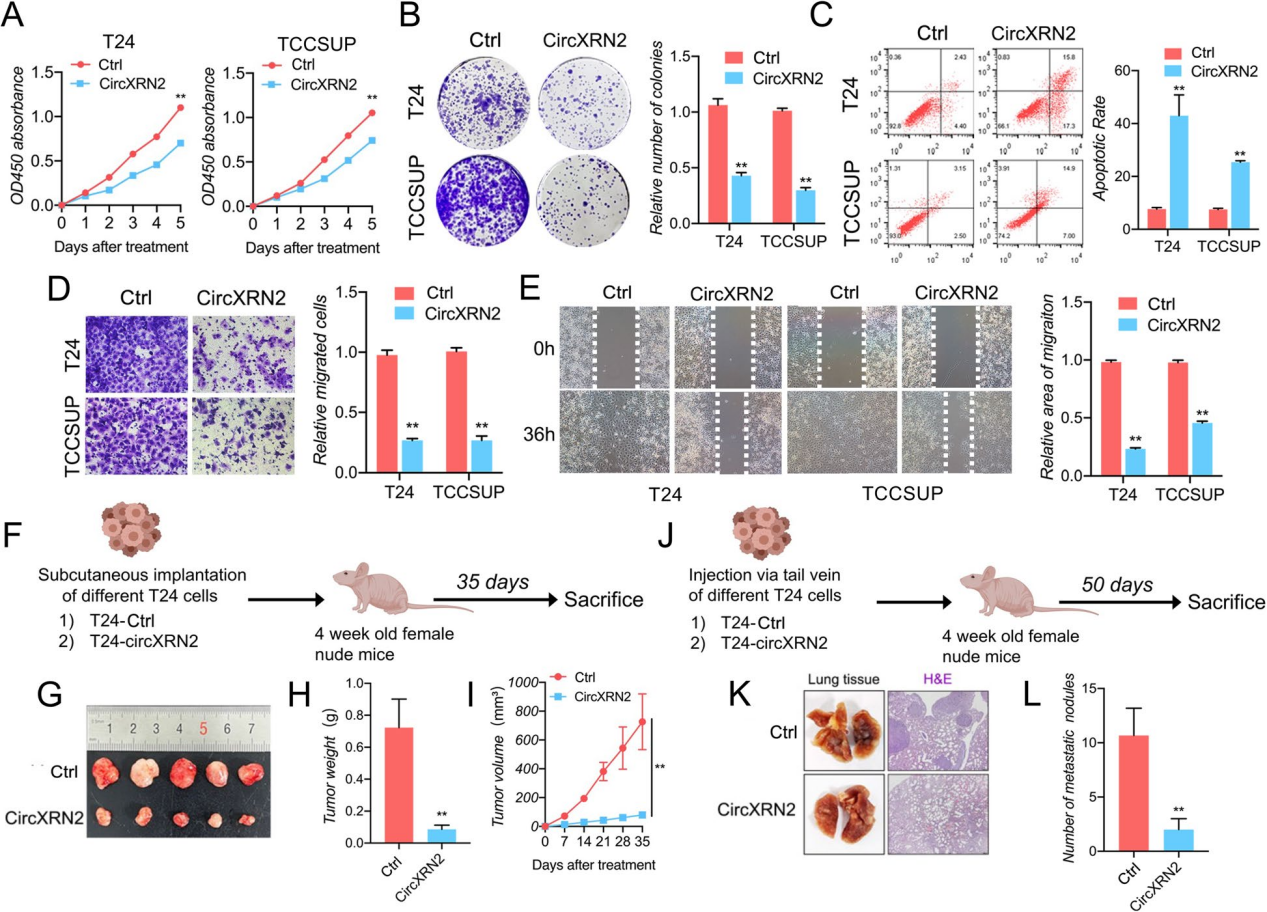 图2 CircXRN2在体内外均能抑制膀胱癌细胞的增殖和迁移
图2 CircXRN2在体内外均能抑制膀胱癌细胞的增殖和迁移
CircXRN2可以阻止LATS1被SPOP降解
为了揭示circXRN2和LATS1之间的相互作用,作者构建了表达LATS1不同片段的质粒,RIP结果显示,LATS1蛋白的片段2与circXRN2相互作用。过表达circXRN2在蛋白水平上上调了LATS1,但不上调了mRNA水平。推测circXRN2可能通过翻译后修饰调节LATS1蛋白水平。为了证实这一推测,通过真核蛋白合成抑制剂CHX处理阴性对照和过表达circXRN2的细胞,显示circXRN2可以延长LATS1蛋白的半衰期。蛋白酶体抑制剂bortezomib恢复了能抗circXRN2的肿瘤细胞中LATS1蛋白的表达水平。通过IP检测不同细胞中LATS1蛋白的泛素化情况。在使用蛋白酶体的抑制剂和去泛素化酶抑制剂的过表达circXRN2的细胞中,LATS1蛋白的泛素化程度较少。综上所述,circXRN2通过调节转录后泛素化来调节膀胱癌细胞中的LATS1蛋白水平。
LATS1是散斑型POZ的潜在底物(SPOP,E3泛素连接酶适配器),而SPOP促进LATS1 的泛素化和降解。因此,为了验证SPOP参与了人膀胱癌细胞中LATS1的泛素化和降解,在T24细胞中进行了IP和质谱检测,结果表明LATS1与SPOP蛋白相互作用,并且SPOP反向调控LATS1蛋白,且呈剂量依赖性。另外,敲低SPOP也降低了LATS1蛋白的泛素化水平。
大多数SPOP底物具有SPOP结合共识基序F-PS-S/T-S/T(“F”代表非极性,“P”代表极性)。在LATS1蛋白的n端有两个推测的SPOP结合基序SBC1和SBC2。circXRN2与含有SBC1和SBC2的片段2相互作用。因此作者推测circXRN2和SPOP可能与LATS1蛋白竞争性地相互作用,以调节其降解。
为了验证这一点,作者构建了野生型或突变型LATS1质粒,将其转染到293T或膀胱癌细胞中,发现SBC1突变导致SPOP介导的LATS1降解被显著阻断,而SBC2的突变几乎没有效果。同时,co-IP结果显示,野生型LATS1可以与SPOP结合,但SBC1突变型LATS1与SPOP的无相互作用。最后,作者发现敲低 circXRN2 促进了膀胱癌细胞中SPOP与LATS1的相互作用。综上所述,circXRN2可以阻止LATS1的SPOP介导的降解。
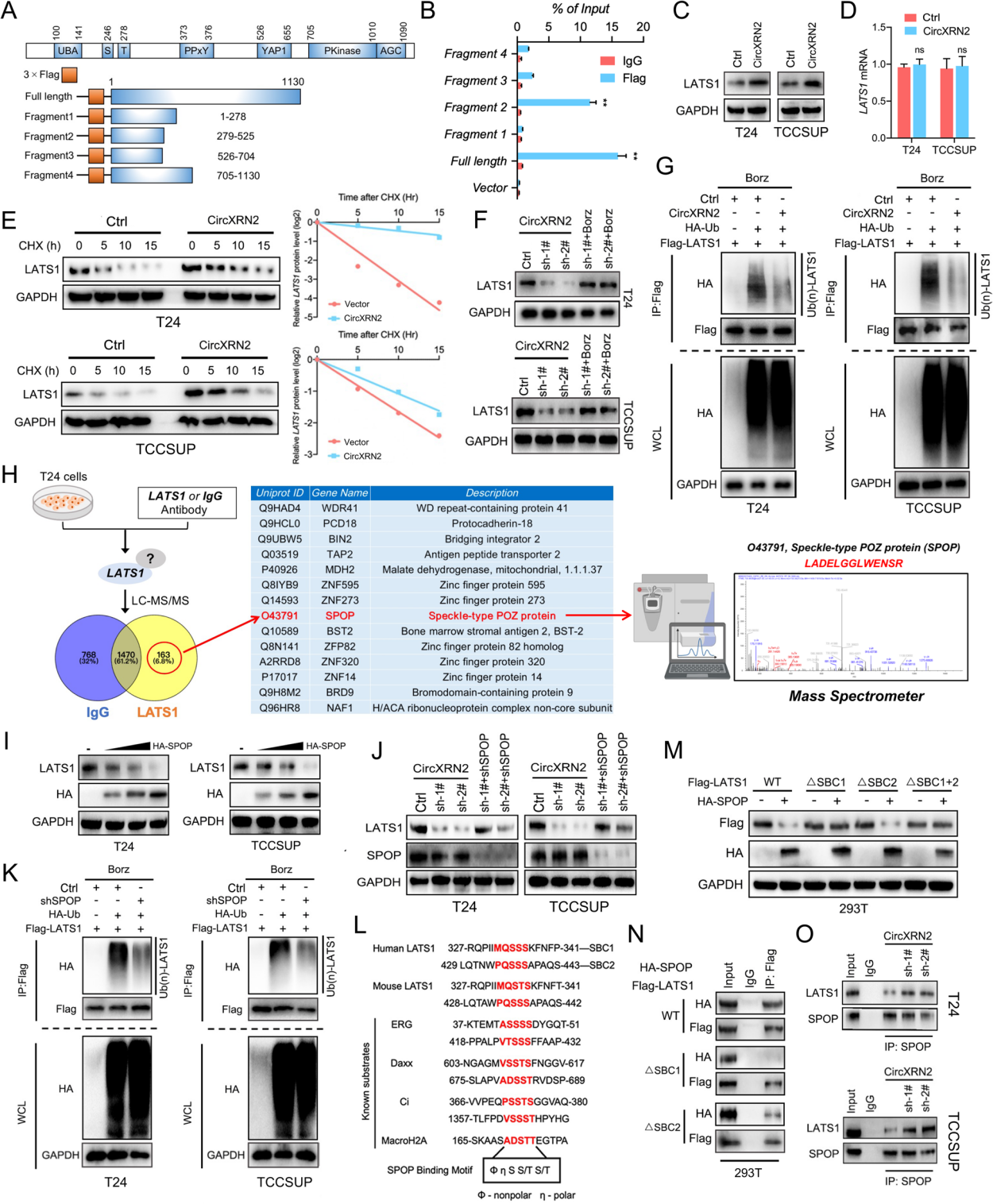 图3 CircXRN2 通过与其降解子序列结合阻止 LATS1 被 SPOP 降解
图3 CircXRN2 通过与其降解子序列结合阻止 LATS1 被 SPOP 降解
CircXRN2是膀胱癌中糖酵解和乳酸产生的抑制因子
Hippo通路能够调节细胞糖酵解代谢,鉴于circXRN2、LATS1和Hippo通路之间的密切关系,作者假设circXRN2在膀胱癌细胞的糖酵解中起着关键作用。为了验证这一推测,作者过表达了circXRN2,并进行了2-NBDG摄取检测、葡萄糖摄取测定和乳酸生成测定。结果证明,circXRN2降低了T24和TCCSUP细胞中的葡萄糖摄取和乳酸生成。海马糖酵解速率分析的结果表明,过表达circXRN2的膀胱癌细胞的糖PER、基础糖酵解和代偿性糖酵解均低于正常肿瘤细胞。综上所述,circXRN2在膀胱癌细胞的糖酵解和乳酸代谢中起负面作用。
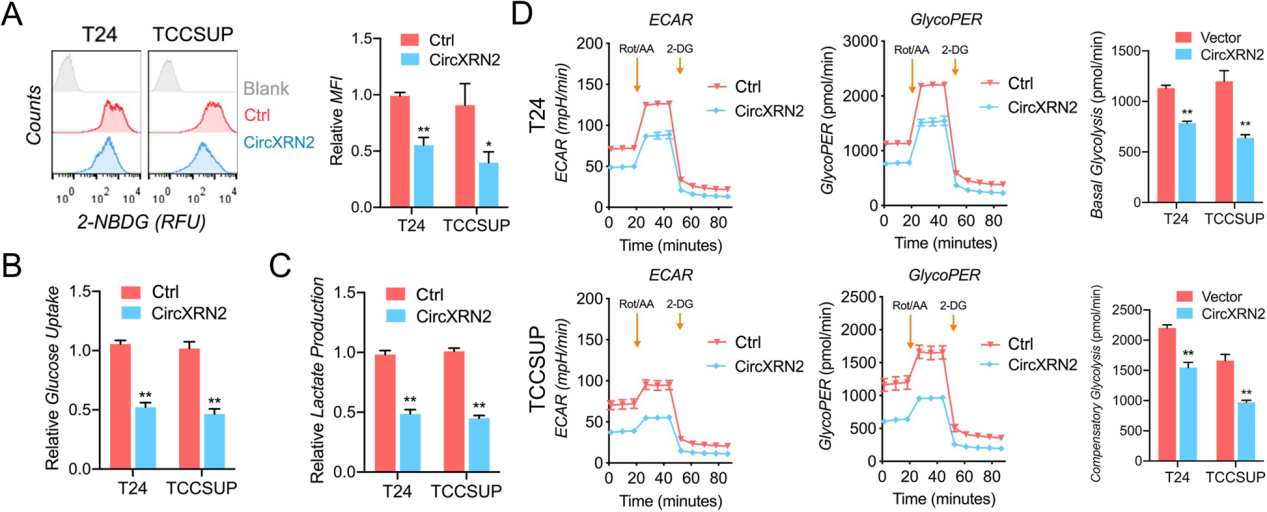 图4 CircXRN2是人膀胱癌细胞糖酵解的负调控因子
图4 CircXRN2是人膀胱癌细胞糖酵解的负调控因子
CircXRN2通过稳定LATS1介导Hippo通路,以调节膀胱癌的进展、糖酵解和乳酸生成
作者为了证实circXRN2/LATS1轴调控膀胱肿瘤细胞的多种生物学功能和葡萄糖代谢,在过表达circXRN2的细胞中敲低LATS1蛋白。免疫印迹分析显示在过表达circXRN2细胞中,LATS1蛋白和Hippo通路关键蛋白TAZ/YAP表现出相反的趋势,免疫荧光也表明CircXRN2改变了膀胱癌细胞中TAZ/YAP的位置。
CCK-8实验和细胞集落形成实验的结果表明,shLATS1逆转了circXRN2对细胞活力和增殖的抑制作用。同时,通过Transwell实验和伤口愈合实验表明。与circxrn2过表达的细胞相比,转染shLATS1的细胞迁移能力更强。
此外,对照组、circXRN2-过表达组和 circXRN2+shLATS1组的葡萄糖摄取能力和乳酸生成分别通过2-NBDG摄取测定、葡萄糖摄取测定和乳酸生成检测来确定。结果显示,shLATS1减轻了circXRN2对糖酵解代谢的抑制。
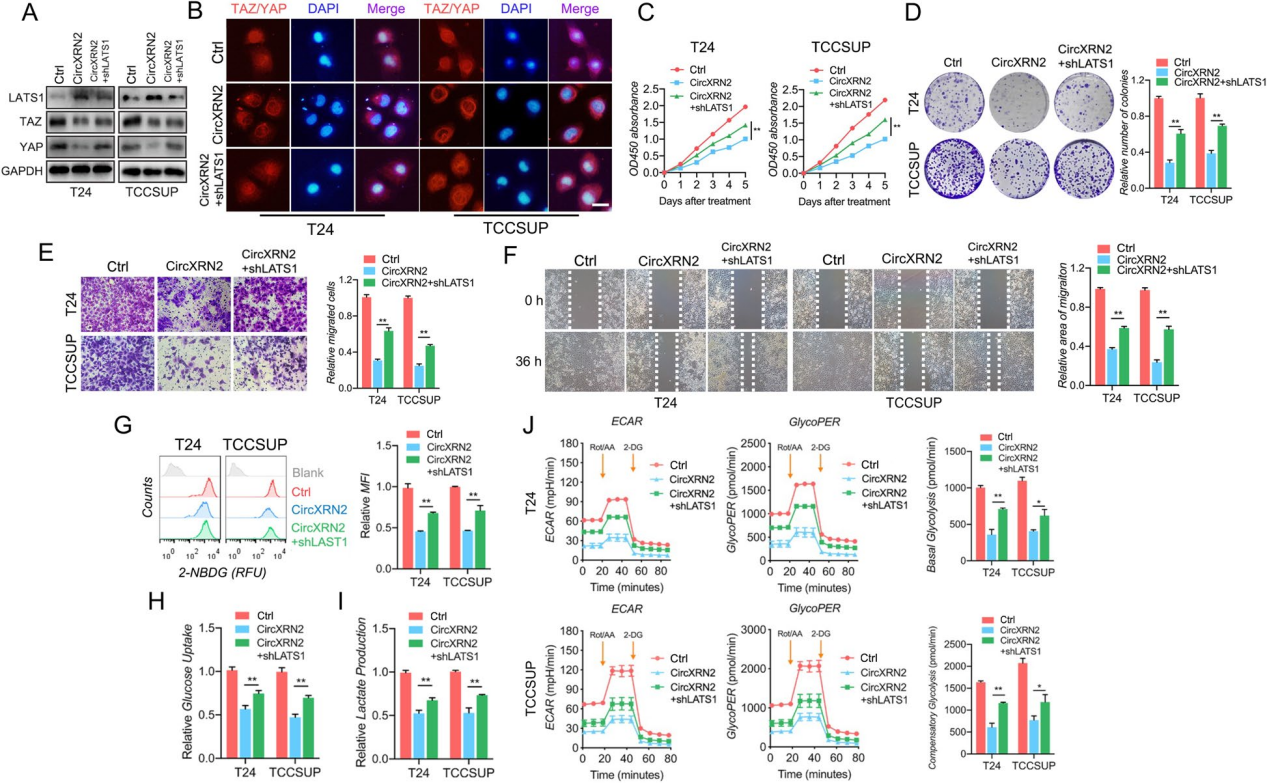 图5 CircXRN2通过稳定LATS1介导 Hippo通路,调节人膀胱癌中的细胞增殖、迁移和糖酵解
图5 CircXRN2通过稳定LATS1介导 Hippo通路,调节人膀胱癌中的细胞增殖、迁移和糖酵解
circXRN2调控组蛋白乳酸化促进膀胱癌的发生
组蛋白乳酸化依赖于糖酵解或其他代谢过程产生的细胞内乳酸。因此,作者利用2-DG(一种糖酵解抑制剂)和草酸酯(一种乳酸脱氢酶抑制剂)来证实膀胱癌细胞中糖酵解、总乳酸化和组蛋白乳酸化之间的关系。2-DG和草酸酯以剂量依赖的方式降低了总乳酸化和组蛋白H3K18乳酸化水平,而乳酸脱氢酶LDH则完全抑制了这一趋势。同时,circXRN2显著降低了总乳酸化和H3K18乳酸化水平。值得注意的是,在膀胱癌细胞系中,总乳酸化和H3K18乳酸化水平是显著升高的,这表明其在肿瘤发生中的潜在作用。
所以,作者接着验证H3K18乳酸化在膀胱癌中的生物学功能,通过消siLDHA/B以降低总乳酸化和H3K18乳酸化水平,CCK-8和菌落形成实验表明,H3K18乳酸化在细胞增殖和集落形成能力起着至关重要的作用。此外,siLDHA/B还会损害膀胱癌细胞的迁移能力。综上所述,这些结果表明组蛋白H3K18的乳酸化是由circXRN2调节的,并参与了膀胱癌的肿瘤发生。
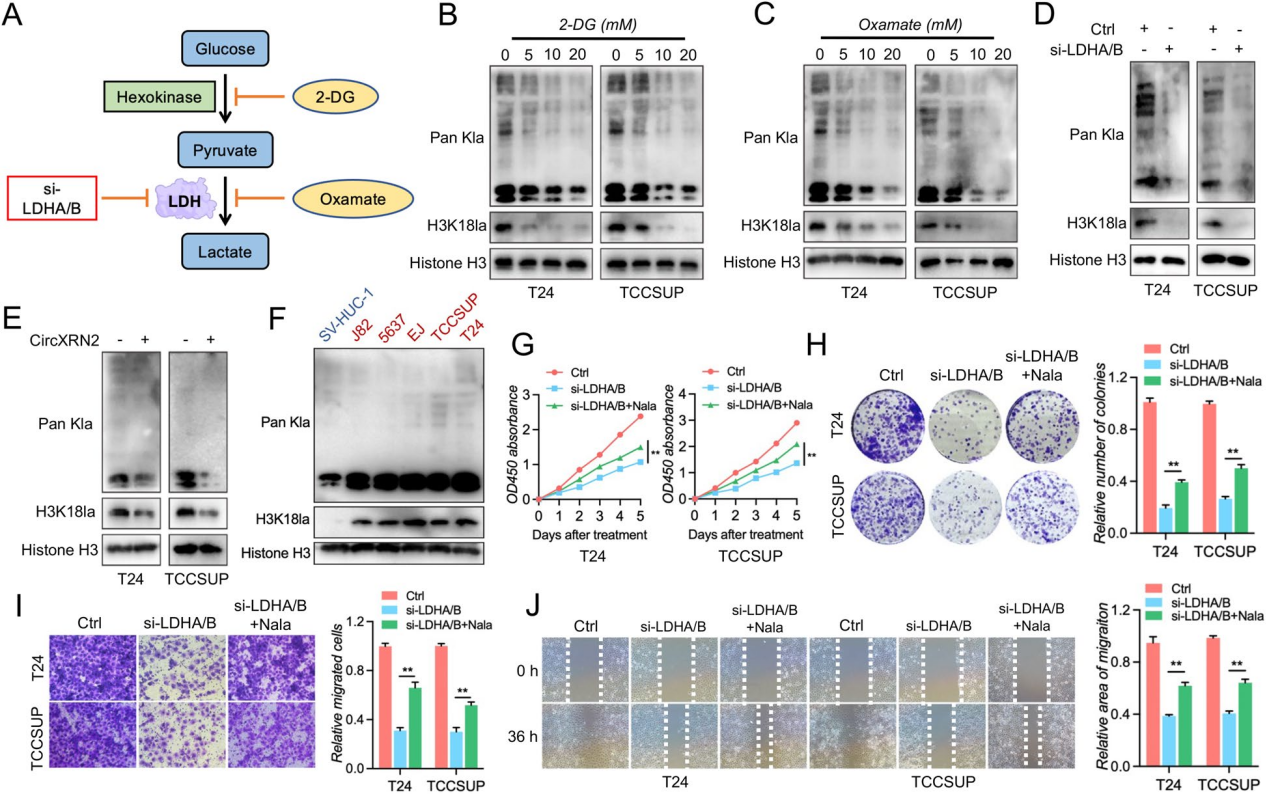 图6 CircXRN2介导的H3K18乳酸化促进了人膀胱癌的肿瘤进展
图6 CircXRN2介导的H3K18乳酸化促进了人膀胱癌的肿瘤进展
LCN2是H3K18乳酸化的靶点,在膀胱癌中作为致癌基因
作者接着研究了H3K18乳酸化的调控机制,CUT&Tag和KEGG数据库分析显示,H3K18la可以在许多基因的启动子区域富集,同时,H3K18la相关基因也在调节肿瘤发生的多种信号通路中富集。通过转录组测序,并与CUT&Tag数据和PubMed数据库比对,作者选取了LCN2、NRARP 和KRT80作为候选基因,然后发现,在过表达circXRN2的膀胱癌细胞中,LCN2被circXRN2显著下调。此外,2-DG也在蛋白水平上调节LCN2的表达。
LCN2是一种癌症进展的促进因子,在膀胱癌组织中表达上调。为了进一步研究其功能,作者针对LCN2启动子设计了不同区域的特异性引物,ChIP实验显示H3K18la富集在LCN2启动子中,且H3K18la与LCN2启动子之间的相互作用可以被2-DG和circXRN2降低,进一步表明H3K18la在LCN2转录中的关键作用。最后,LCN2的敲低显著地降低了细胞的增殖、菌落的形成和增殖肿瘤细胞的迁移。综上所述,LCN2直接受H3K18乳酸化调控,并在人类膀胱癌中发挥致癌基因的作用。
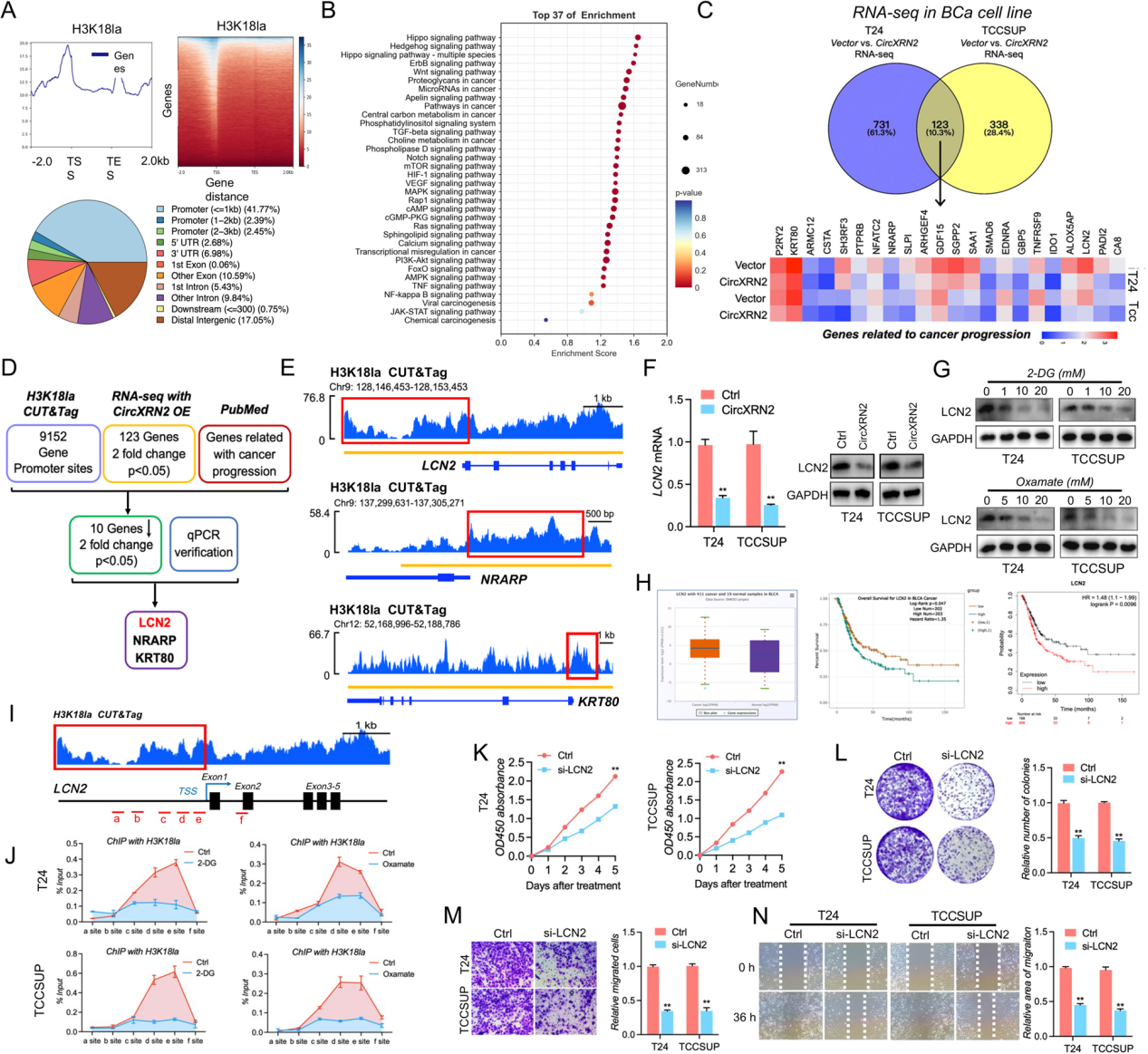 图7 LCN2是H3K18乳酸化的一个靶点,并作为一种致癌基因
图7 LCN2是H3K18乳酸化的一个靶点,并作为一种致癌基因
CircXRN2-LATS1轴在体内抑制膀胱癌细胞的肿瘤生长和转移
为了验证circXRN2-LATS1轴是否能抑制膀胱癌细胞的肿瘤生长和转移,作者将转染(对照、circXRN2过表达、circXRN2+shLATS1)的细胞皮下注射到裸鼠体内。与体外细胞实验相似,过表达circXRN2显著降低肿瘤的生长速率,而敲低LATS1可显著减弱circXRN2的抑制效果。作者又构建了裸鼠肺转移模型,与对照组相比,过表达circXRN2显著减少了肺转移性结节,而circXRN2+shLATS1组中,结节显著增加。此外,通过免疫组化和免疫印迹检测了不同治疗组肿瘤中LATS1、TAZ/YAP、LCN2和H3K18la的表达水平,与上述的实验结果一致。综上所述,circXRN2通过调控Hippo信号通路来抑制人膀胱癌中H3K18乳酸化介导的肿瘤进展。
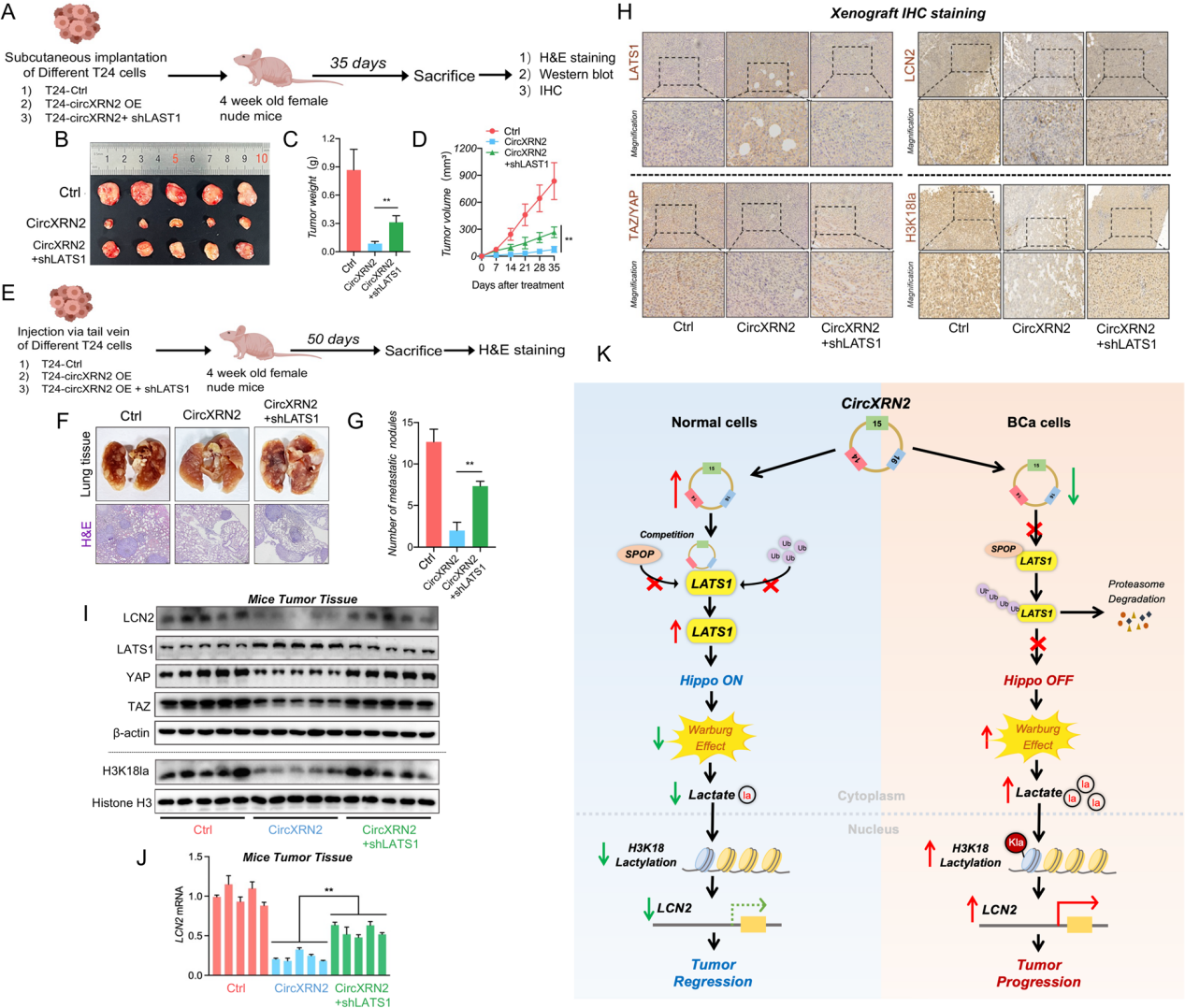 图8 CircXRN2/LATS1轴抑制膀胱癌肿瘤生长和转移
图8 CircXRN2/LATS1轴抑制膀胱癌肿瘤生长和转移
总结
本研究探索了环状RNA的一种新的分子机制,并为环状RNA和H3K18乳酸化调节人膀胱癌的肿瘤进展提供了具体的证据。特别地,circXRN2通过调节H3K18乳酸化来抑制膀胱癌的进展。在机制上,circXRN2与LAST1蛋白结合,保护其免受SPOP介导的泛素化降解,随后调控Hippo信号通路,抑制H3K18乳酸化。本研究结果将有助于发现人类膀胱癌新的分子靶点和治疗策略。
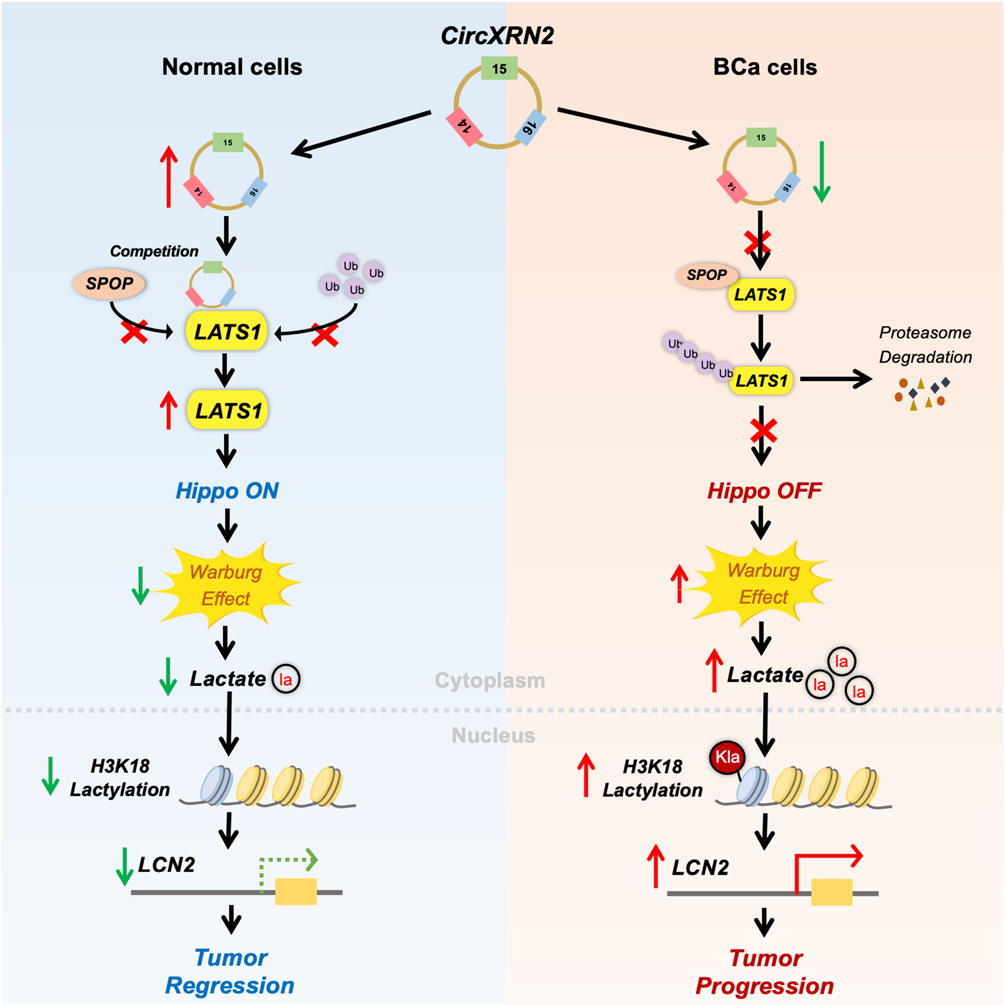 图9 circXRN2通过调控Hippo信号通路,抑制人膀胱癌中由H3K18乳酸化驱动的肿瘤进展
图9 circXRN2通过调控Hippo信号通路,抑制人膀胱癌中由H3K18乳酸化驱动的肿瘤进展
原文链接:
https://doi.org/10.1186/s12943-023-01856-1
.png)
