乳腺癌是女性中最常见的恶性肿瘤,其新发病例和死亡人数居世界第一。人表皮生长因子受体2(HER2)阳性乳腺癌作为一种特殊的亚型,其特征是侵袭性和预后不良。曲妥珠单抗是一种人源化单克隆抗体,在临床前和临床试验中均显示出相当大的抗肿瘤疗效。然而,很大比例的患者最终会对曲妥珠单抗产生耐药性,这极大地限制了其临床应用。而NRF2高表达的HER2乳腺癌患者在接受曲妥珠单抗治疗后的无进展生存期更短,表明NRF2对曲妥珠单抗耐药至关重要。另外,部分环状RNA已被证明可以直接翻译成功能蛋白,参与癌症的发生、发展和进展。那么它们是否与曲妥珠单抗的耐药性有关,以及与NRF2蛋白之间的关系,还需要进一步研究。
2023年9月28日,西安交通大学第二附属医院Zeng Kaixuan在Redox Biology(IF=11.4)发表文章“The novel β-TrCP protein isoform hidden in circular RNA confers trastuzumab resistance in HER2-positive breast cancer”。本研究揭示了一种由环状RNA编码多肽驱动曲妥珠单抗耐药的新机制,同时为抗肿瘤药物复敏策略提供了概念验证和理论基础。
circ-β-TrCP在曲妥珠单抗耐药的HER2阳性乳腺癌中表达上调
作者筛选了曲妥珠单抗耐药乳腺癌细胞(BT474-TR)和BT474细胞之间环状RNA的差异表达。并采用qRT-PCR检测验证发现circ-β-TrCP在BT474-TR细胞中上调率最高(图1A-B),因此选择其进行后续研究。同样,circ-β-TrCP在人耐曲妥珠单抗的乳腺癌组织中过表达(图1C),且表达高circ-β-TrCP的患者比表达低circ-β-TrCP的患者总生存时间更短(图1C-D)。序列比对结果显示,circ-β-TrCP来源于β-TrCP前mRNA第7和13外显子的反向剪接,全长913 bp(图1F-G)。RNase R酶进一步验证了circ-β-TrCP的稳定性,且半衰期更长(图1H-M),另外,qRT-PCR和FISH结果显示,circ-β-TrCP主要位于曲妥珠单抗敏感和耐药细胞的细胞质中(图1N-R),表明在曲妥珠单抗耐药过程中,circ-β-TrCP的定位没有改变。综上所述,circ-β-TrCP是一种细胞质环状RNA,可能对曲妥珠单抗的耐药性至关重要。
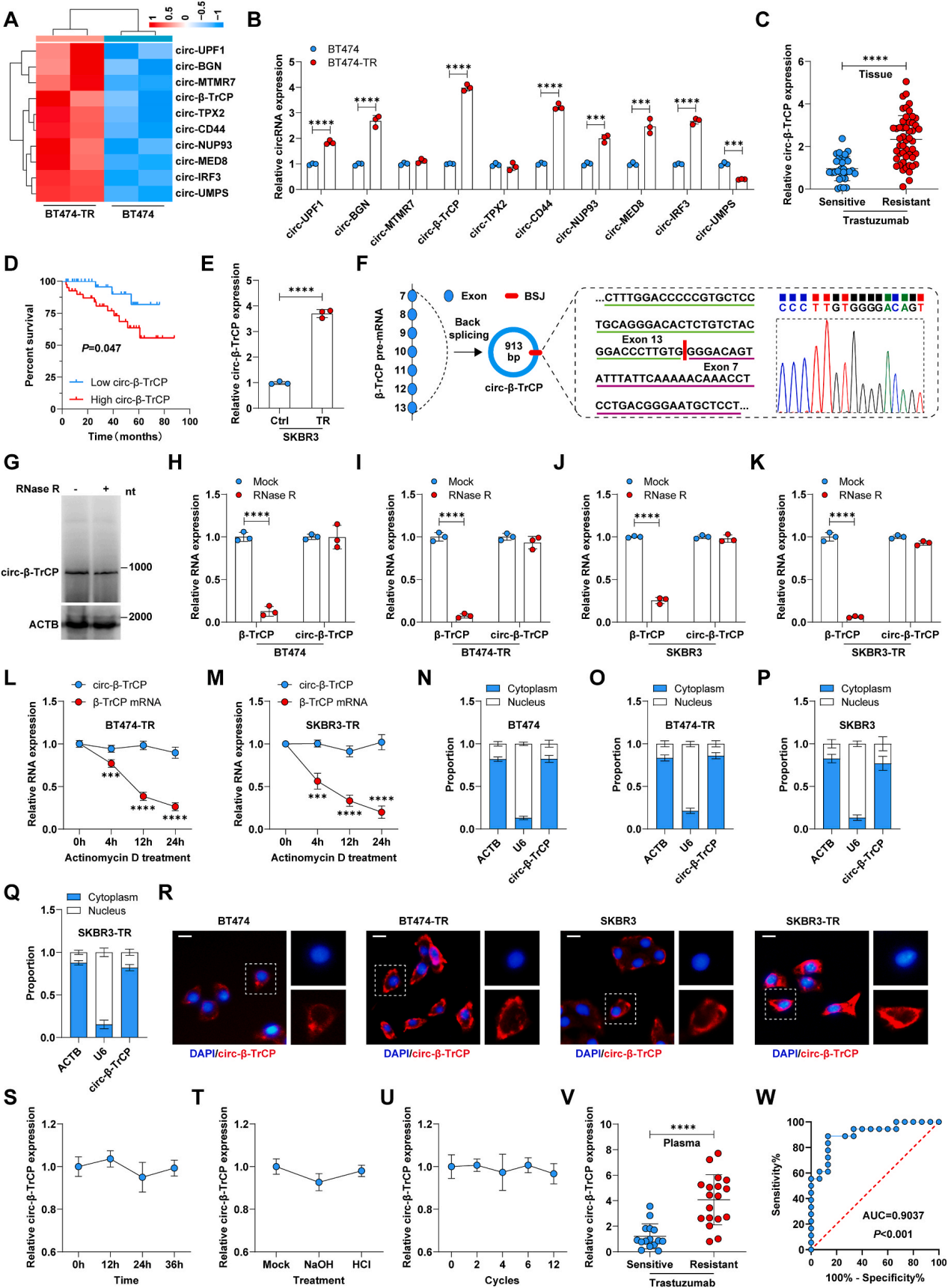 图1 circ-β-TrCP在曲妥珠单抗耐药的HER2阳性乳腺癌中高表达
图1 circ-β-TrCP在曲妥珠单抗耐药的HER2阳性乳腺癌中高表达
circ-β-TrCP促进曲妥珠单抗耐药性
作者使用CRISPR/Cas13d系统敲低曲妥珠单抗耐药细胞中的内源性circ-β-TrCP,并建立了稳定的细胞系(图2A)。CCK-8的结果显示,在曲妥珠单抗治疗后,circ-β-TrCP敲低后,细胞活力显著降低,细胞集落形成较少,ROS水平升高(图2C-F)。此外,作者在BT474和SKBR3细胞中过表达circ-β-TrCP,细胞集落形成和细胞活力显著增强,而ROS水平在曲妥珠单抗治疗后降低(图2G-K)。
接着作者建立原位移植肿瘤模型,评估circ-β-TrCP对曲妥珠单抗耐药的体内影响。将BT474-TR细胞原位注射到NOD/SCID小鼠的腹部乳腺脂肪垫中,然后每周给药曲妥珠单抗(图2L)。结果显示,BT474-TR来源的肿瘤对曲妥珠单抗具有高度耐药性,但敲低circ-β-TrCP后,肿瘤体积明显较小(图2N-P)。相比之下,在接受曲妥珠单抗治疗后,BT474来源的肿瘤体积减小,而过表达circ-β-TrCP显著降低了曲妥珠单抗的治疗效果(图2Q-U)。综上所述,体外和体内的结果表明,circ-β-TrCP是曲妥珠单抗耐药性的驱动因素。
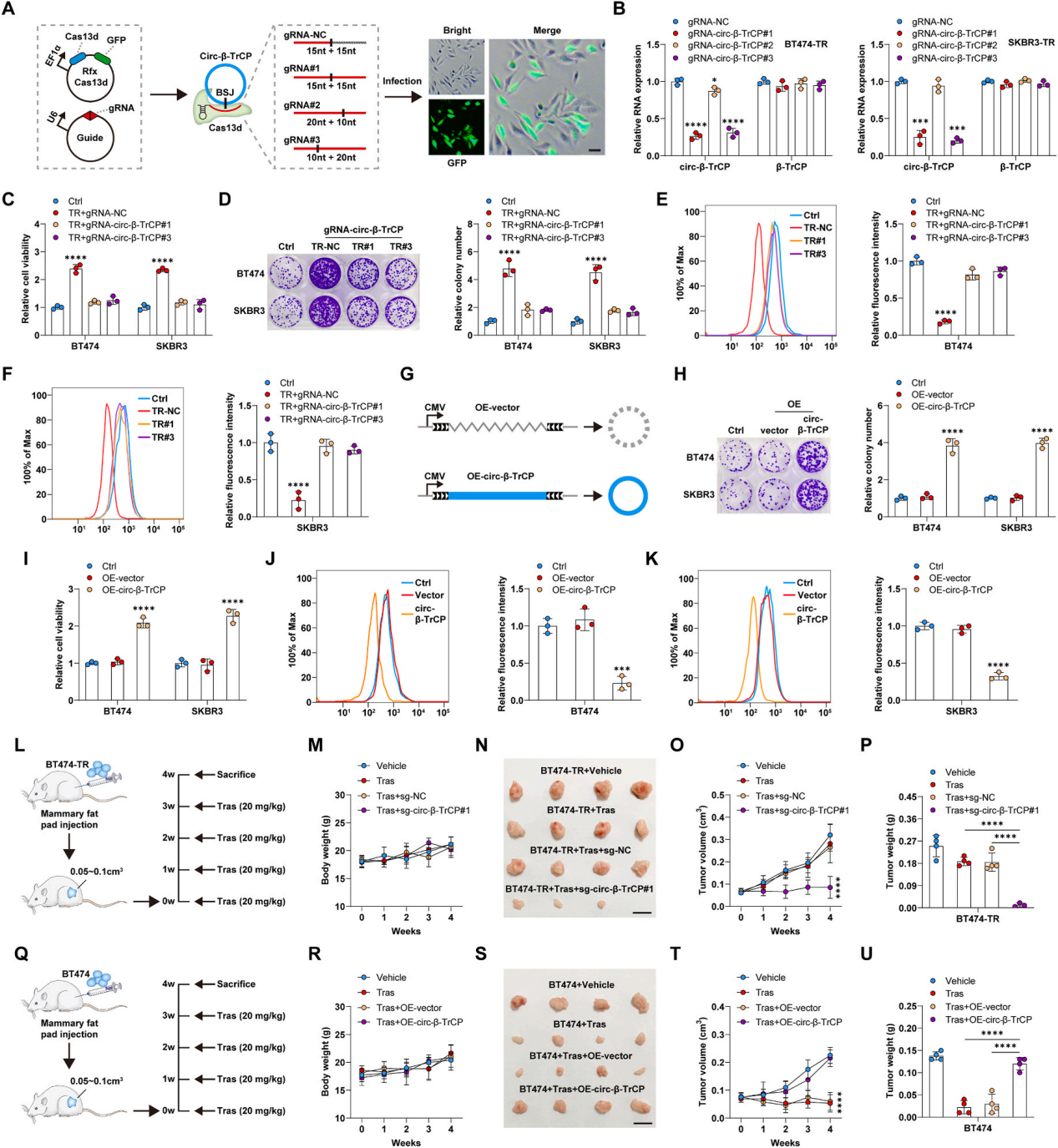 图2 circ-β-TrCP驱动曲妥珠单抗耐药性
图2 circ-β-TrCP驱动曲妥珠单抗耐药性
circ-β-TrCP通过编码β-TrCP-343aa促进曲妥珠单抗耐药性
作者通过对TransCirc数据库分析,发现circ-β-TrCP可能在连接位点编码一个343个氨基酸的蛋白,预测分子量为36 KDa,命名为β-TrCP-343aa(图3A)。为了检测circ-β-TrCP是否可翻译,作者构建了带circ-β-TrCPOE载体、circ-β-TrCPOE/Flag载体和circ-β-TrCPmut/flag突变载体(图3 B-C)。结果发现,转染circ-β-TrCPOE/Flag组在35 KDa附近检测到Flag条带。质谱分析进一步验证了β-TrCP-343aa的存在(图3D-E)。同时,在转染circ-β-TrCP过表达载体的细胞中,该蛋白信号显著增强,circ-β-TrCPmut/flag载体没有变化(图3 D-E)。荧光结果显示,circ-β-TrCP和β-TrCP-343aa分别主要位于细胞质和细胞核中(图3F)。此外,与曲妥珠单抗敏感的对照组相比,β-TrCP-343aa在曲妥珠单抗耐药的细胞和组织中过表达(图3G-I)。circ-β-TrCP的敲低显著降低了BT474-TR和SKBR3-TR细胞内源性β-TrCP-343aa水平,而这些作用被circ-β-TrCPOE阻断,而没有被circ-β-TrCPmut阻断(图3J)。在功能上,circ-β-TrCPOE消除了在曲妥珠单抗治疗后,circ-β-TrCP敲低导致的细胞活力降低、集落形成和ROS含量增加(图3 K-O)。综上所述,circ-β-TrCP编码产物,而不是circ-β-TrCP本身,赋予了细胞曲妥珠单抗耐药性。
接着作者使用RNAi筛选来确定调控circ-β-TrCP翻译过程的因子。qRT-PCR和免疫印迹结果显示,eIF3亚基的敲低明显影响了β-TrCP-343aa的产生,而对circ-β-TrCP的表达影响不大,说明eIF3参与了circ-β-TrCP的翻译。其中,eIF3a和eIF3b敲低降低β-TrCP-343aa水平,而eIF3j敲低与此相反,说明eIF3j通过阻断eIF3a和eIF3b与circRNA的结合抑制circRNA翻译(图3 P-Q)。
然后作者采用合成的全长circ-β-TrCP和纯化的eIF3j蛋白进行体外结合实验,结果显示circ-β-TrCP直接与eIF3j结合(图3 R-S)。此外,RIP和RNA pulldown实验进一步验证了circ-β-TrCP和eIF3j蛋白之间的相互作用(图T-U)。另外,在BT474-TR和SKBR3-TR细胞中,eIF3a、eIF3b和eIF3j蛋白均被circ-β-TrCP探针拉出,而在eIF3j过表达的情况下,很少或几乎没有eIF3a和eIF3b蛋白与circ-β-TrCP相互作用(图V)。综上所述,circ-β-TrCP的翻译受到eIF3j的负调控。
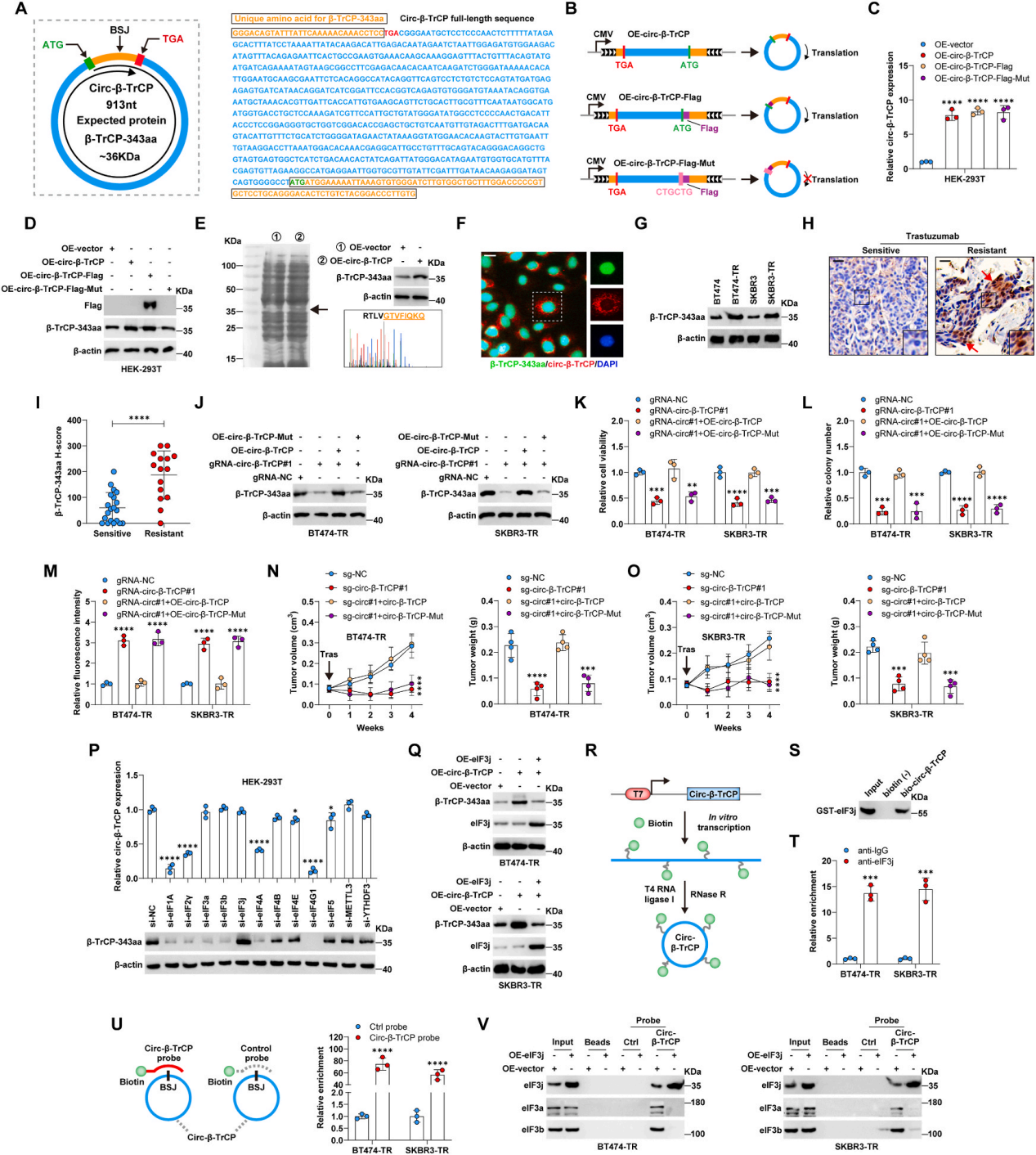 图3 circ-β-TrCP编码β-TrCP-343aa,它受到eIF3j的抑制
图3 circ-β-TrCP编码β-TrCP-343aa,它受到eIF3j的抑制
β-TrCP-343aa阻断SCFβ-TRCP介导的NRF2降解
鉴于β-TrCP-343aa包含β-TrCP的WD结构域,而β-TrCP降解核NRF2,这是曲妥珠单抗耐药的关键因素,推断β-TrCP-343aa可能通过影响β-TrCP/NRF2轴发挥作用。与预期的一样,在BT474-TR和SKBR3-TR细胞中敲低circ-β-TrCP显著降低了NRF2蛋白水平,但可以通过恢复circ-β-TrCP的过表达来逆转(图4A)。与对照组细胞相比,circ-β-TrCP敲低细胞中的NRF2靶点的mRNA水平以及NRF2转录活性降低,这些影响可被circ-β-TrCP过表达所抵消(图4B和C)。值得注意的是,NRF2 mRNA的丰度没有变化(图4B),这表明β-TrCP-343aa在转录后水平上调节NRF2。用环己酰亚胺(CHX)阻断蛋白合成后,下调circ-β-TrCP后,NRF2蛋白的降解速率显著加快(图4D和E)。circ-β-TrCP敲低导致的NRF2蛋白下降被MG132(一种蛋白酶体抑制剂)阻断,而氯喹(CQ,一种自噬抑制剂)没有阻断(图4F),表明泛素蛋白酶体系统参与了β-TrCP-343aa介导的NRF2蛋白周转调节。同样,在circ-β-TrCP敲低的细胞中,NRF2的泛素化水平显著增加,这些作用被过表达circ-β-TrCP或线性β-TrCP-343aa所阻断(图4G和H)。此外,敲低circ-β-TrCP能够在萝卜硫素(SFN,NRF2激活剂;SFN能够修饰KEAP1的关键胱氨酸残基,以抑制NRF2泛素化)存在的情况下降低NRF2蛋白水平(图4F)。综上所述,β-TrCP-343aa可以稳定NRF2蛋白,而不依赖于KEAP1。
β-TrCP和β-TrCP-343aa蛋白序列都具有与NRF2结合的WD结构域,但β-TrCP-343aa缺少F-box结构域,而F-box结构域能招募SKP1-Cul1-Rbx1复合物降解NRF2(图4J)。IP结果显示,SKP1免疫沉淀了β-TrCP,而不是β-TrCP-343aa(图4K)。推测β-TrCP-343aa可能与β-TrCP竞争结合NRF2,导致NRF2未被降解。蛋白对接模型显示,β-TrCP-343aa比β-TrCP具有更高的NRF2结合能力(图4L)。在BT474-TR和SKBR3-TR细胞中,通过IP检测验证了β-TrCP-343aa和NRF2之间的内源性相互作用(图4M)。此外,外源性HA-NRF2也通过circ-β-TrCP翻译的Flag-β-TrCP-343aa免疫沉淀(图4N)。与预期的那样,circ-β-TrCP敲低导致更多的NRF2与β-TrCP结合,同时NRF2蛋白表达下降,这些现象被circ-β-TrCP过表达所抵消(图4 O-P)。此外,过表达β-TrCP的BT474-TR和SKBR3-TR细胞中NRF2蛋白水平降低,而泛素化水平升高,但能被circ-β-TrCP或线性β-TrCP-343aa阻断(图4 Q-R)。已知β-TrCP与NRF2的Neh6结构域结合需要GSK3磷酸化的降解子,推测β-TrCP-343aa与NRF2的结合也是如此。结果显示,过表达β-TrCP或敲低circ-β-TrCP显著降低了NRF2−/−细胞中的NRF2水平,而不是HA-NRF2-S4A4(NRF2的Neh6磷酸化蛋白内的四个丝氨酸的丙氨酸替代物),这些现象在GSK3抑制剂SB216763处理后消失。此外,IP结果显示,NRF2-S4A4未能与β-TrCP和β-TrCP-343aa结合(图4T)。
综上所述,circ-β-TrCP编码的β-TrCP-343aa通过抑制β-TrCP/NRF2相互作用直接结合并稳定NRF2蛋白,该相互作用独立于KEAP1通路,但需要GSK3活性。
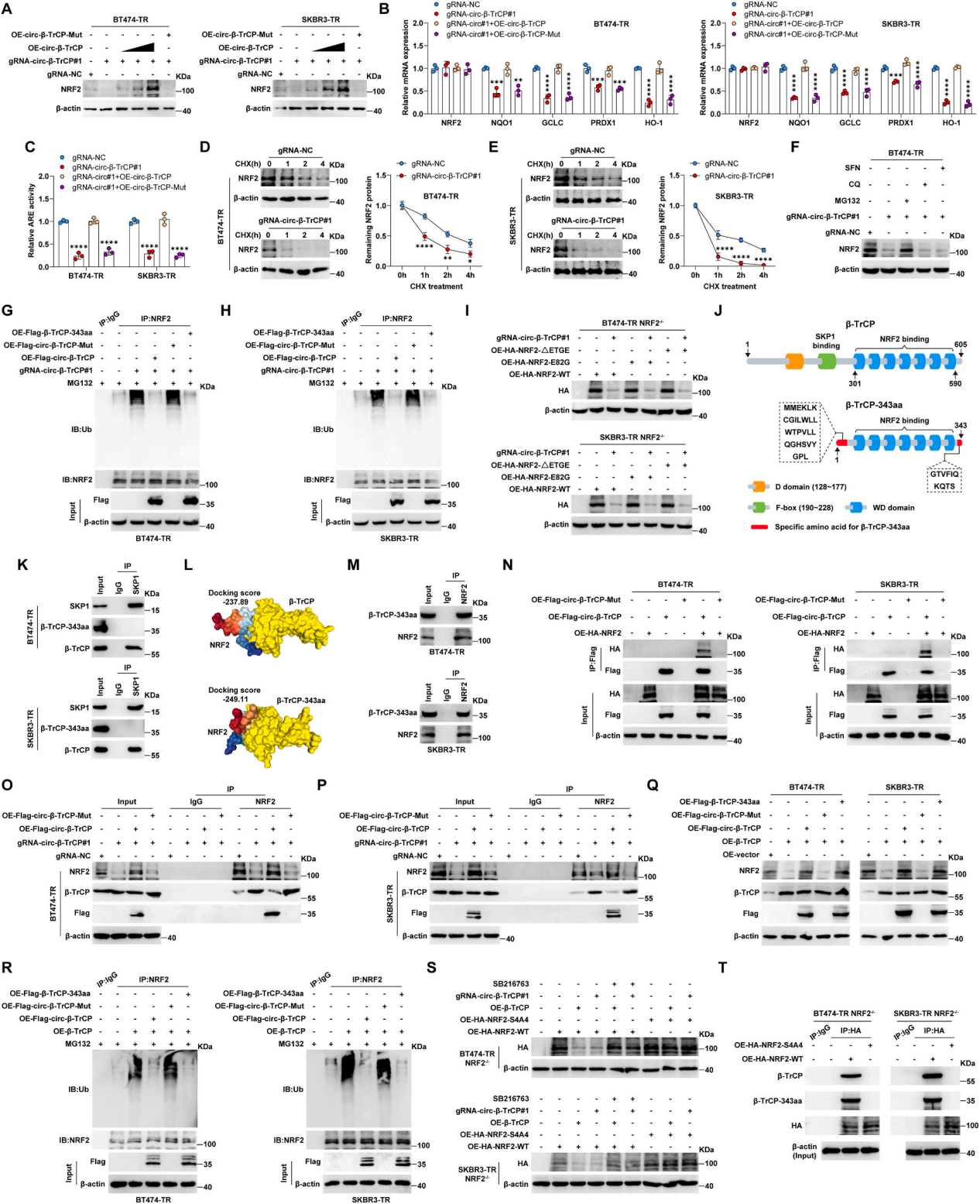 图4 β-TrCP-343aa阻断SCFβ-TRCP介导的NRF2降解
图4 β-TrCP-343aa阻断SCFβ-TRCP介导的NRF2降解
NRF2通过转录抑制eIF3j,在正常和氧化应激条件下提高circ-β-TrCP的翻译效率
曲妥珠单抗或过氧化氢治疗增加了β-TrCP-343aa的水平,然而,circ-β-TrCP的表达没有改变(图5A-D),这表明circ-β-TrCP的翻译是受氧化应激调控的。但是在NRF2−/−细胞中,曲妥珠单抗或过氧化氢处理后,β-TrCP-343aa的表达保持不变(图5E),这表明NRF2在氧化应激条件下对β-TrCP-343aa的产生至关重要。敲低NRF2可降低β-TrCP-343aa的表达,但没有降低circ-β-TrCP的表达(图5 F-G),再次表明NRF2调控了β-TrCP-343aa的表达。此外,与野生型NRF2细胞相比,NRF2−/−细胞中eIF3j蛋白表达上调,NRF2过表达可逆转这一效应(图5H)。同时过表达eIF3j可拮抗NRF2过表达升高的β-TRCP-343aa水平(图5I),表明eIF3j参与了NRF2介导的β-TrCP-343aa的调控。此外,eIF3j的mRNA水平与其蛋白水平一样,也受到NRF2的调控(图5J)。
通过对编码数据集的NRF2 ChIP-seq数据进行分析,发现许多NRF2峰位于eIF3j的启动子区域(图5K)。此外,使用JASPAR在线工具,在eIF3j启动子的−21 ~−11区域发现了一个ARE(图5L)。然后对ARE进行突变,并进行荧光素酶报告基因检测,结果显示,敲低NRF2显著增加了野生型eIF3j启动子的活性,而对突变型1没有影响(图5M)。同样,BT474-TR和SKBR3-TR细胞的细胞核提取物中的NRF2蛋白被野生型eIF3j启动子探针富集,但突变探针不富集(图5N)。接下来,作者设计了三对针对eIF3j启动子中指定区域的引物(P1和P2为阴性对照组,P3含有ARE)(图5L),然后ChIP检测NRF2与eIF3j启动子的结合。如图5O所示,NRF2拉下的片段仅被P3扩增。qRT-PCR结果显示,NRF2在eIF3j启动子中ARE基序上的富集量几乎是IgG的4倍(图5P)。此外,曲妥珠单抗治疗显著增加了NRF2在eIF3j启动子上的富集(图5Q-R)。在功能上,在NRF2−/−细胞中,过表达circ-β-TrCP并不影响曲妥珠单抗治疗后的细胞活力(图5S),而在曲妥珠单抗存在的情况下,circ-β-TrCP的过表达所引起的细胞活力和集落形成的增强在引入eIF3j后被显著抑制(图5T和U),表明circ-β-TrCP通过NRF2/eIF3j轴促进曲妥珠单抗耐药性。
综上所述,NRF2通过转录抑制eIF3j来加速circ-β-TrCP的翻译过程,从而在β-TrCP-343aa和NRF2之间形成一个正向调控环,加速曲妥珠单抗耐药性。
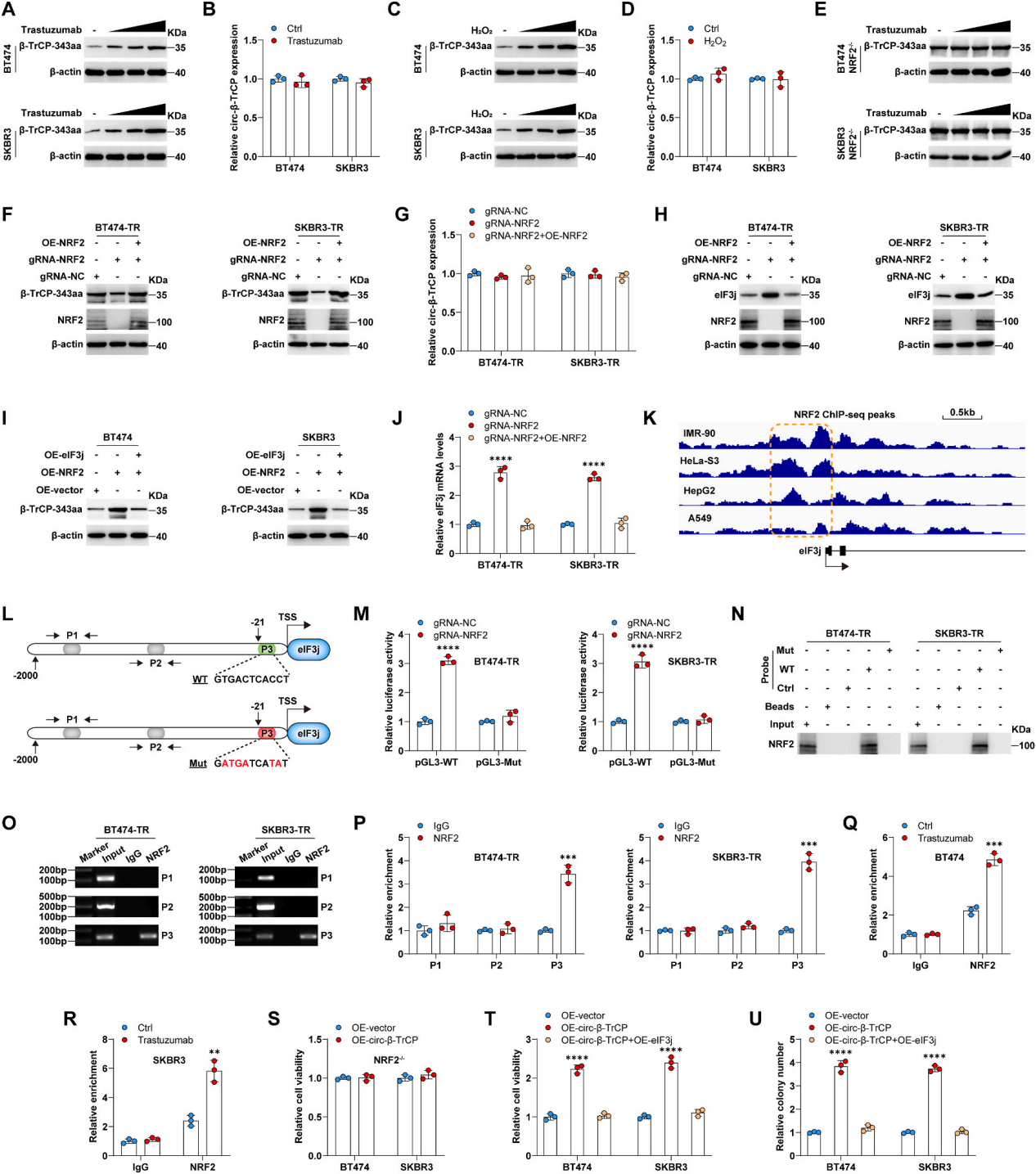 图5 NRF2通过转录抑制eIF3j来提高circ-β-TrCP的翻译效率
图5 NRF2通过转录抑制eIF3j来提高circ-β-TrCP的翻译效率
总结:
circ-β-TrCP在曲妥珠单抗耐药性中起着重要作用。对circ-β-TrCP表达的基因干预显著改变了乳腺癌细胞对曲妥珠单抗的体内外敏感性。进一步的研究表明,circ-β-TrCP以NRF2依赖的方式有助于曲妥珠单抗的耐药性。circ-β-TrCP编码一种新的β-TrCP蛋白亚型,β-TrCP-343aa,与β-TrCP竞争,在细胞核中与NRF2结合,从而阻断SCFβ-TrCP E3复合物介导的NRF2泛素化降解。此外,在正常条件或者氧化应激条件下,eIF3j都会抑制circ-β-TrCP的翻译,而NRF2能够直接与eIF3j启动子结合并抑制其转录,从而在β-TrCP-343aa和NRF2之间形成正循环,最终加速曲妥珠单抗的抗性。此研究为环状RNA编码功能在细胞生物学中的重要性提供了新的证据,也为HER2阳性乳腺癌患者对曲妥珠单抗耐药的机制提供了新的见解。
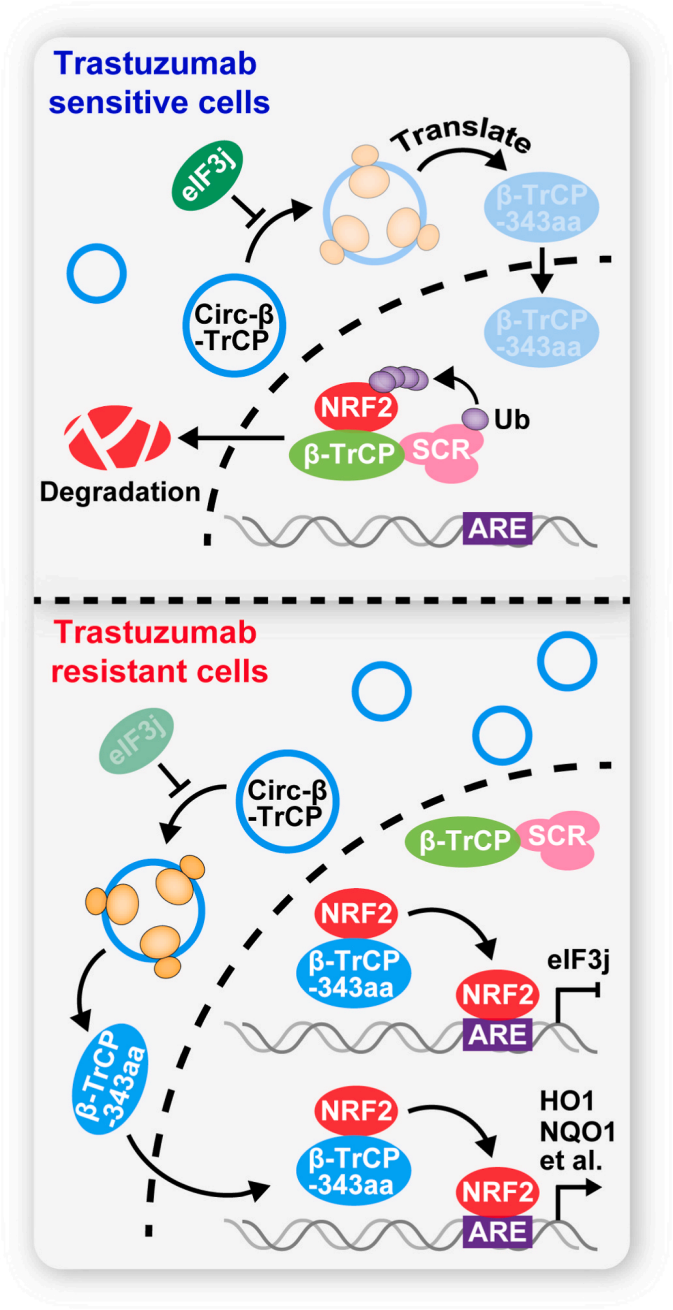 图6 circ-β-TrCP调控曲妥珠单抗耐药性的作用机制
图6 circ-β-TrCP调控曲妥珠单抗耐药性的作用机制
原文链接:
https://doi.org/10.1016/j.redox.2023.102896
.png)
