胰腺癌以高恶性肿瘤和有限的治疗选择,被认为是重大的全球卫生挑战。化疗虽然是改善局部晚期或转移性胰腺癌预后的最有效手段之一,但化疗耐药性却是一个临床障碍。胰腺癌最有效的化疗方案是叶酸,奥沙利铂是关键的活性药物。但是,目前数据来看,只有21%的胰腺癌患者对铂类药物敏感。因此,需要研究胰腺癌中铂耐药的机制以及如何提高铂敏感性,为治疗胰腺癌提供思路。
细胞外囊泡(EVs)是一种新的细胞间通信手段,可携带各种生物活性分子来调节受体细胞的活性。并且环状RNA(circRNAs)在EV中丰富且稳定,可在细胞间发挥特定功能。已有研究发现外泌体中的circRNA在介导肝细胞癌顺铂化疗耐药中的重要作用。但是针对EV包裹的circRNA在胰腺癌铂耐药中的作用未被广泛探索。
今年6月份,广东省人民医院陈汝福教授团队在Cancer Research(IF=11.2)发表文章,挖掘到了淋巴结转移性胰腺导管腺癌的潜在治疗靶点-circARFGEF2,为胰腺癌的诊断和治疗提供有力的参考依据。
推荐阅读:Cancer Res丨广东省人民医院陈汝福教授团队揭示circARFGEF2为淋巴结转移性胰腺导管腺癌的潜在治疗靶点
同年11月28日,广东省人民医院陈汝福教授团队在Journal of Experimental & Clinical Cancer Research(IF=11.3)再度发表circRNA在胰腺癌诊断/治疗方向的最新文章Extracellular vesicle-packaged circBIRC6 from cancer-associated fbroblasts induce platinum resistance via SUMOylation modulation in pancreatic cancer。在本研究中,作者发现了一种环状RNA-circBIRC6,富集于肿瘤相关成纤维细胞(CAFs)产生的EV中,在胰腺导管腺癌(PDAC)的化疗耐药性中起着关键作用。circBIRC6在CAF中的表达同奥沙利铂的化疗耐药性呈正相关。circBIRC6可通过调节非同源端连接(NHEJ)依赖的DNA修复,增强了胰腺癌细胞和类器官的奥沙利铂耐药性。具体机制在于,circBIRC6直接与XRCC4结合,增强XRCC4与SUMO1在赖氨酸115残基上的相互作用,从而促进XRCC4染色质的核定位,增加奥沙利铂耐药性。组合奥拉帕尼和circBIRC6和单独circBIRC6的抑制剂可显著抑制奥沙利铂化疗耐药性。
circBIRC6与奥沙利铂耐药密切相关
为了研究铂类化疗耐药性中参与CAF的关键环状RNA,我们对奥沙利铂耐药患者的CAFs及正常邻近组织相关成纤维细胞(NAFs)进行了高通量测序+qPCR分析,筛选出10个上调的circRNA(图1A)。但在这些circRNA中,仅有circBIRC6在奥沙利铂耐药患者的CAFs表达明显高于奥沙利铂灵敏患者;并且高表达的circBIRC6与较短的无进展生存期(PFS)密切相关(图1C-E);无铂化疗方案治疗的患者,circBIRC6表达与PFS没有关系了(图1F);这提示circBIRC6与奥沙利铂耐药息息相关。circBIRC6起源于BIRC6基因的第2~10外显子,成环验证和RNase R和放线菌素D实验验证其环化和耐受性(图1G-I)。综上提示,circBIRC6是一个共价封闭的环状RNA,并与奥沙利铂耐药有密切关系。
作者进一步阐明导致circBIRC6在铂耐药PDAC中上调的分子机制。RNA结合蛋白(RBPs)调节circRNA的生成已有文献报道。CircInteractome分析和qPCR的结果以及RIP的验证显示,EIF4A3蛋白与circBIRC6结合,并促进circBIRC6的生成。
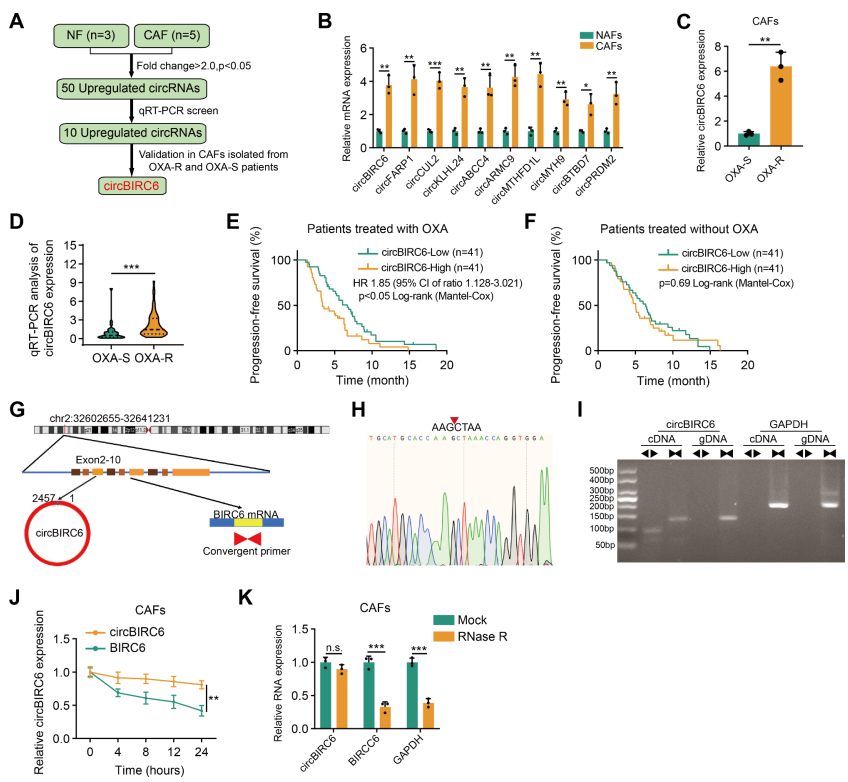 图1 circBIRC6与奥沙利铂耐药密切联系
图1 circBIRC6与奥沙利铂耐药密切联系
circBIRC6被包装成EV,可传递到肿瘤细胞中
前面提到circBIRC6富集在CAF中而非NAF。有趣的是,circBIRC6也富集CAFs的培养基(CM)而非NAFs(图2A-B)。与NAF-CM共培养或单独培养的PDAC细胞相比,CAF-CM共培养的PDAC细胞系中circBIRC6水平显著升高,提示circBIRC6可传递到PDAC细胞系中。细胞外circBIRC6研究发现,RNase处理没有影响CAF-CM中circBIRC6的水平;而RNase和Triton X-100(通透液)联合处理可降低CAF-CM中circBIRC6的水平(图2C),提示circBIRC6可能存在CM的EV中。此外,用α-鹅膏蕈碱处理Panc-1细胞(CAF-CM共培养)抑制内源性转录,并不影响Panc-1细胞中circBIRC6的升高(图2D),再度提示EV-circBIRC6可传递到Panc-1细胞中,产生富集。综上提示,CAF-CM中富集EV-circBIRC6,并且可以传递到肿瘤细胞中。
为了证实细胞外circBIRC6被包裹在EV中,作者从CAF-CM中分离了EV。NanoSight和WB验证了ev的形态、大小和生物标志物(图2E-G)。EV中circBIRC6的水平与CAF-CM中几乎相同(图2H),这意味着circBIRC6在caf分泌的EV中富集,而不是直接释放。此外,血浆EV包裹的circBIRC6水平与来自配对CAF-EV-circBIRC6呈正相关(图2I),表明血浆EV-circBIRC6主要来自PDAC微环境中的CAF。
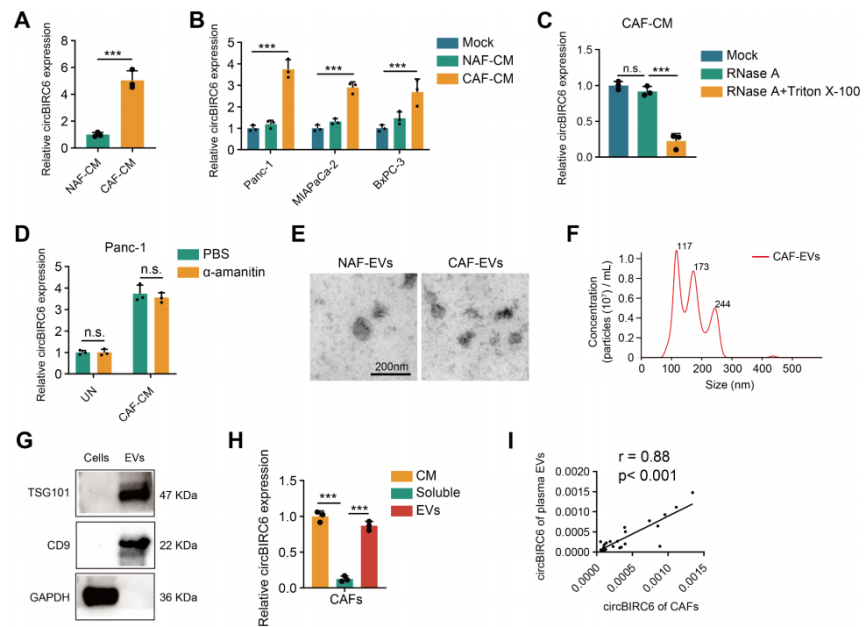 图2 CAF-EV-circBIRC6可传递到肿瘤细胞中
图2 CAF-EV-circBIRC6可传递到肿瘤细胞中
离体研究——CAF-EV-circBIRC6促进奥沙利铂耐药
为了探索CAF-EV-circBIRC6在体外调控奥沙利铂耐药,作者分别先在过表达和敲低circBIRC6的CAFs中分离EV(图3A-B);随后,将PDAC细胞系与这些EV共孵育。结果显示,过表达circBIRC6的CAF-EV对奥沙利铂治疗表现出了更高的半抑制浓度值和更高的细胞增殖,而沉默circBIRC6则相反(图3C-F)。此外,CAF-EV-circBIRC6可减弱奥沙利铂诱导的PDAC细胞凋亡,促进胰腺癌类器官增殖;而CAF-EV-sh-circBIRC6则相反(图3G-J)。综上表示,离体研究中,CAF-EV-circBIRC6可正向调控奥沙利铂耐药性。
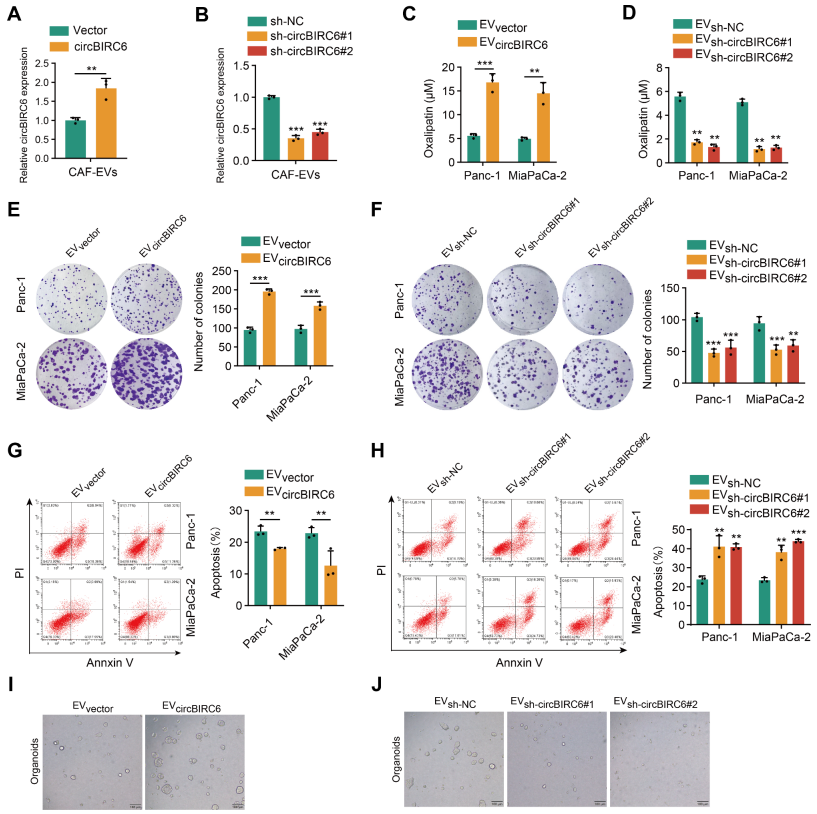 图3 CAF-EV-circBIRC6可正向调控奥沙利铂耐药性
图3 CAF-EV-circBIRC6可正向调控奥沙利铂耐药性
circBIRC6通过NHEJ通路诱导奥沙利铂耐药
为了进一步阐明EV-circbirc6驱动的奥沙利铂耐药机制,作者对敲低circbirc6的CAF和对照细胞进行测序和KEGG分析,发现富集在DNA修复途径上(图4A)。双链DNA断裂(DSB)修复被认为是奥沙利铂耐药的关键机制之一。随后,作者使用中性彗星实验(检测DNA双链的断裂损伤)研究EV-circbirc6是否改变了PDAC细胞中DSB修复的效率。结果显示,CAF-EV-circbirc6组有更短的彗星尾,且γH2AX水平降低,CAF-EV-sh-circbirc6组则相反,提示circbirc6对DSB修复的促进作用(图4B-E)。HR和NHEJ是DSB修复的关键途径。CAF-EV-circbirc6提高了NHEJ的效率,但没有提高HR(图4F-G)。SCR7可抑制NHEJ通路,实验结果显示,SCR7可逆转CAF-EV-circbirc6促进肿瘤细胞增殖的作用;γH2AX分析结果与之一致(图4H-I)。综上结果表明,circBIRC6通过NHEJ通路介导奥沙利铂耐药,而阻断NHEJ通路可消除circBIRC6对奥沙利铂耐药的影响。
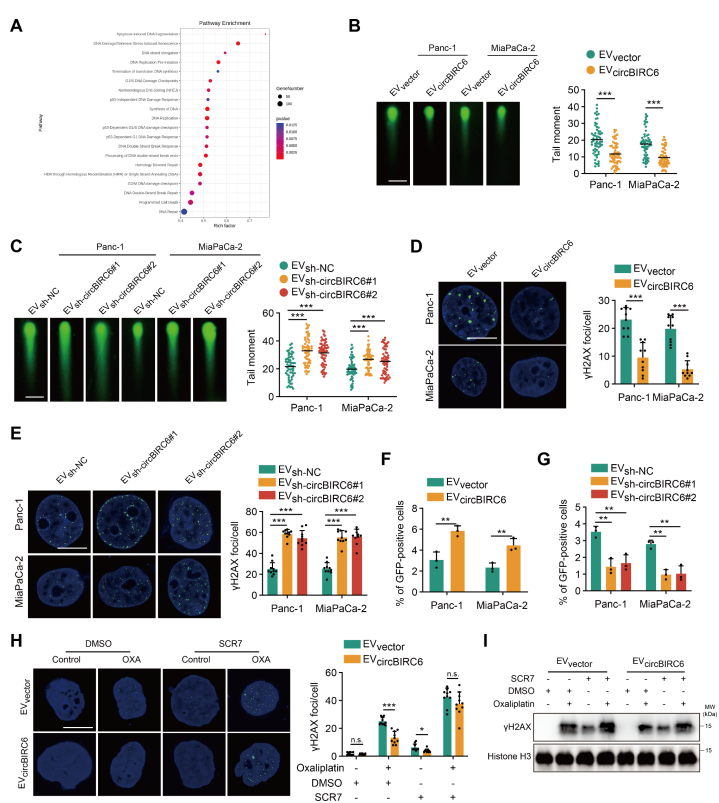 图4 circBIRC6通过NHEJ通路诱导奥沙利铂耐药
图4 circBIRC6通过NHEJ通路诱导奥沙利铂耐药
circBIRC6与XRCC4结合
为了确定circBIRC6提高NHEJ修复效率的机制,作者又通过RNApulldown+MS+WB+RIP实验确定在PANC-1细胞中circBIRC6结合XRCC4(图5A-E)。CAF-EV-sh-circBIRC6不影响Panc-1细胞中XRCC4 mRNA和蛋白水平(图5F-G)。令人惊讶的是,作者发现CAF-EV-circBIRC6增强了XRCC4向染色质的募集(促进XRCC4核定位,可提高NHEJ修复效率),CAF-EV-sh-circBIRC6则相反(图5H)。接下来,作者合成了circBIRC6的分段探针,并确定了circBIRC6的400-600nt区域对于XRCC4的相互作用是至关重要的(图5I-J)。非编码RNA通常通过茎环结构与蛋白质相互作用。我们预测circBIRC6(500-545)是形成了双链茎环结构(图5K),关于这个位点的突变也削弱了XRCC4蛋白RIP下来的circBIRC6的量以及XRCC4核定位(图5L-M)。
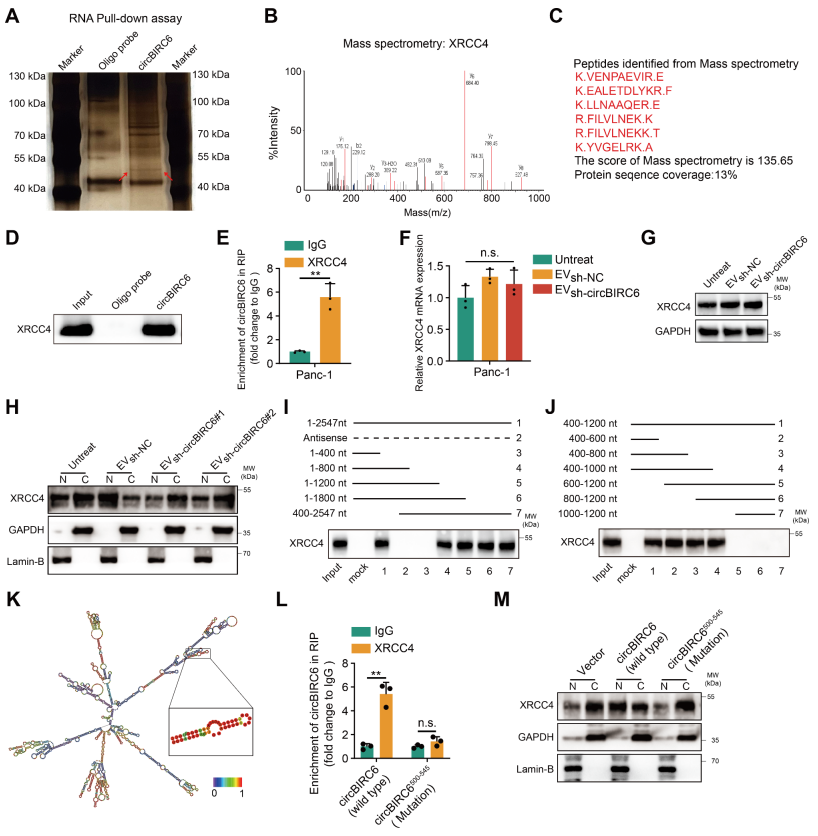 图5 circBIRC6与XRCC4结合
图5 circBIRC6与XRCC4结合
EV-circBIRC6通过SUMO修饰正向调控XRCC4定位
翻译后的修饰(PTMs)在蛋白质定位中是非常重要的。为了确定参与XRCC4核定位的关键PTM,我们用CAF-EV和各种PTM抑制剂处理PANC-1细胞。CAF-EV促进XRCC4核定位;抑制SUMO修饰(2-D08)可抑制XRCC4核定位(图6A)。CO-IP结果也证实了sh-circBIRC6显著降低修饰因子SUMO1与XRCC4的连接,但没有显著改变XRCC4的泛素化、磷酸化或甲基化(图6B)。这提示circBIRC6影响XRCC4的SUMO修饰。Co-IP分析表明,circBIRC6增强了XRCC4与SAE1(sumo激活酶)互作(图6C)。si-SAE1可减轻SUMO1对XRCC4的修饰,并抑制了XRCC4的核定位(图6D-E)。考虑到修饰残基在SUMO修饰对靶蛋白影响中的重要作用,我们利用GPS-SUMO(预测SUMO修饰),确定了XRCC4上两个潜在的SUMO修饰位点(K115和K210)(图6F-G)。实验表示,K115R突变而不是K210R突变显著阻碍了XRCC4的SUMO修饰和核定位(图6H-J)。然后,作者研究了SUMO修饰依赖的XRCC4核定位是否对EV-circBIRC6介导的奥沙利铂耐药是必要的。结果显而易见,XRCC4的K115R突变抵消了EV-circBIRC6诱导的奥沙利铂耐药(图6K)。综上所述,EV-circBIRC6是通过SUMO修饰途径促进XRCC4核定位,从而促进奥沙利铂耐药。
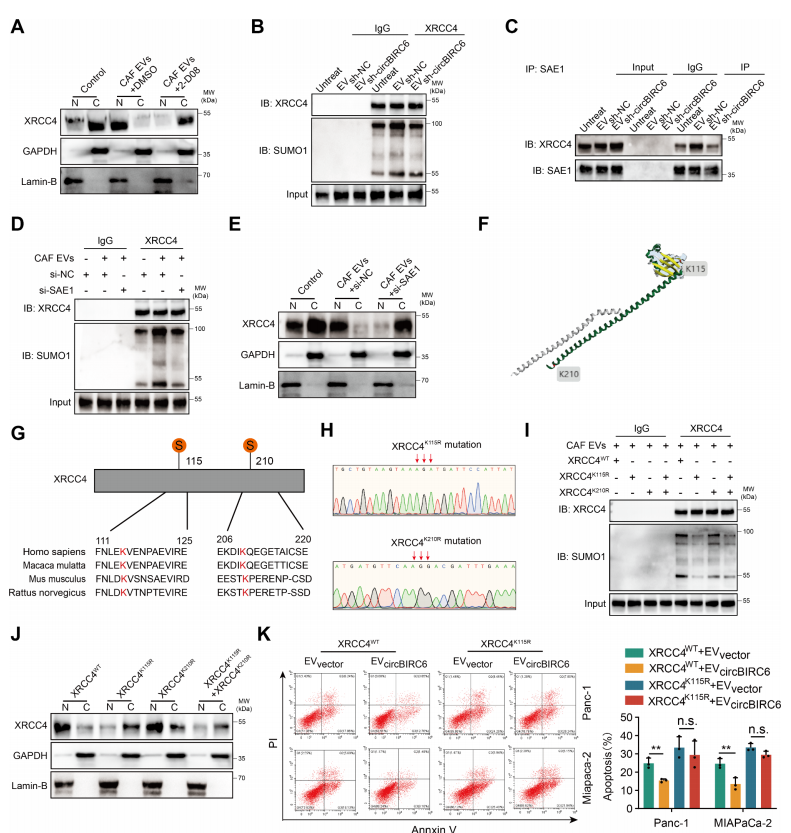 图6 EV-circBIRC6通过SUMO修饰正向调控XRCC4核定位,促进奥沙利铂耐药
图6 EV-circBIRC6通过SUMO修饰正向调控XRCC4核定位,促进奥沙利铂耐药
在体研究——EV-circBIRC6诱导胰腺癌奥沙利铂耐药
为了研究EV-circBIRC6在体内的作用,将XRCC4-WT或XRCC4-Mut转导的PANC-1细胞注射到小鼠的胰腺尾部,并用奥沙利铂和CAF-EV处理原位异种移植小鼠(图7A)。静脉注射CAF-EV-circBIRC6导致化疗效果不佳,肿瘤体积更大,DSBs水平和细胞凋亡水平降低,而XRCC4突变可逆转这些效应,抑制肿瘤生长(图7B-F)。
为了评估circBIRC6/XRCC4轴的潜在治疗价值,作者在临床奥沙利铂耐药患者建立了患者来源的异种移植(PDX)小鼠模型,并使用靶向circBIRC6的反义寡核苷酸(ASO)抑制剂进行治疗(图7G)。与预期的一样,ASO-circBIRC6的治疗显著改善了化疗反应。此外,奥沙利铂与ASO-circBIRC6和奥拉帕尼联合使用,显著提高了化疗反应(图7H)。IHC分析显示,ASO-circBIRC6或ASOcircBIRC6联合奥拉帕尼治疗可增加DSBs水平和细胞凋亡(图7I)。综上所述,CAF-EV-circBIRC6通过SUMO修饰途径正向调控XRCC4核定位,促进奥沙利铂耐药。
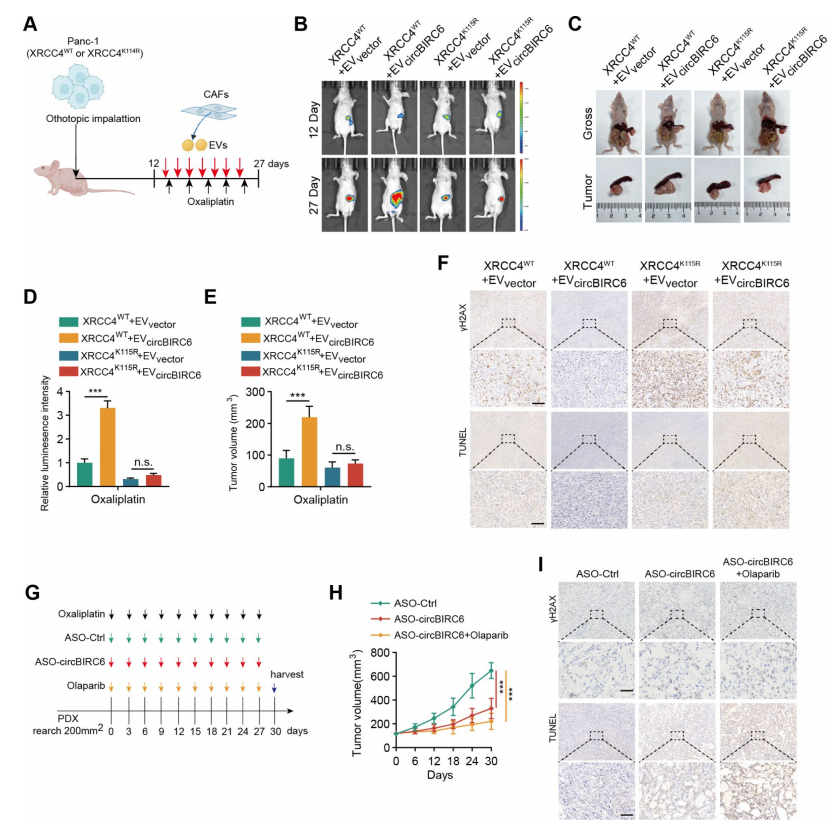 图7 EV-circBIRC6诱导胰腺癌奥沙利铂耐药
图7 EV-circBIRC6诱导胰腺癌奥沙利铂耐药
circBIRC6与PDAC患者的DNA损伤和奥沙利铂耐药相关
为了评估circBIRC6对奥沙利铂化疗反应的预测价值和临床意义,作者检测了82例接受奥沙利铂化疗的晚期PDAC患者中circBIRC6在血浆EV和原发肿瘤组织中的表达,并通过免疫染色评估γH2AX的DNA损伤水平。结果显示,耐药患者肿瘤组织中circBIRC6水平相对不耐药的组织升高,γH2AX水平降低(图8A-C);circBIRC6的表达与γH2AX的表达呈负相关(图8D);作者也检测了SUMO修饰的XRCC4水平,发现耐药患者肿瘤组织中XRCC4水平升高,化疗反应性变弱(图8E-G)。此外,与奥沙利铂反应灵敏患者相比,耐药性患者血浆EV-circBIRC6水平升高(图8H)。Kaplan-Meier分析显示,血浆EV-circBIRC6含量越高,PFS就越短(图8I)。不过有趣的是,在接受其他无奥沙利铂化疗方案的患者中,无论血浆ev-circBIRC6水平如何,PFS均无显著差异(图8J)。综上所述,circBIRC6可作为基于奥沙利铂的胰腺癌化疗耐药性的潜在治疗和生物标志物(图8K)。
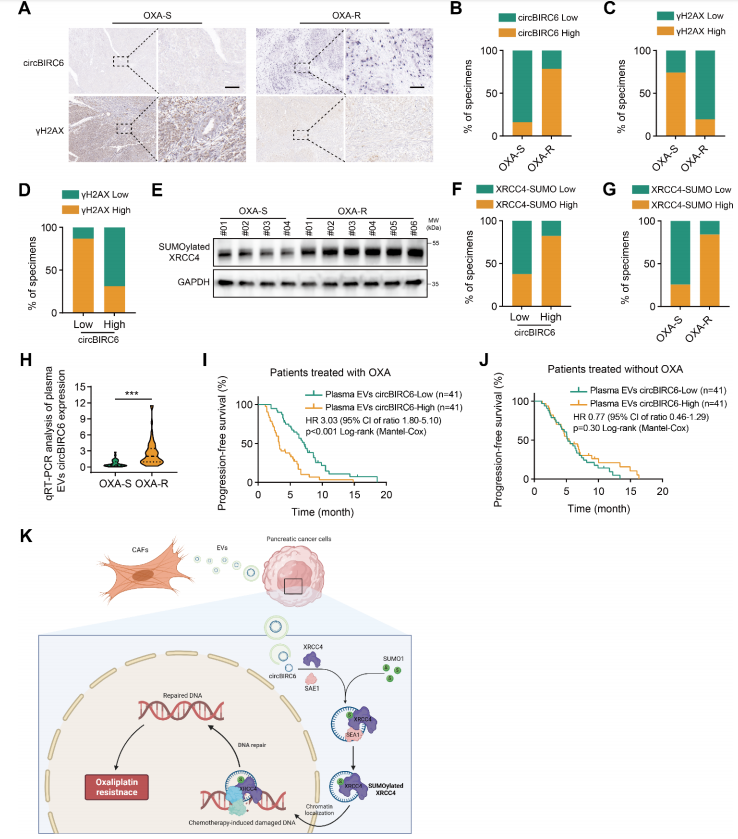 图8 circBIRC6与PDAC患者的DNA损伤和奥沙利铂耐药相关
图8 circBIRC6与PDAC患者的DNA损伤和奥沙利铂耐药相关
.png)

