环状RNA(circRNAs)是一种丰富且高度保守的非编码RNA。越来越多的研究表明环状RNA在癌症的致病机理中可能发挥生理作用,包括在癌症转移、预后等进程,但相关机制尚不明确。
2023年11月3日,中国药科大学邢莹莹副教授、郑禄枫副教授、唐昕莹副研究员研究团队在Molecular Cancer(IF=37.3)发表文章“Hsa_circ_0136666 stimulates gastric cancer progression and tumor immune escape by regulating the miR-375/PRKDC Axis and PD-L1 phosphorylation”。本研究结果揭示了hsa_circ_0136666在胃癌中发挥的致癌作用,通过miR-375/PRKDC信号轴驱动PD-L1磷酸化,促进免疫逃逸。这项工作提出了一种全新的胃癌致病机制,揭示了hsa_circ_0136666作为免疫靶点的新作用,并为增强抗PD-L1治疗胃癌的疗效提供了理论依据。
Hsa_circ_0136666与miR375有交叉点,而Hsa_circ_0136666与胃癌的生长呈正相关
作者在之前的研究中发现,miR-375可以抑制胃癌的进展,且miR-375的过表达导致包括环状RNA在内的长非编码RNA的异常变化。推测其可能受到上游分子的调控。为了鉴定潜在的为miR-375海绵的环状RNA,作者通过基因表达综合数据库(GEO)和ENCORI在线数据库筛选发现唯一一个与miR- 375结合位点的circPRKDC,即hsa_circ_0136666。
RNase R酶和放线菌素D以及oligo dT实验表明,相比PRKDC,hsa_circ_0136666具有更强的稳定性(图1d-f)。荧光探针检测结果显示hsa_circ_0136666能在不同阶段的胃癌组织中广泛表达(图1g)。与正常组织相比,hsa_circ_0136666在原位癌组织中的表达水平较高,其次是癌旁组织和转移组织(图1h),说明hsa_circ_0136666在胃癌的发生发展中的重要作用。综上所述,hsa_circ_0136666具有不易降解的环状结构,在胃癌组织中高表达,推测hsa_circ_0136666调控胃癌的发生发展。
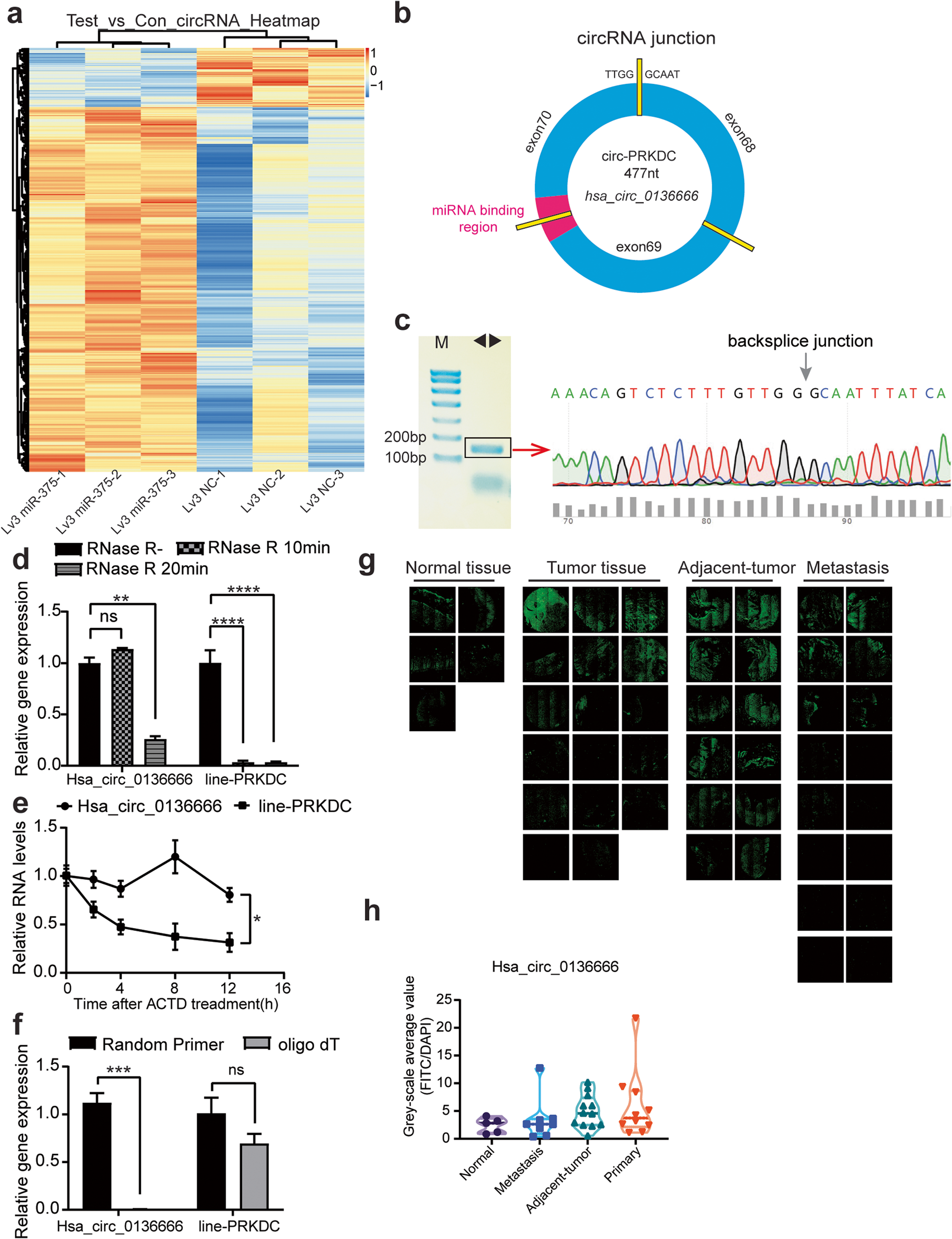 图1 Hsa_circ_0136666与miR-375有交叉点,后者与胃癌的生长呈正相关
图1 Hsa_circ_0136666与miR-375有交叉点,后者与胃癌的生长呈正相关Hsa_circ_0136666促进肿瘤增殖和肿瘤免疫逃逸
作者发现hsa_circ_0136666在不同的胃癌组织和肿瘤细胞系中广泛表达。且相比正常胃上皮细胞GES-1相比,肿瘤细胞系中hsa_circ_0136666的表达丰度更高(图2a)。因此,hsa_circ_0136666在胃癌中高表达。
Hsa_circ_0136666在肿瘤生长过程中的作用至关重要。CCK-8实验发现过表达hsa_ circ_0136666可促进癌细胞增殖(图2d-e),而使用siRNA敲低hsa_ circ_0136666可抑制细胞生长(图2f-g)。Circular RNA interactome显示,在hsa_circ_0136666前mRNA的上游和下游有EIF4A3的4个结合位点。EIF4A3的存在持续促进了胃癌细胞的生长速率(图2h)。相反,EIF4A3基因的下调则抑制了细胞的生长速率(图2i)。
结合之前的研究,作者探讨了hsa_circ_0136666如何通过免疫途径调节肿瘤生长。结果显示,过表达hsa_circ_0136666的癌细胞在与分离的、再活化的CD8+ T细胞共培养下,存活率增加,而hsa_circ_0136666的下调逆转了这一趋势(图2j-k)。推测hsa_ circ_0136666有助于肿瘤细胞对抗肿瘤免疫。
接着作者发现hsa_ circ_0136666与免疫检查点分子密切相关。Hsa_circ_0136666可以显著增加免疫检查点蛋白的表达量,特别是PD-L1,敲低Hsa_circ_0136666则降低了PD-L1的表达。综上所述,hsa_circ_0136666在体外可有效促进肿瘤细胞增殖的情况下,不被免疫细胞检测到,且hsa_circ_0136666的生物合成也受到EIF4A3的调控。
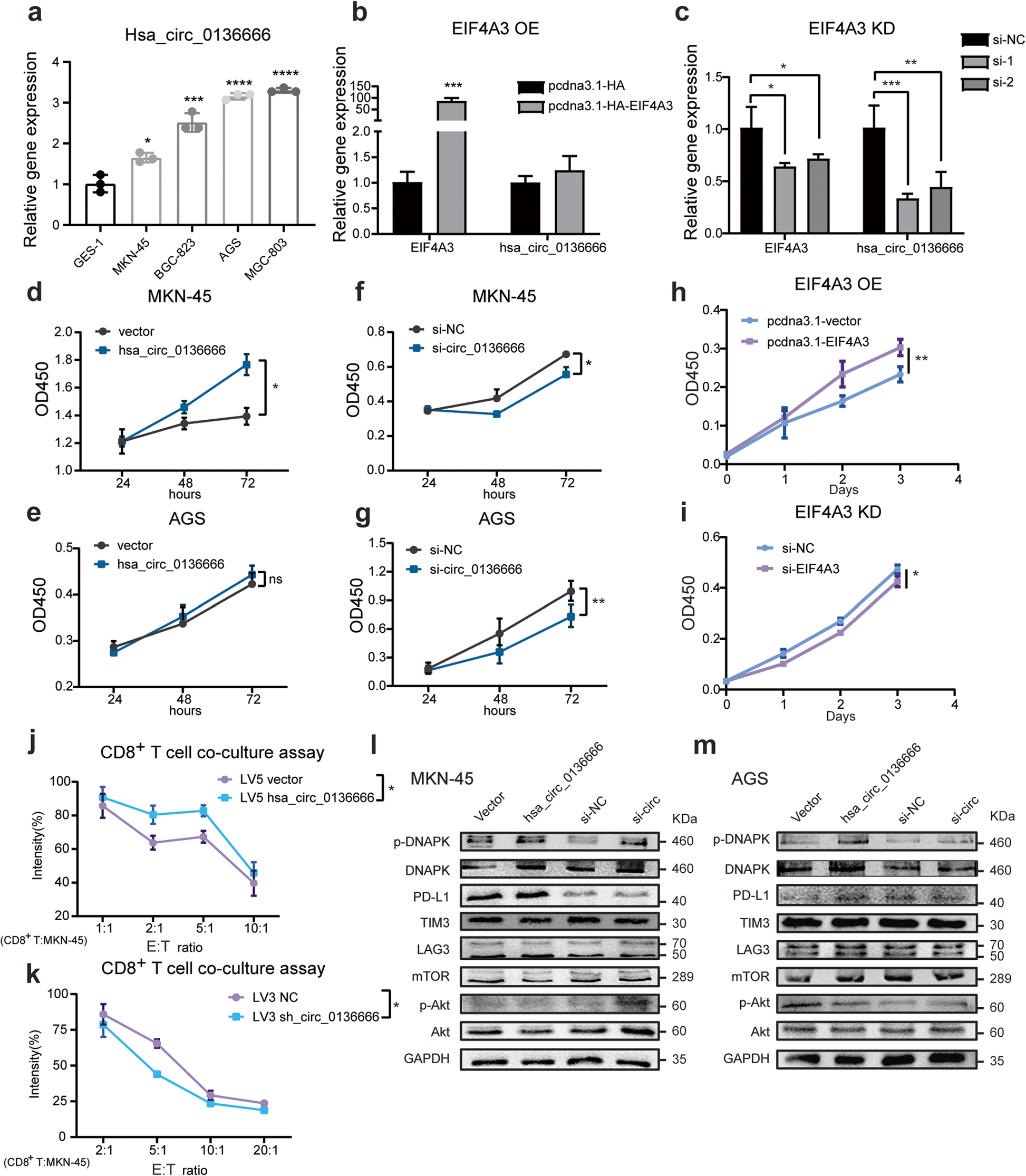 图2 Hsa_circ_0136666促进肿瘤增殖和肿瘤免疫逃逸
图2 Hsa_circ_0136666促进肿瘤增殖和肿瘤免疫逃逸Hsa_circ_03666调节向免疫逃逸驱动的抗肿瘤免疫反应
作者利用小鼠胃癌细胞构建同源肿瘤移植模型。结果表明,接种MFC-hsa_circ_0136666细胞的荷瘤C57BL/c小鼠具有更快的肿瘤生长速率和更大的肿瘤重量(图3a-c)。说明hsa_circ_0136666导致小鼠肿瘤生长进展过程中癌症恶化。
接着作者探讨了hsa_circ_0136666是否参与TME中的免疫细胞迁移,结果表明,hsa_circ_0136666过表达后,肿瘤膨胀的T细胞总数显著减少,在抗肿瘤免疫抵抗期,肿瘤相关的巨噬细胞向M2期极化(图3d-e)。结果表明,在hsa_circ_0136666存在的情况下,肿瘤生长向恶性肿瘤发展。
细胞因子在细胞免疫中也起着关键作用。研究发现,IFN-γ和IL-6在过表达hsa_circ_0136666的肿瘤组织中呈上升趋势,而TGF-β没有明显的变化。然而,这些促癌因子在表达下调的组织中表现出下调的趋势(补充图3c-e)。对致瘤区病理切片的免疫组化分析显示,局部恶化更严重,PD-L1表达更多(补充图3f)。综上所述,hsa_circ_0136666在体内促进了肿瘤的快速生长和免疫微环境的形成。
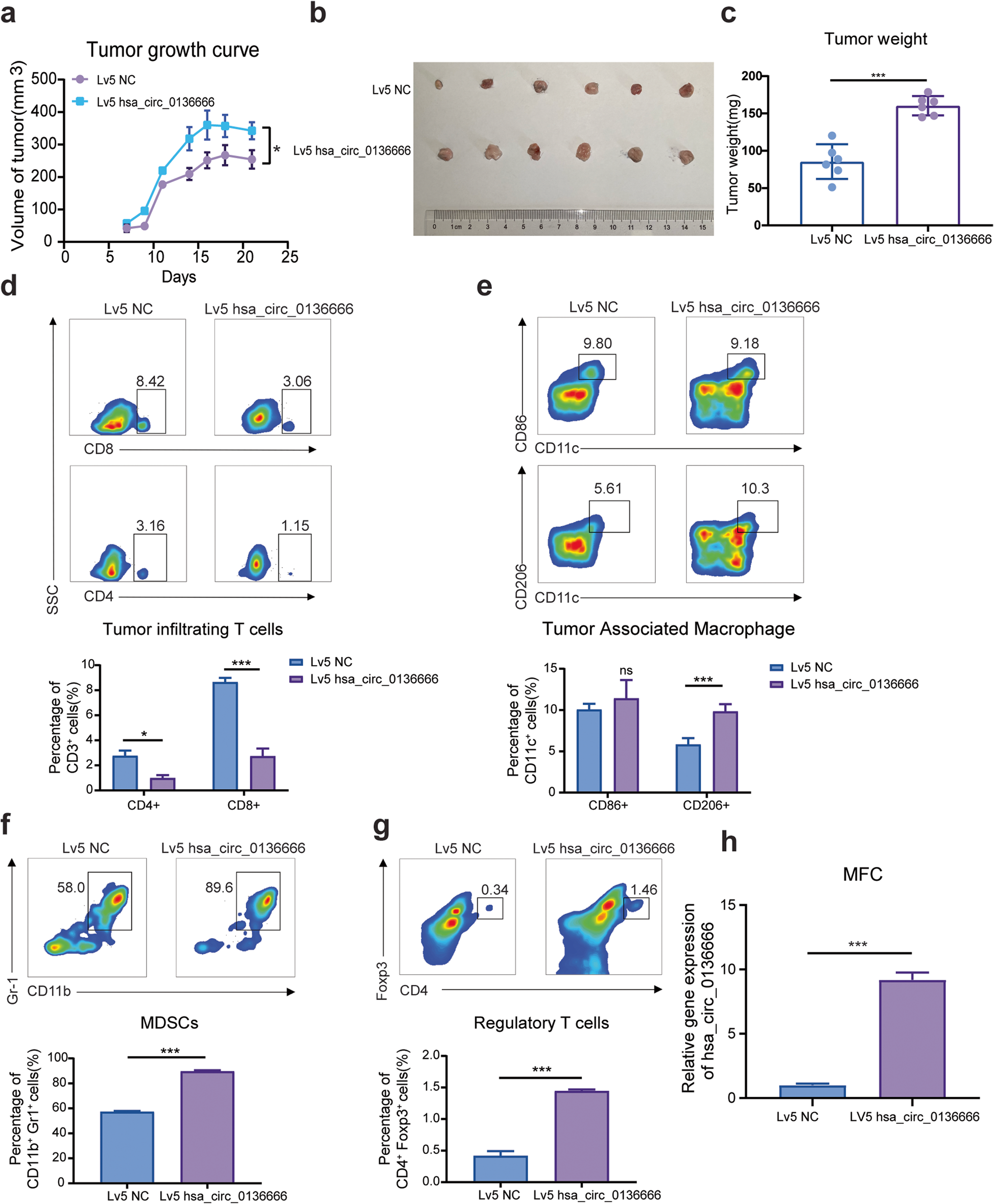 图3 Hsa_circ_03666调节向免疫逃逸驱动的抗肿瘤免疫反应
图3 Hsa_circ_03666调节向免疫逃逸驱动的抗肿瘤免疫反应Hsa_circ_0136666通过miR-375海绵调控胃癌进展
miR-375可以抑制幽门螺杆菌诱导的胃癌发生,幽门螺杆菌可以通过下调miR-375的表达来抑制胃内炎症因子的水平和免疫细胞的分化。研究发现,hsa_circ_0136666与miR-375的表达呈负相关(图4a)。作者利用starBase v2.0,预测了hsa_circ_0136666和miR-375的结合区域(图4b)。接着通过RIP实验证实两者的相互结合。Argonaute 2(AGO2)是RISC复合物的关键组成部分,使用抗AGO2抗体可拉下与野生型hsa_ circ_0136666结合的miR-375(图4c和补充图5e)。双荧光素酶报告基因检测也证实hsa_ circ_0136666可以与miR-375结合(图4d)。同时,RNA荧光原位杂交实验结果表明hsa_circ_0136666主要存在于细胞质中,与miR-375的分布几乎相同(图4e)。此外,miR-375还具有调节肿瘤免疫的功能。转染miR-375模拟物的癌细胞在与分离和再活化的CD8+ T细胞共培养时存活率降低,而转染miR-375抑制剂的癌细胞存活率有所提高(图4f)。
接着,作者验证了miR-375对C57BL/c荷瘤小鼠肿瘤生长的影响(图4g)。发现过表达miR-375也能降低肿瘤生长速率和肿瘤重量,miR-375抑制剂能显著促进肿瘤生长,增加肿瘤重量(图4h-i)。同时,miR-375过表达后,肿瘤区域的T细胞的扩增明显增加,CD4+ T细胞和CD8+ T细胞均呈增加趋势(图4j)。而miR-375抑制剂组的T细胞增殖现象被逆转(图4k)。综上所述,hsa_ circ_0136666海绵吸附miR-375从而抑制miR-375发挥生理作用。
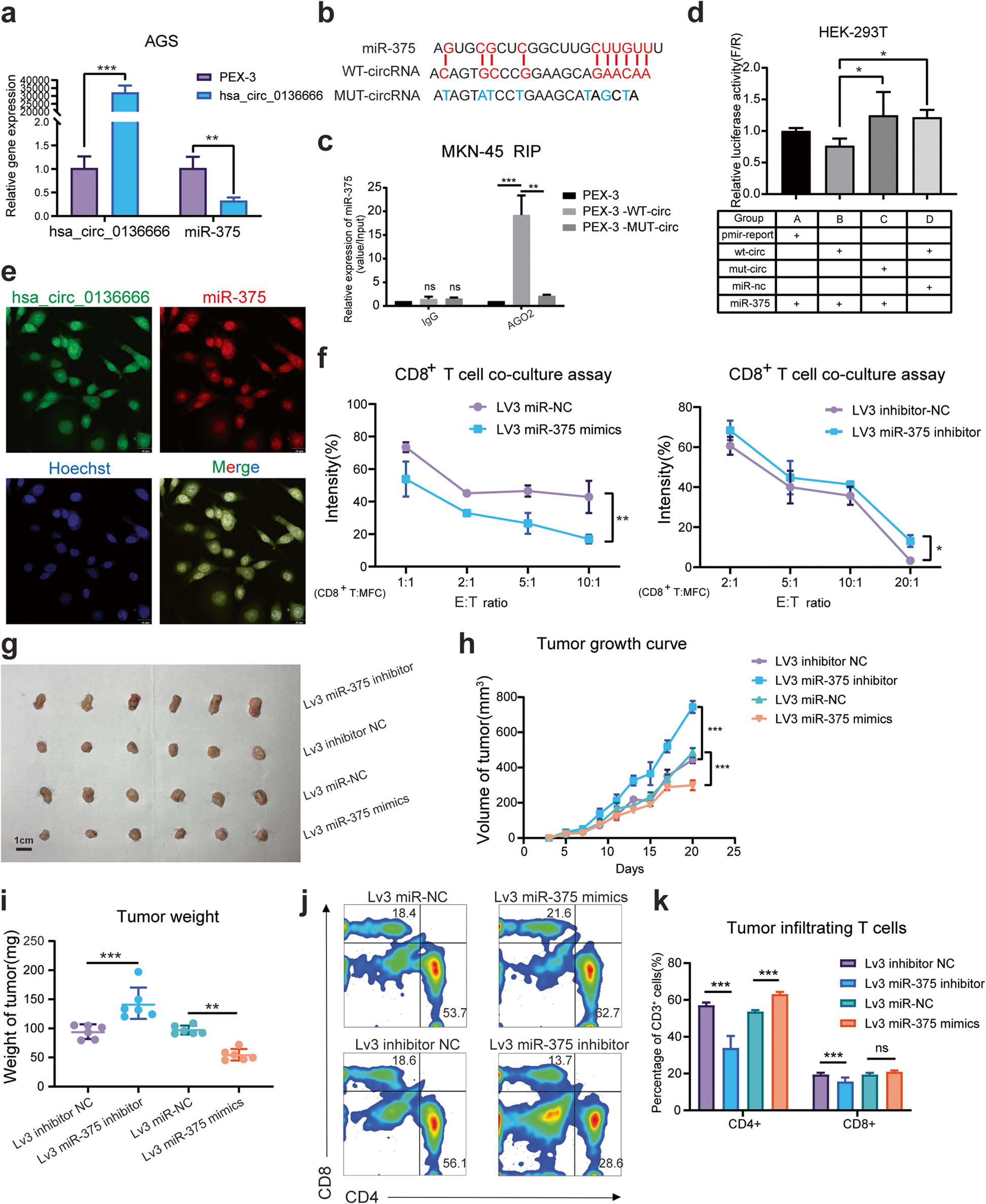
Hsa_circ_0136666通过miR375/PRKDC信号轴调节免疫应答
作者进一步验证了miR-375的功能,在过表达miR-375的基因芯片上,共检测到1777个上调基因和262个下调基因(图5a)。同时,通过数据库预测了miR-375和亲本基因PRKDC 3’UTR区域的配对序列(图5b)。QRT-PCR实验发现,过表达Hsa_circ_0136666上调PRKDC的表达,而下调Hsa_circ_0136666下调PRKDC的表达(补充5a-b)。同时,miR- 375与PRKDC mRNA水平之间存在显著的负相关关系(补充5c-d)。在RIP和双荧光素酶实验中证实了两者的结合(图5c-d和补充图5f)。
PRKDC mRNA主要分布在细胞质中,与miR-375的分布几乎相同(图5e)。miR-375可同时调控PRKDC编码蛋白DNA-PKcs的表达。它是DNA依赖蛋白激酶(DNA-PK)的催化亚基,在DNA双链断裂修复和重组中作为Ku70/Ku80异二聚体蛋白发挥作用。MKN-45和AGS细胞转染miR-375模拟物和miR-375抑制剂后,分别测定了总蛋白表达量。结果表明,miR-375抑制PRKDC的表达,导致DNA-PK下调(图5f和补充图5g-j)。
此外,高浓度的NU-7441(一种DNA-PK选择性抑制剂)表现出良好的肿瘤抑制作用(图5g-h)。与对照组相比,高浓度的NU-7441显著增加了T细胞的招募(图5i),从而激活免疫系统,快速杀死癌细胞(图5j)。
综上所述,hsa_circ_0136666作为一种miR-375海绵,可以防止miRNAs降解靶基因,从而使DNA-PK发挥促癌作用,导致免疫逃逸的发生。
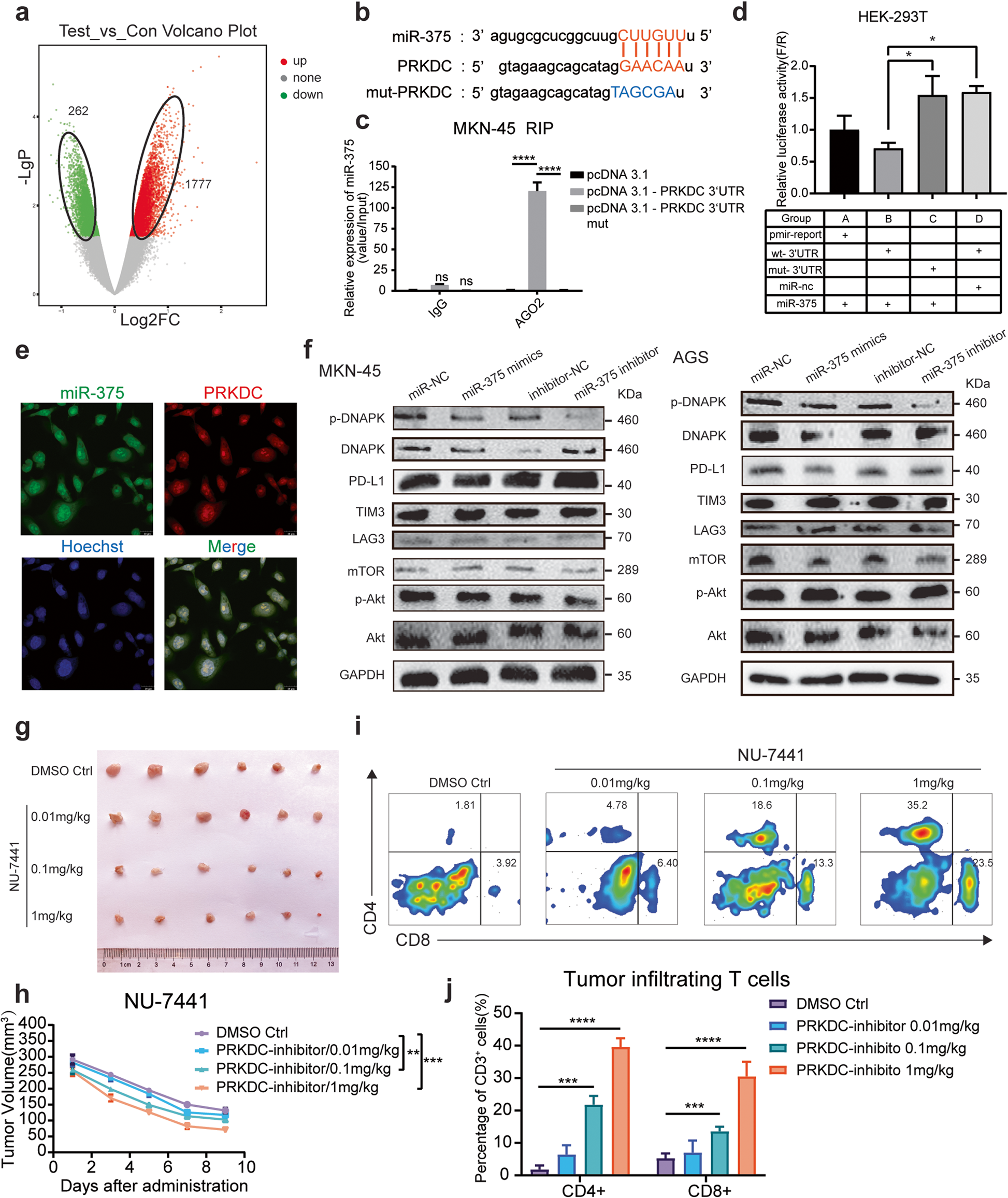 图5 Hsa_circ_0136666通过miR-375/PRKDC信号轴调节免疫应答
图5 Hsa_circ_0136666通过miR-375/PRKDC信号轴调节免疫应答蛋白激酶DNAPK驱动PDL1T20T22双位点磷酸化,介导蛋白稳定
PRKDC和免疫检查点PD-L1之间有很强的相关性。所以作者提出假设:蛋白激酶可能直接结合PD-L1并磷酸化,介导PD-L1蛋白稳定性上调,从而丰富并促进肿瘤免疫逃逸。为此,作者首先对肿瘤细胞进行了内源性验证。PD-L1蛋白可以用DNA-PK(mAb)拉下,反之亦然(图6a)。在转染了hsa_circ_0136666或miR- 375模拟物的HEK- 293 T细胞中,随着DNA-PK的上调,下拉蛋白显著增加(图6b-c)。免疫荧光也证实了DNA-PK与PD-L1在细胞质中共定位(图6d)。
由于DNA-PK属于PI3K激酶超家族,那么PRKDC是否可以直接磷酸化PD-L1。于是作者通过补回实验发现,hsa_circ_0136666的加入导致PD-L1磷酸化水平的上调,而miR- 375可以逆转这种上调(图6e)。NU-7441可以抑制DNA-PK激酶的活性,PD-L1的表达也被NU-7441抑制(图6f)。
在验证了DNA-PK直接与PD-L1结合的基础上,作者进一步验证DNA-PK驱动PD-L1的磷酸化。在HEK-293 T细胞中,DNA-PK抗体下拉后,质谱分析发现7个潜在的PD-L1磷酸化位点(补充图6a)。对这7个位点进行了突变,检测磷酸化蛋白表达水平。发现T20A和T22A两个位点磷酸化的蛋白水平显著下调(图6g)。相比之下,当仅保持一个位点未发生突变时,磷酸化蛋白的水平均有所上调(图6h)。此外,在MKN-45 hsa_circ_0136666过表达细胞中,PD-L1双磷酸化位点(T20A T22A)突变比单位点突变更能下调PD-L1的磷酸化(图6i-j)。在CHX处理后,PD-L1的稳定性不如野生型蛋白,且在6h内降解程度更强(图6k-l)。临床数据也表明胃腺癌组织样本中DNA-PK和PD-L1呈极高的正相关关系(图6m)。
综上所述,蛋白激酶DNA-PK与PD-L1的直接结合且共定位。DNA-PK在T20-T22双位点磷酸化PD-L1,使PD-L1不易降解,并提高PD-L1蛋白的稳定性,使PD-L1聚集,从而促进免疫失调。
 图6 蛋白激酶DNA-PK驱动PD-L1 T20T22双位点磷酸化来介导蛋白的稳定
图6 蛋白激酶DNA-PK驱动PD-L1 T20T22双位点磷酸化来介导蛋白的稳定Hsa_circ_0136666是一种新的药物靶点,可以有效改善抗PD-L1的药物靶点
为了验证hsa_circ_0136666是否可以作为一个有效的药物靶点,作者在C57BL/c小鼠中建立了一个皮下模型(图7a)。简单地说,MFC细胞过表达hsa_circ_0136666的荷瘤小鼠被随机分为4组,并在瘤内注射LNP-siRNA,si-circRNA的敲低效率可达到50%(图7b)。同时,腹腔注射抗小鼠PD-L1单抗(aPD-L1),实验结果表明,LNP-siRNA+aPD-L1组的肿瘤大小和重量在四组中最小,相比对照组抑制率约为50%-60%(图7c-f)。四组小鼠的体重没有明显变化,说明两种药物没有明显的毒性(图 7d)。
siRNA能够抑制肿瘤的生长,但与单抗治疗相比,这种抑制率并不显著。然而,LNP-siRNA有助于肿瘤微环境的治疗,主要通过抑制免疫细胞的比例。肿瘤免疫抑制细胞(MDSCs)经LNP-siRNA治疗后,肿瘤区域明显被抑制,而LNP-siRNA+aPD-L1组的MDSCs数量在四组中最小。同样,肿瘤浸润调节性T细胞在所有LNP-siRNA治疗组中数量都较少,而在未接受LNP-siRNA治疗的组中数量则较多(图7g)。
综上所述,LNPsiRNA可以有效地改善抗PD-L1药物的抗肿瘤效果,并显著阻碍免疫抑制细胞的募集。LNP-siRNA无明显的副作用,可作为进一步在体内应用的安全药物。
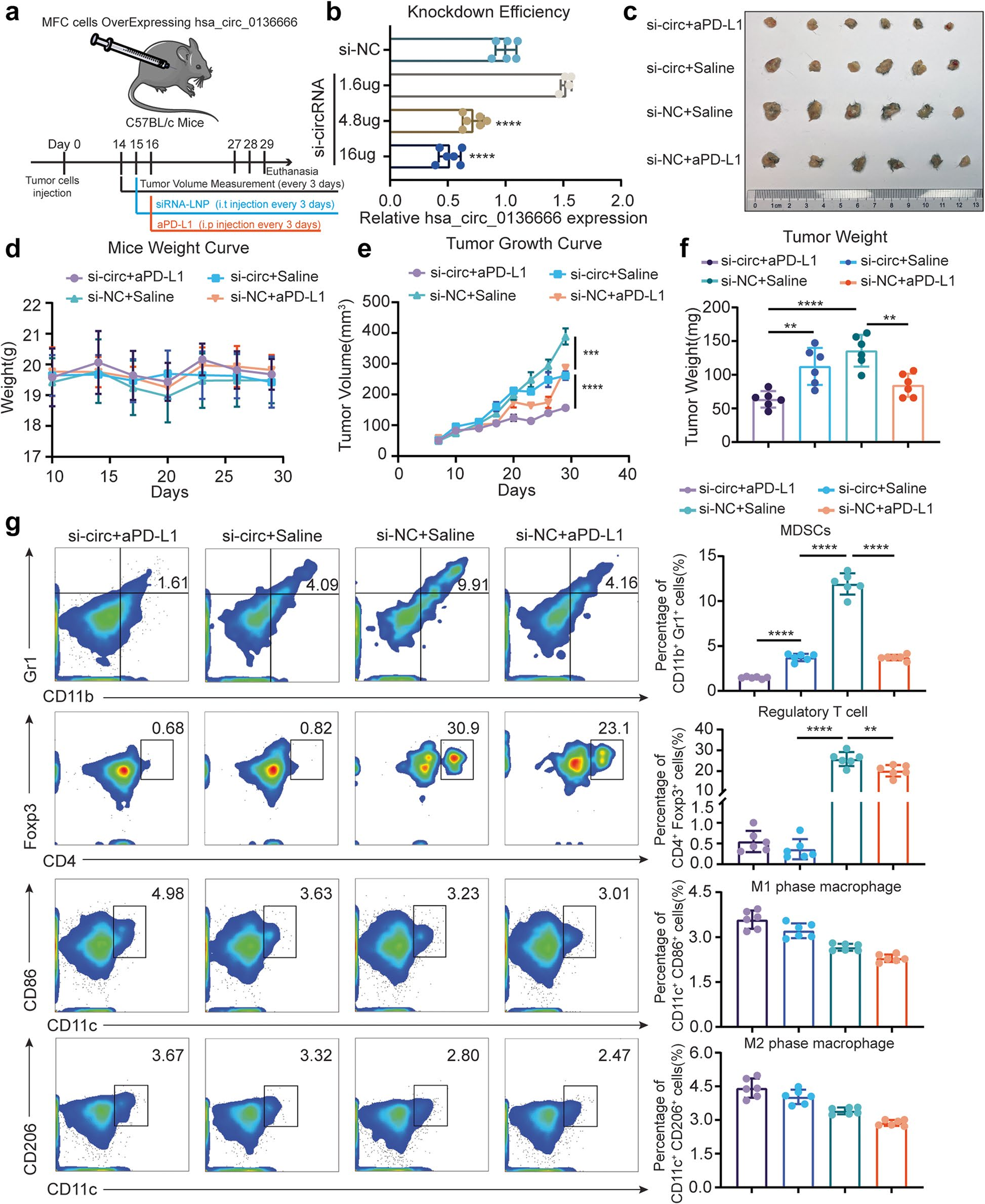 图7 Hsa_circ_0136666是一种新的药物靶点,siRNA可以有效地改善抗PD-L1药物的疗效
图7 Hsa_circ_0136666是一种新的药物靶点,siRNA可以有效地改善抗PD-L1药物的疗效总结
本研究表明在胃癌中高表达的环状RNA hsa_circ_0136666具有促进胃癌增殖和肿瘤免疫逃逸的功能,通过hsa_circ_0136666/miR-375/PRKDC信号轴调控蛋白激酶DNAPK对PD-L1的磷酸化,抑制PD-L1蛋白降解,导致PD-L1的异常积累,引发免疫逃逸。利用纳米脂质颗粒(LNPs)包裹靶向hsa_circ_0136666的siRNA,能够显著阻碍肿瘤免疫抑制细胞MDSCs与Treg细胞的招募,有效提高抗PD-L1治疗的效果。该研究为寻找胃癌治疗和预后新靶提供了理论基础,为开发胃癌治疗的小RNA药物提供新的思路。
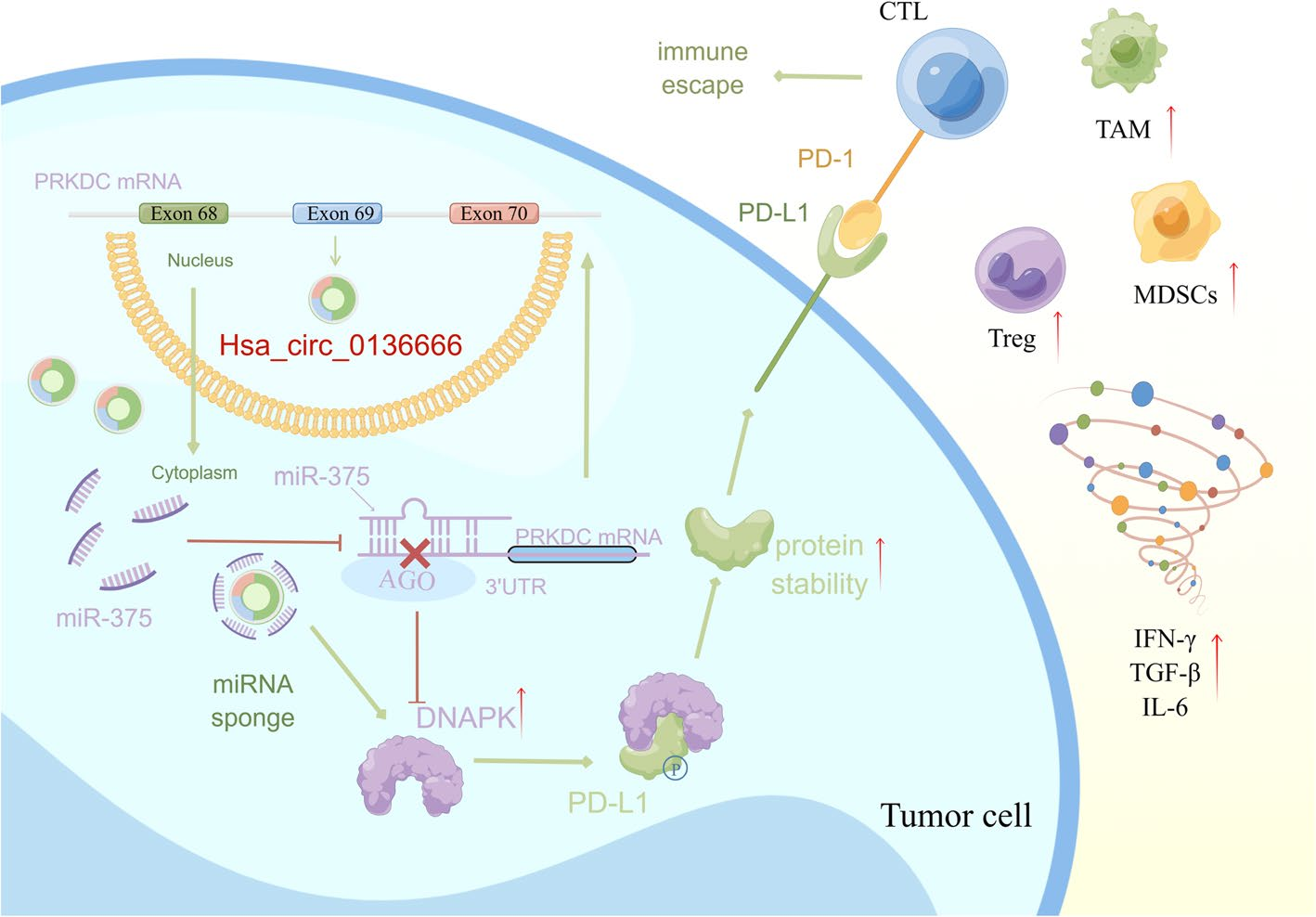 图8 hsa_circ_0136666促进胃癌进展的信号通路图
图8 hsa_circ_0136666促进胃癌进展的信号通路图原文链接:
https://doi.org/10.1186/s12943-023-01883-y
.png)
