有点让人目不暇接了,可见circRNA已由一颗生物医药研究届的新星升为炙热之星!
② 随着IVT circRNA长度的增加,线性前体RNA两端形成双链RNA(dsRNA)和二级结构的可能性也增加,显著降低了末端连接的效率。
③ 添加寡核苷酸辅助夹板可防止线性前体RNA末端二级结构的形成,但夹板片段的引入增加了目标产物纯化和回收的难度。
④ 线性前体RNA的环化是熵变不利的过程,而序列越长,熵变会越不利,反应效率会变得更低。
⑤ 当增加线性前体RNA浓度以提高反应效率,会增加分子间连接的副反应,严重影响目标产物的产量。
② 为减少副反应使反应物浓度下降,则会导致反应效率下降。
③ 针对夹板法环化而言,需要设计更短的夹板,但仍解决不了分子间连接产生多聚体的副反应问题。
② 表达其它分子量较大的蛋白,如融合蛋白,以及研究热点的双靶CAR实现基于circRNA的双靶CAR-T治疗。
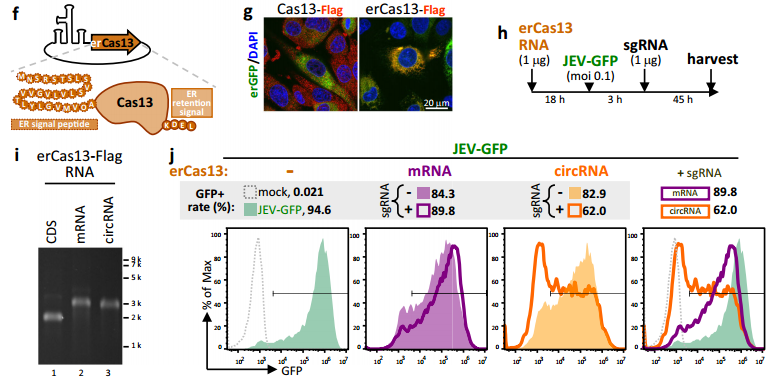
图1 f:环状RNA编码ER靶向Cas13的设计示意图。g:N18细胞共转染DNA编码erGFP的质粒和编码flag标记Cas13或erCas13的circRNA。h-j:用mRNA或circRNA形式的erCas13 RNA处理N18细胞,并感染JEV-GFP,然后按特定的时间和剂量加入sgRNA。i:RNA电泳显示使用的mRNA和circRNA。j:48 h (erCas13 RNA转染66 h)流式细胞术分析N18细胞。
02 超短序列
② 发挥短序列核酸适配体的功能;
③ 作为短序列天然RNA表达,研究其功能机制,或在体内发挥相应的功能;
④ 作为其它超短序列RNA发挥作用。
相关研究2 Wu等(2023)将核酸酶激活的CRISPR- Cas12a与环状CRISPR RNA用于生物传感。[8]
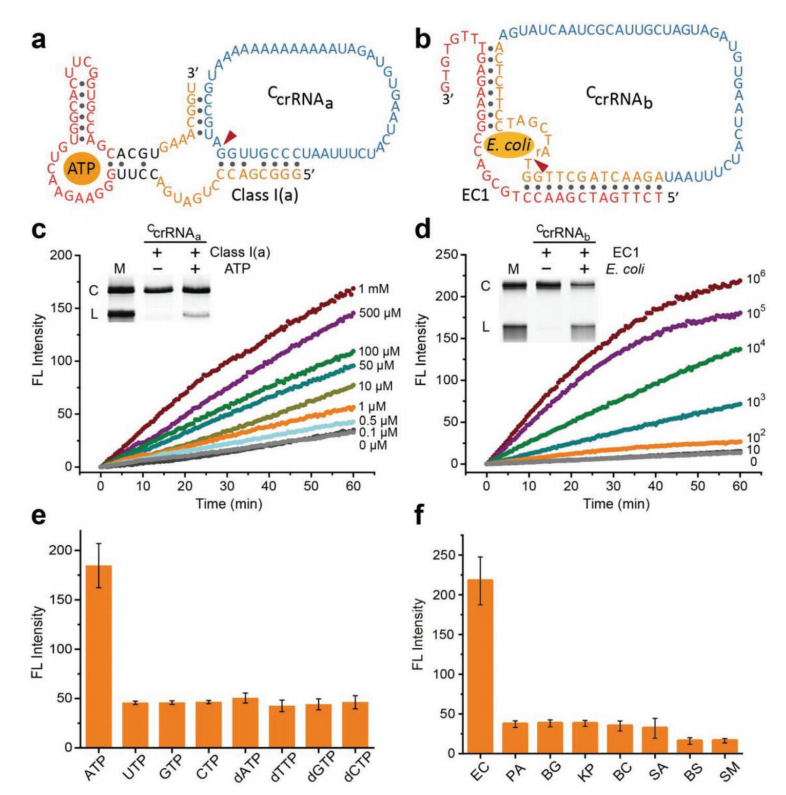
图2 NA3C用于ATP和大肠杆菌检测。
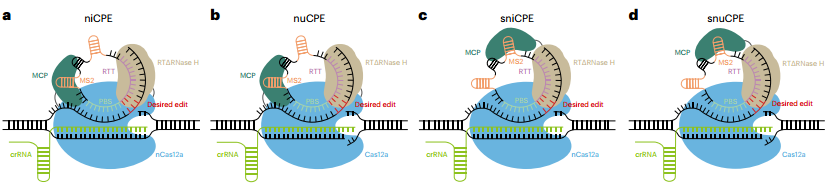
图3 不同形式CRISPR-Cas12a 编辑器示意图。
相关研究4 Guo等(2024)利用环状RNA适配体治疗银屑病小鼠模型。[7]
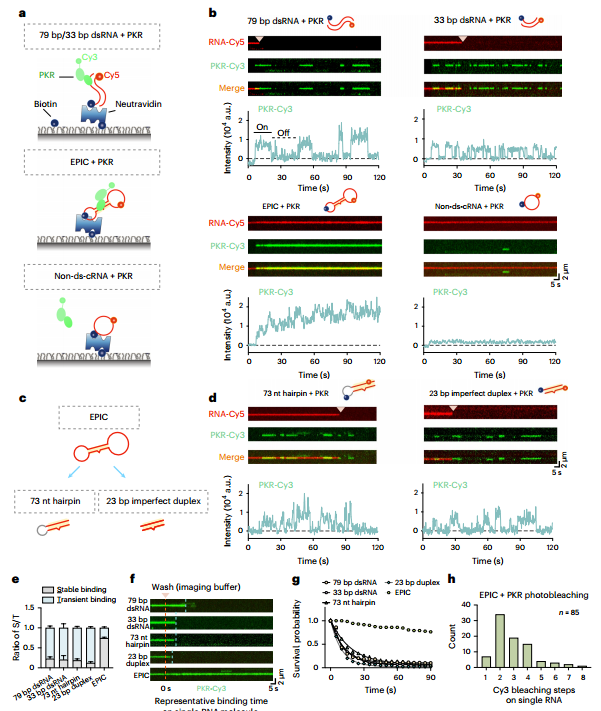
图4 EPIC(适配体)与PKR蛋白在动力学上的高亲和力。
那怎么办?
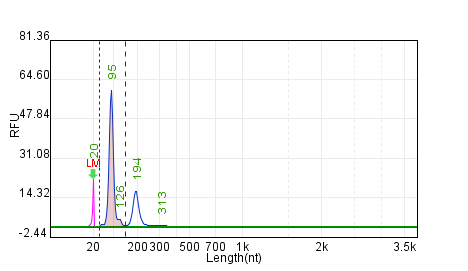
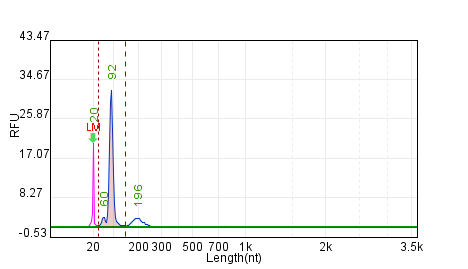
Qsep检测超短(上)、超长(下)纯化后circRNA完整性>90%
参考文献
[2] Liu J, et al. A single dose of VEGF-A circular RNA sustains in situ long-term expression of protein to accelerate diabetic wound healing. J Control Release. 2024, 373:319-335.
[3] Zhang X, et al. Scarless circular mRNA-based CAR-T cell therapy elicits superior anti-tumor efficacy. bioRxiv. 2024.
[4] Wang F, et al. Circular RNA-based neoantigen vaccine for hepatocellular carcinoma immunotherapy. MedComm (2020). 2024, 5(8):e667.
[5] Zhou J, et al. Circular RNA vaccines against monkeypox virus provide potent protection against vaccinia virus infection in mice. Mol Ther. 2024, 32(6):1779-1789.
[6] Su CI, et al. A cis-acting ligase ribozyme generates circular RNA in vitro for ectopic protein functioning. Nat Commun. 2024, 15(1):6607.
[7] Guo SK, et al. Therapeutic application of circular RNA aptamers in a mouse model of psoriasis. Nat Biotechnol. 2024. doi: 10.1038/s41587-024-02204-4.
[8] Wu Y, et al. Nucleic Acid Enzyme-Activated CRISPR-Cas12a With Circular CRISPR RNA for Biosensing. Small. 2023, 19(41):e2303007.
[9] Liang R, et al. Prime editing using CRISPR-Cas12a and circular RNAs in human cells. Nat Biotechnol. 2024 . doi: 10.1038/s41587-023-02095-x.
.png)
