膀胱尿路上皮癌(UCB)是一种世界上最常见的复发率高的恶性肿瘤。大约70%的患者被诊断为非肌层浸润性肿瘤(NMIBC),30%的患者被诊断为肌肉浸润性肿瘤(MIBC)。 50%的MIBC患者在肺,骨和肝器官发生转移,导致其预后不良。 目前还没有有效的治疗方法可用于发生肿瘤转移的UCB患者。 因此,更好地理解UCB肿瘤发生发展分子机制有助于开发治疗UCB的有效方法。已有大量研究报道, circRNA表达失调与多种肿瘤的发生发展相关。 然而,circRNA对于癌细胞上皮-间质转化(EMT)进展的功能和临床意义仍不清楚。

来自广州中山大学肿瘤防治中心的谢丹教授研究团队最近于CLINICAL CANCER RESEARCH(IF=10.199)发表题为“PRMT5 Circular RNA Promotes Metastasis of Urothelial Carcinoma of the Bladder through Sponging miR-30c to Induce Epithelial-Mesenchymal Transition”的研究论文。该研究发现了膀胱尿道上皮癌(UCB)患者的血浆中circPRMT5的表达水平与患者临床分期级别高和预后差成正相关。具体机制主要是circPRMT5可作为miR-30c的sponge,促进EMT进程相关的SNAIL1基因表达上调,E-cadherin基因表达下调,从而促进UCB的侵袭和迁移。而且患者的血浆和尿液外泌体中circPRMT5表达水平上调,并与肿瘤的转移相关,提示circPRMT5可作为UCB患者的预后生物标志物,也可作为治疗UCB患者的潜在靶点。
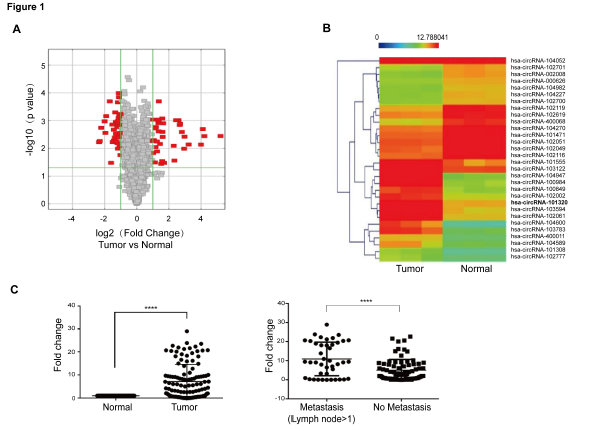
- 对UCB组织样本进行circRNA表达谱分析,并筛选和鉴定circRNAs
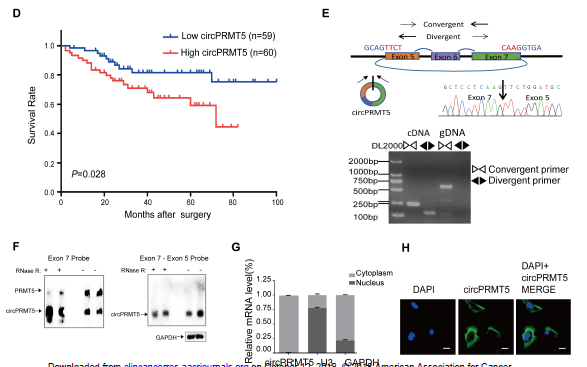
作者对三对UCB组织样本和其相应正常组织样本进行circRNA芯片分析,发现37种circRNAs表达上调,43种circRNAs表达下调(A);分层聚类分析了上调水平最大的前15种和下调水平最大的前15种circRNAs(B);其中circRNA_101320表达水平上调高达6倍以上,通过比对GRCh37/hg19基因组,发现其来源于染色体14q11.2中的PRMT5基因,故命名为circPRMT5。为明确其临床意义,RT-qPCR检测UCB组织样本,发现在UCBs样本中circPRMT5表达水平明显上调,而且相比于无发生转移样本,发生淋巴结转移的样本中circPRMT5表达水平也相对偏高(C);进一步临床统计分析显示上调的circPRMT5水平与患者的无疾病生存期DFS呈负相关(D)。Sanger测序RT-PCR产物证明了circPRMT5是由5’端7号和6号外显子与 3’端的5号外显子连接而成(E),同时利用靶向7号和5号外显子连接序列探针、7号外显子的探针进行杂交实验,证明了circPRMT5的存在,而且不同于线性PRMT5,RNase R处理说明circPRMT5是环状RNA,可以耐受RNase R(F)。mRNA成分分离和FISH实验都证明了circPRMT5主要存在于胞浆中(G,H)。
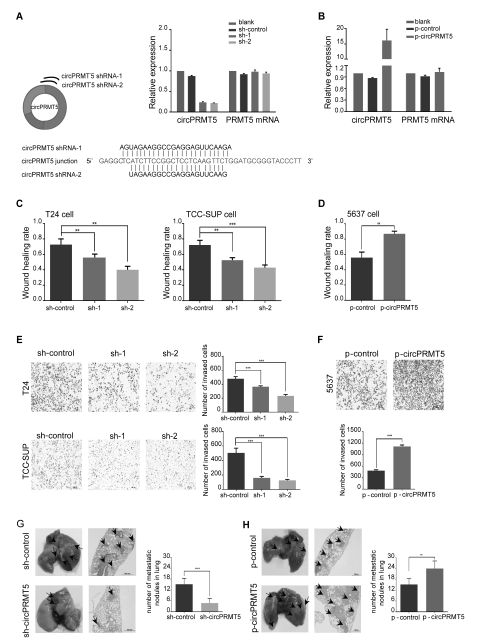
- circPRMT5表达上调促进UCB的迁移和侵袭
在UCB细胞(T24, TCC-SUP, 5637)中,circPRMT5过表达和敲低的效果很明显,而且都不会影响其对应基因的mRNA的表达(A,B) ;体外实验证明circPRMT5过表达可以明显促进UCB 5637细胞的迁移和侵袭;而circPRMT5敲低可以明显抑制UCB 5637细胞的迁移和侵袭(C-F);体内实验(尾静脉回输circPRMT5过表达和敲低的UCB细胞后,观察其发生肺转移的情况)证明,circPRMT5过表达的UCB细胞发生肺转移的情况更严重;而circPRMT5敲低的UCB细胞发生肺转移的情况明显减轻(G-H)。
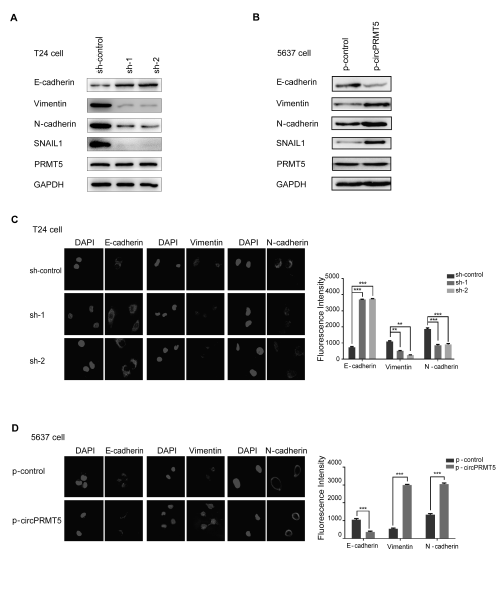
- CircPRMT5是否可以调控UCB细胞的EMT进程?
在UCB细胞中敲低circPRMT5后,WB检测发现上皮marker—E-cadherin表达水平明显增加,而间质marker—Vimentin 和N-cadherin表达水平明显下调(A);而在UCB细胞中过表达circPRMT5会下调E-cadherin的表达,上调Vimentin 和N-cadherin表达(B)。另外在T24细胞中敲低circPRMT5和5637细胞中过表达circPRMT5后,FISH免疫荧光杂交实验也证明了与WB同样的结果(C-D)。这些结果提示,circPRTM5可以促进UCB细胞的EMT进程,而且该过程不依赖于PRMT5 mRNA。
- circPRTM5是否可以结合miRNA?
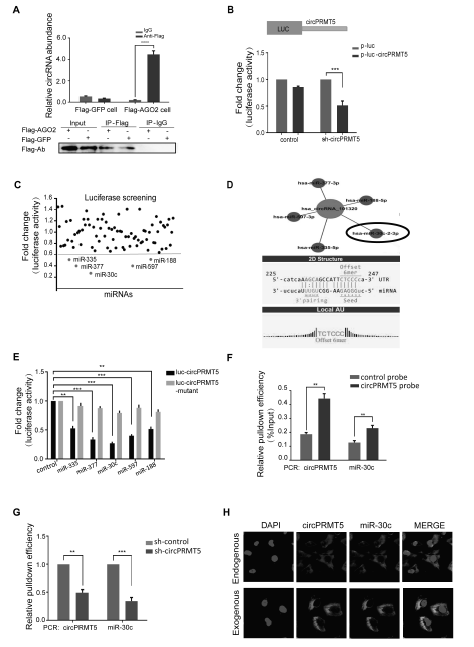
为明确circPRMT5是否存在AGO2复合物中,通过RIP实验pull-downAGO2复合物,再RT-qPCR检测circPRMT5的表达情况,发现内源性circPRMT5会富集在RNA诱导的沉默复合体(RISC complex)中(A)。为了明确circPRTM5是否可以结合某种miRNA发挥功能,通过荧光素酶报告基因实验,首先转染circPRMT5 shRNA后,其荧光素酶活性明显降低,证明了shRNA的有效性(B);接着利用miRNA模拟物库(83种miRNA)来筛选可以结合circPRMT5的miRNA,只有miR-30c, miR-335, miR-188, miR-377 和miR-597这五种,可以明显降低至少一半的荧光素酶活性(C)。通过TargetScan预测miRNA结合位点情况,均发现这五种miRNA至少都含有1-2个circPRMT5结合位点(D);而如果突变了荧光素酶报告质粒上的circPRTM5的3’UTR序列后再转染miRNA,发现荧光素酶活性并无明显降低(E),提示circPRMT5可能作为这五种miRNA的sponge,调控其下游基因的表达。
为进一步明确具体是哪种miRNA结合了circPRMT5,通过biotin标记的 circPRMT5 进行RIP实验, RT-qPCR检测复合物中的miRNA,发现了只有miR-30c有明显富集情况(F);如果敲低了circPRMT5表达后,RIP复合物中富集的miR-30c明显减少(G);RNA-FISH实验证明了内源性或者外源性circPRMT5与miR-30c的共定位(H)。
- circPRMT5结合miR-30c后会对UCB细胞有什么影响?
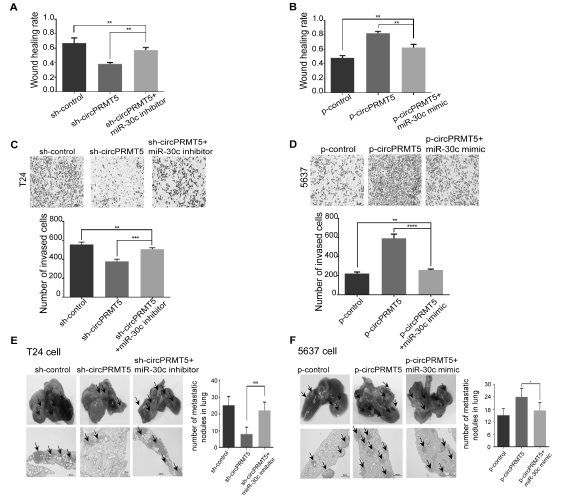
- 体外实验:circPRMT5敲低可以明显抑制UCB细胞的迁移和侵袭能力,而如果同时给予miR-30c抑制剂,可以抵消UCB细胞迁移和侵袭能力被抑制的效应(A,C); circPRMT5过表达可以明显促进UCB细胞的迁移和侵袭能力,而如果同时给予miR-30c模拟物,可以抵消促进UCB细胞迁移和侵袭能力的效应(B,D)。
②体内实验: circPRMT5敲低可以明显抑制UCB细胞发生肺转移,而如果同时给予miR-30c抑制剂,可以大部分抵消肺转移被抑制的效应(E); circPRMT5过表达可以明显促进UCB细胞发生肺转移,而如果同时给予miR-30c模拟物,可以抵消促进肺转移的效应(F)。
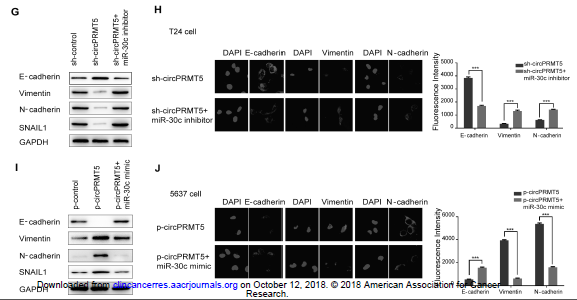
③作者假设circPRMT5结合miR-30c,促进miR-30c下游靶向基因的表达,通过miRanda数据库分析,miR-30c可直接结合EMT进程相关的转录因子SNAIL1的3’ UTR区域,转染miR-30c可以明显抑制UCB细胞的SNAIL1表达。另外在UCB细胞中敲低circPRMT5表达后,WB和FISH检测发现E-cadherin表达水平明显增加,而Vimentin 和N-cadherin表达水平明显下调,而同时给予miR-30c抑制剂,会出现相反的WB和FISH结果(G,H);过表达circPRMT5会下调E-cadherin的表达,上调Vimentin 和N-cadherin表达,如果给予miR-30c模拟物,会出现相反的WB和FISH结果(I,J)。
- circPRMT5/miR-30c/SANIL1/E-cadherin通路对于 UCB患者的临床意义
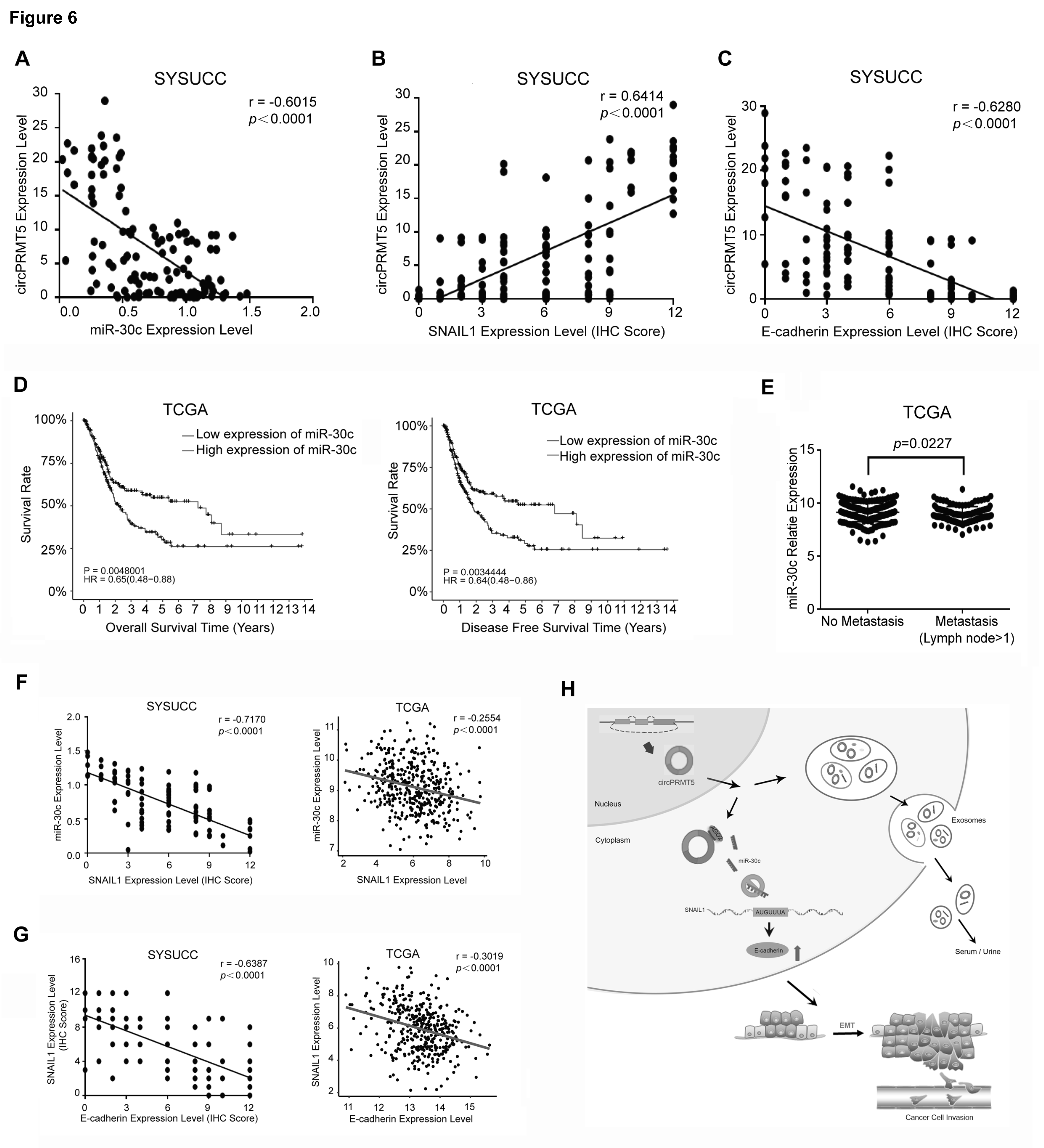
通过对收集的临床数据进行统计分析,circPRMT5与miR-30c表达水平成负相关(A);高表达的circPRMT5与SNAIL1表达水平成正相关,而与E-cadherin的表达水平成负相关(B,C)。为明确miR-30c通路对于UCB患者的临床意义,通过TCGA数据分析,发现miR-30c表达水平与患者的OS和DFS生存期成正相关(D),而且无发生转移的UCB患者的miR-30c表达水平明显上调(E),进一步提示了miR-30c对UCB发展的抑制作用;临床数据统计和TCGA数据分析显示,miR-30c表达水平与SNAIL1表达水平成负相关,而SNAIL1表达水平与E-cadherin的表达水平成负相关(F,G)。
- circPRMT5存在UCB患者血浆和尿液外泌体中,与促进肿瘤转移有密切关系
作者对临床患者血浆和尿液外泌体进行分离后,表型鉴定外泌体后,RT-qPCR分析发现circPRMT5也富集在这些来源的外泌体中,而且其高表达水平与肿瘤淋巴结转移和分期进展成正相关,而且这些外泌体中circPRMT5和miR-30c的表达水平也是成负相关,以上结果提示UCB细胞会分泌含有高水平circPRMT5的外泌体,进入循环血液或者尿液,促进肿瘤发展和转移,也提示circPRMT5可作为UCB患者的预后生物标志物,也可作为治疗UCB患者的潜在靶点。
参考文献
- Chen X, et al. PRMT5 Circular RNA Promotes Metastasis of Urothelial Carcinoma of the Bladder through Sponging miR-30c to Induce Epithelial-Mesenchymal Transition. Clin Cancer Res. 2018 Oct 10. doi: 10.1158/1078-0432.CCR-18-1270.
.png)
