赵齐 9月2日
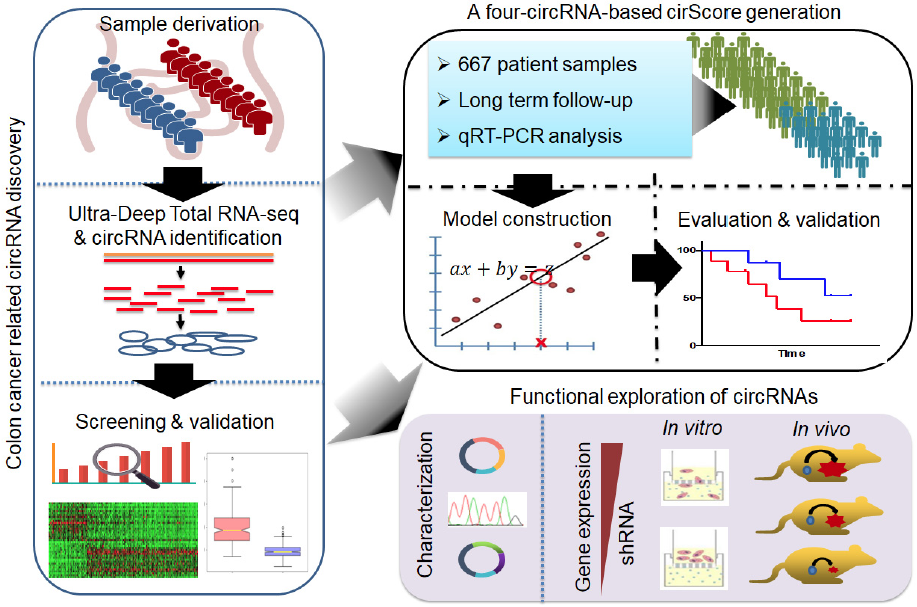 9月2日,EMBO Mol Med(IF=10.62)在线发表一篇circRNA的临床转化文章,来自中山大学附属肿瘤医院的研究团队采用高通量测序数据系统的鉴定和筛选了一批可用于中期结肠癌复发预测的circRNA,并在第三方数据中得到验证。中山大学附属肿瘤医院的徐瑞华教授为该文章通讯作者,鞠怀强副研究员,赵齐博士、王峰副主任医师、王梓贤博士及中山大学附属第六医院的兰平教授为文章共同第一作者。该研究在国家自然科学基金及广东省自然科学基金等项目资助下完成【1】。
9月2日,EMBO Mol Med(IF=10.62)在线发表一篇circRNA的临床转化文章,来自中山大学附属肿瘤医院的研究团队采用高通量测序数据系统的鉴定和筛选了一批可用于中期结肠癌复发预测的circRNA,并在第三方数据中得到验证。中山大学附属肿瘤医院的徐瑞华教授为该文章通讯作者,鞠怀强副研究员,赵齐博士、王峰副主任医师、王梓贤博士及中山大学附属第六医院的兰平教授为文章共同第一作者。该研究在国家自然科学基金及广东省自然科学基金等项目资助下完成【1】。
图一,研究基本框架。
背景
结直肠癌是威胁我国国民健康的一大近些年,随着人民生活水平提高,我国结直肠癌的发病率及死亡率逐年上升,呈现年轻化趋势且早期诊断率极低,80%以上的患者诊断为中晚期【2】。而中期结肠癌在治疗上,一般进行结肠癌根治手术,术后并辅以化疗。复发与转移是引起患者死亡率增加的主要原因,然而现有的临床病理因素并不能有效的预测复发风险及化疗获益【3】。因此,探究适用于中期肠癌预后预测分子指标,有助于推动肠癌患者的精准诊疗。
近些年研究发现,circRNA在各类生物过程甚至肿瘤等疾病发生发展过程中扮演着重要角色。如:它可以作为miRNA海绵的形式来对下游基因进行调控,也可以调控RNA剪接以及有一定编码多多肽的特性。然而,尽管如此,肠癌中circRNA相关研究较少,更没有使用circRNA对肠癌雨后预测的相关研究被发表。因此,本研究主要采用高通量检测手段筛选并尝试构建可作为肠癌预后预测分子标记物的circRNA,从而预测中期结肠癌的术后复发和患者生存情况。
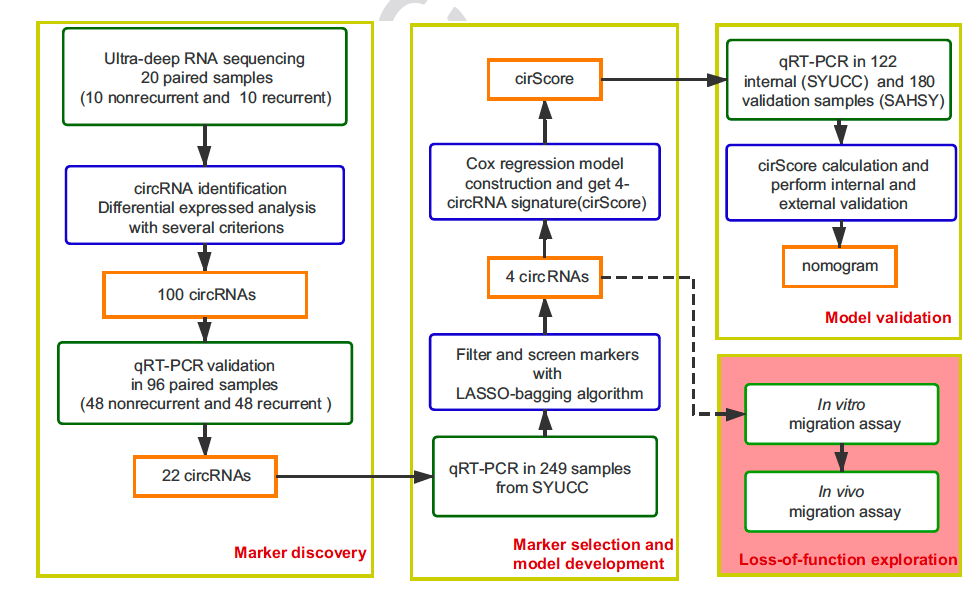
图二,筛选及研究的具体流程图。
中期结肠癌筛选复发相关circRNA
作者首先收集了20对结肠癌肿瘤和癌旁样本,其中10对复发组,10对非复发组,并对其进行转录组检测。利用生物信息学分析,鉴定了肿瘤组织相对于癌旁组织326个上调和11个下调的circRNA。同时,也鉴定出了复发组相对非复发组48个上调和55个下调的circRNA。然后,作者从中挑选了100个上调的circRNA进行下游qRT-PCR验证。验证的样本采用额外的48对样本进行。其中,有22个circRNA的差异表达得到了验证。紧接着,作者在249例中期肠癌的样本中进行这22个circRNA的检测,用以构建模型。由于对于22个circRNA作为模型构建的标志物来说,数目仍显得有点多,于是作者采用机器学习LASSO-bagging的方法对circRNA进行进一步筛选。值得一提的是,该方法也在2017年该团队的Nature Material论文中也用到【4】。最终,筛选出了4个circRNA用于模型构建。多因素COX回归表明,这四个circRNA相互独立且均具有预测复发的能力。作者同时也做了Sanger测序验证了这些circRNA的序列并且证明了这4个circRNA的真实存在性。这四个circRNA分别是hsa_circ_0122319,hsa_circ_0087391,hsa_circ_0079480和hsa_circ_0008039。
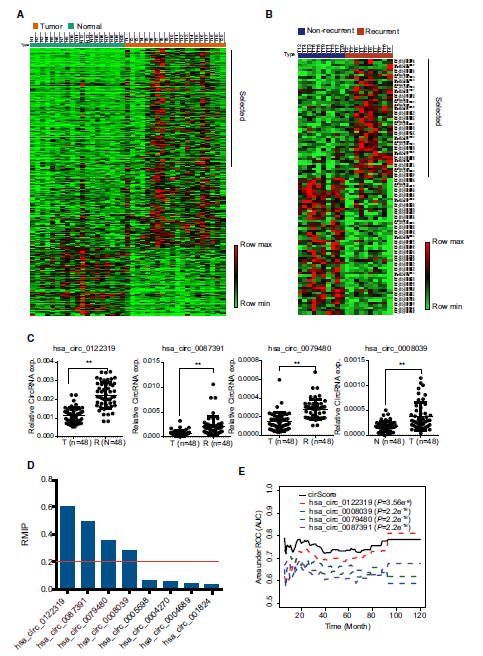
图三,筛选结肠癌复发相关circRNA
预后预测模型构建
紧接着,作者将筛选的circRNA进行线性组合,利用训练数据集构建了基于circRNA预测中期结肠癌复发的分子标签cirScore。性能评估表明,该标签可以有效将结肠癌患者区分高危复发组合低危复发组。此外,作者还收集了本院122例和来自中山大学附属第六医院的180结肠癌病人样本作为内部验证集和外部验证数据集对标签性能进行验证。结果显示,该标签均可以在额外的数据集中得到验证。通过比较,作者发现高cirScore的患者复发风险是低cirScore的2倍以上。且高cirScore的患者总生存期也显著长于低cirScore患者。
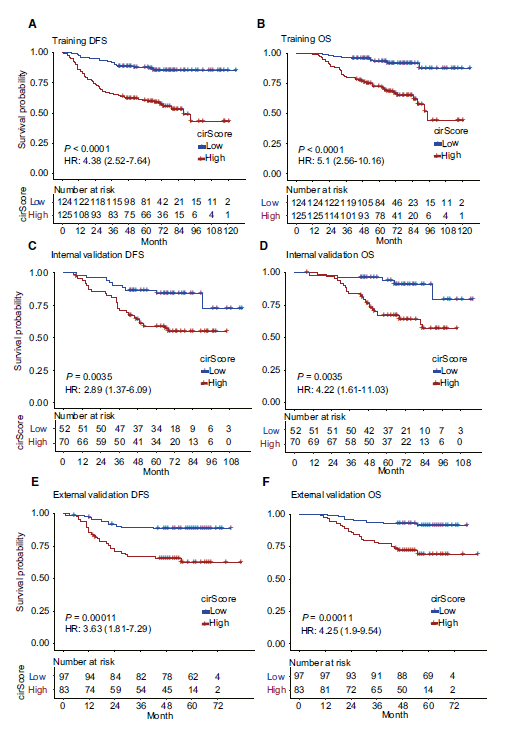
图四,circRNA标签在不同数据集中的预测性能。
候选circRNA的功能探索
看了这四个circRNA的预后预测效果,作者们抛出了疑问,他们的功能是什么呢?作者随即采用慢病毒在SW620和HCT116两个细胞系稳定敲降了hsa_circ_0122319, hsa_circ_0079480和hsa_circ_0087391三个环状RNA。并且用qRT-PCR、免疫印迹和转录组测序方法对敲降的效率进行验证,排除脱靶效率。作者发现,分别敲降这些circRNA后,细胞系迁移能力得到了显著抑制。进一步地,作者做了体内实验:小鼠成瘤实验发现(小鼠脾脏注射肿瘤细胞),敲降hsa_circ_0079480可以显著降低肿瘤的肝转移病灶。此外,通过向裸鼠尾静脉注射肠癌细胞观察到严重的肺转移,而注射敲降hsa_circ_0079480的肠癌细胞则抑制了这种现象的发生。综上,细胞和动物实验表明,这些circRNA在肠癌的进展中扮演着重要的角色,同时也验证了筛选的可靠性。
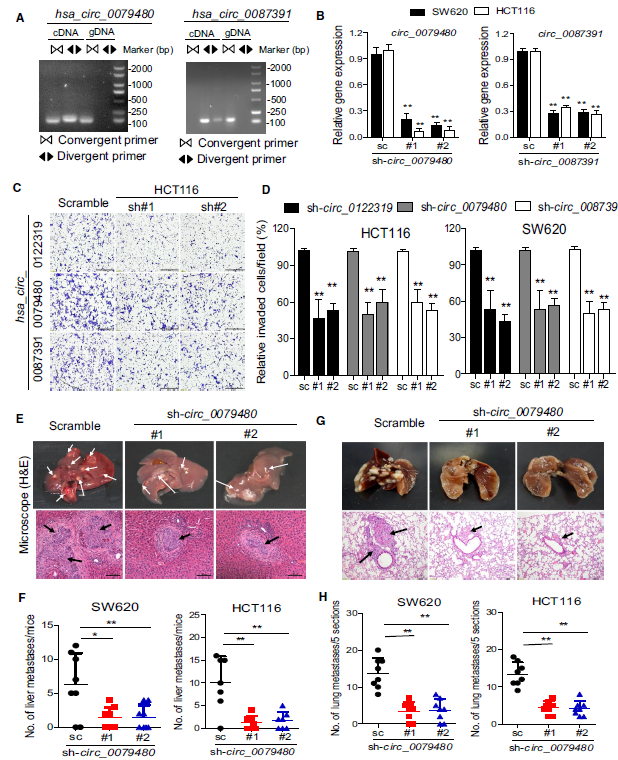
图五,circRNA功能试验。
新的cirScore可以作为独立的预后因素
目前,临床上可以用于预测复发风险的临床因素有分化程度、神经浸润、淋巴结或血管浸润以及是否T4分期等。为了与已有风险因素进行比较,作者基于临床风险因素将所有患者进行分层,分为二期高危/低危以及三期高危/低危四个组,分别比较组内cirScore的预测能力。结果显示,分层分析下cirScore也可以将组内高复发风险和低复发风险的患者作出进一步的划分。此外对于病患中总生存的预测亦是如此。为了进一步的分析,作者还将这些信息作为协变量进行怼因素Cox回归分析,证明了cirScore是可以作为独立的预测因素。为此,作者cirScore加入到现有的临床因素当中,旨在希望能对病人做更准确的划分。构建了可以用于直观预测的nomogram,并且在验证数据集中得到验证。结果表明,整合了cirScore的多变量回归Cox模型可以大幅度提高现有预测中期肠癌复发和生存的准确性。
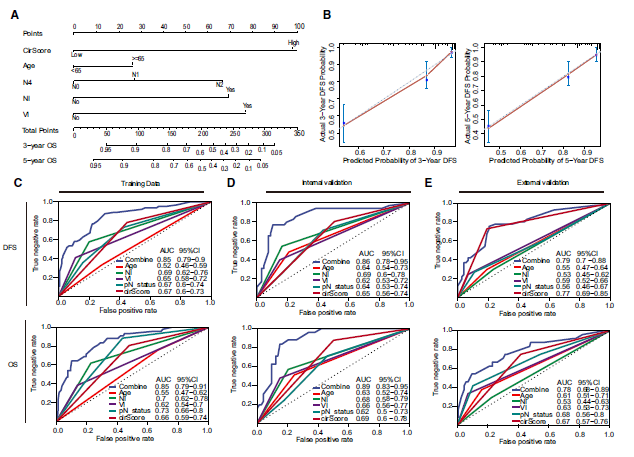
图六,cirScore与现有临床风险因素的比较和结合。
综上,该研究首次发现了一组由环状RNA组成的分子标签用于中期肠癌的复发和预后预测,揭示circRNA在肠癌进展中扮演的重要角色。同时创新了基于机器学习的肠癌分子标记物筛选策略,为肠癌的精准诊疗提供了新的思路和新的方法。
URL: https://www.embopress.org/doi/10.15252/emmm.201810168
通讯作者简介:徐瑞华,华南肿瘤学国家重点实验室主任,中山大学附属肿瘤医院院长。。中国抗癌协会副理事长,中国临床肿瘤学会副理事长,《Cancer Communications》主编,南粤百杰。长期从事消化道肿瘤个体化治疗领域及抗癌药物研究,在消化道肿瘤的在消化系统肿瘤治疗、早诊筛查、转移耐药方面取得了创新性成果。发表通讯作者 SCI 论文150余篇,代表性论文发表于Nat Mater、Lancet Oncol、JCO、JAMA onco、Gut、Hepatology、Cell Res、Nat Commun、JNCI等权威杂志。主持了国家重点研发计划、863计划、国家自然科学基金重点项目等多项基金。以第一完成人获得国家科技进步二等奖两项(2016年、2019年),中华医学会科技奖等省部级一等奖六项。
参考文献
- Hua-qiang Ju, Qi Zhao, et al. “A circRNA signature predicts postoperative recurrence in stage II/III colon cancer”. EMBI Molecular Medicine, DOI: 10.15252/emmm.201810168
- O’Connell, Michael J., et al. “Survival following recurrence in stage II and III colon cancer: findings from the ACCENT data set.” Journal of Clinical Oncology 26.14 (2008): 2336-2341.
- Quasar Collaborative Group. “Adjuvant chemotherapy versus observation in patients with colorectal cancer: a randomised study.” The Lancet 370.9604 (2007): 2020-2029.
- Xu, Rui-hua, et al. “Circulating tumour DNA methylation markers for diagnosis and prognosis of hepatocellular carcinoma.” Nature materials 16.11 (2017): 1155.
.png)
