
来自南京东南大学医学院药学系的姚红红教授最近在Autophagy上在线发表了题为“Novel insight into circular RNA HECTD1 in astrocyte activation via autophagy by targeting MIR142-TIPARP: Implications for cerebral ischemic stroke”研究,通过对短暂性大脑中动脉栓塞(tMCAO)造成大脑组织缺血的模型进行circRNA芯片分析,发现了circHectd1在小鼠中风模型和临床急性缺血性中风病人血浆样本中水平明显升高,而敲低circHectd1表达可以明显减少梗死面积、神经元缺失和减轻星型胶质细胞活化。进一步机制研究证明,circHectd1作为MIR142的sponge,抑制MIR142的活性,导致MIR142与TIPARP的3’ UTR区域结合降低,促进TIPARP的转录和表达,进而活化自噬和激活星型胶质细胞。该研究为治疗中风疾病提供了新的靶点和检测的生物标志物——circHECTD1。
CircRNAs是一种非编码RNA家族的一员,可由反向剪接外显子的方式产生,具有稳定的结构、很高的组织特异性表达和广泛分布胞浆、胞核与不同组织器官的特点。因为circRNAs缺乏可用的末端而抵抗RNase R的消化,所以其比线性mRNA更加稳定。大多数的circRNAs来自外显子的剪接,但是还有一部分同时包含内含子和外显子的circRNAs主要存在于细胞核中,促进相关基因的转录。已有研究报道,发现好几种ncRNAs参与生理和病理过程的调控,如细胞生长和发育、衰老、肥大和心衰等。
脑中风是一组以脑部缺血及出血性损伤症状为主要临床表现的疾病,又称脑卒中或脑血管意外,具有极高的病死率和致残率,主要分为出血性脑中风(脑出血或蛛网膜下腔出血)和缺血性脑中风(脑梗塞、脑血栓形成)两大类,以脑梗塞最为常见。脑中风发病急,病死率高,是世界上最重要的致死性疾病之一。中风的死亡率也有随年龄增长而上升的趋势,目前FDA批准的治疗急性缺血性中风的治疗就是静脉应用重组组织型纤溶酶原激活剂(rt-PA),但是时间窗口短和副作用限制其治疗有效性,所以需要保护缺血神经元以免遭受不可逆损害,同时也要保护多种细胞类型,如避免星型胶质细胞的活化。星型胶质细胞是中枢神经系统中数量最多的细胞,通过接触、交流和影响大脑实质细胞,在维持大脑正常功能中发挥着必不可少的功能。
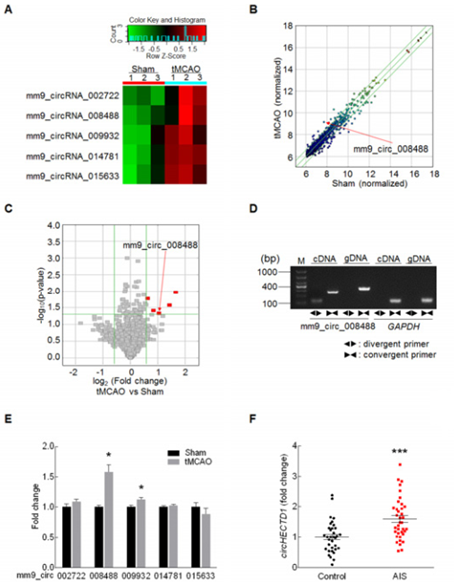
作者建立的tMCAO疾病模型中,脑皮质血流都是减少了基线水平的75%以上。circRNA芯片分析,热图揭示tMCAO疾病组中有5种circRNAs上调1.5倍以上(A);散点图(B)和火山图(C)的分析结果也展示了。接着通过体外设计引物RT-PCR验证,发现只有circRNA_008488(circHECTD1)的上调水平与芯片分析结果一致(D, E)。同时对临床急性缺血性中风病人(AIS)的血浆样本分析,也发现了circHECTD1的水平上调(F)。以上结果证明了,在局部缺血组织circHECTD1的表达水平上调。
2. 体内敲低circHectd1对tMCAO小鼠模型的影响?
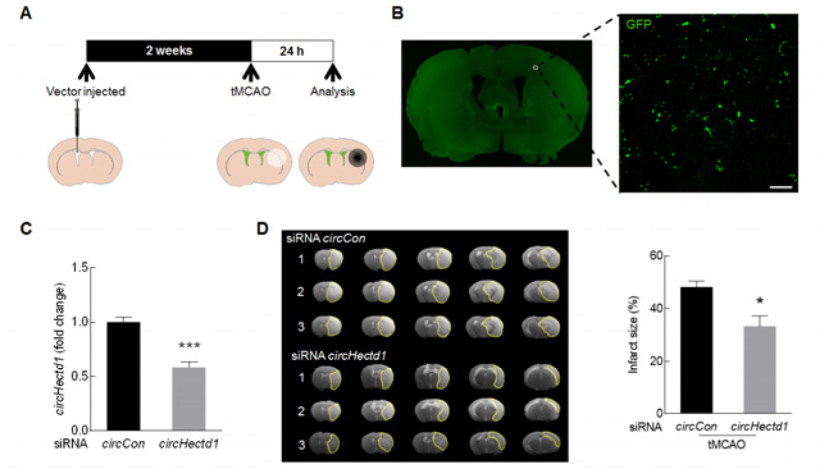
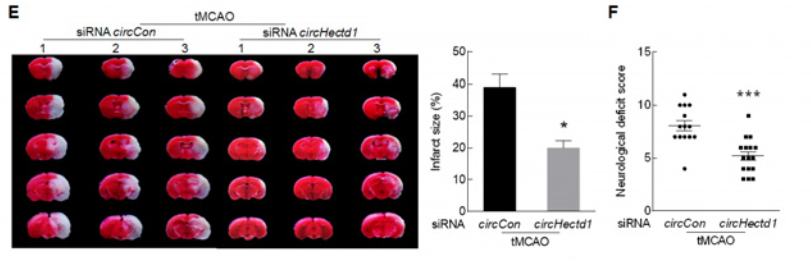
小鼠侧脑室显微注射circHectd1 siRNA慢病毒敲除circHectd1的操作流程(A),confocal验证(B)慢病毒载体的表达和RT-PCR(C)验证circHectd1的表达降低效果。MRI成像和TTC染色证明circHectd1 siRNA体内注射可以明显降低小鼠缺血后脑梗死面积,减轻脑神经元缺陷的后果(D-F),提示tMCAO小鼠体内敲低circHectd1表达可以减轻脑梗死。
3. 星型胶质细胞活化在中风中发挥重要作用,circHECTD1能否影响星型胶质细胞活化?
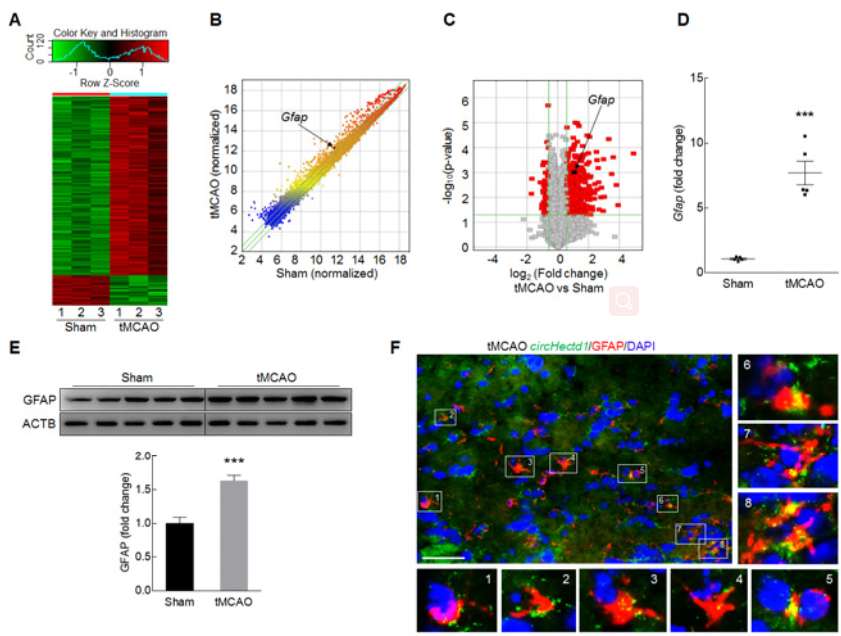
作者也对tMCAO小鼠进行了mRNA芯片分析,发现了602种Mrna的表达水平发生明显改变(A-C);其中星型胶质细胞活化的标志物GFAP水平也是明显的上调(D-E);confocal成像证明,tMCAO小鼠中,标志物GFAP蛋白和circHECTD1出现了共定位情况(F-G);circHectd1-siRNA慢病毒可以明显减少tMCAO小鼠脑组织中GFAP阳性细胞的数量,降低GFAP蛋白的表达(H-K)。以上实验证明了,体内敲低circHECTD1的表达可以抑制星型胶质细胞的活化。
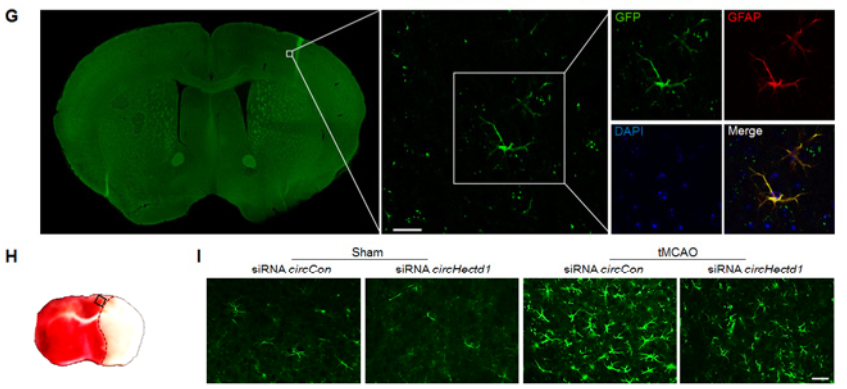
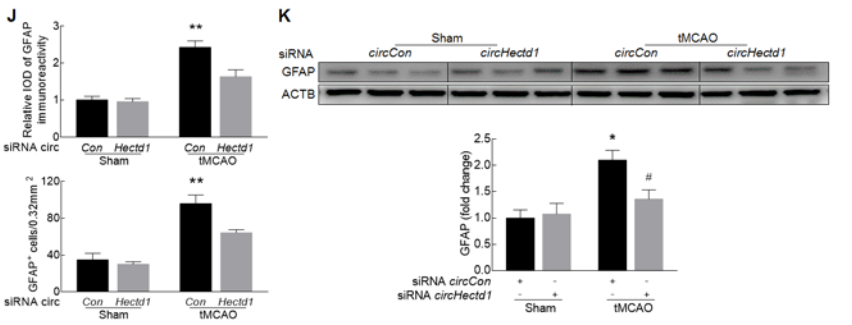
4. 体外敲低circHECTD1的表达能否影响星型胶质细胞的活化?
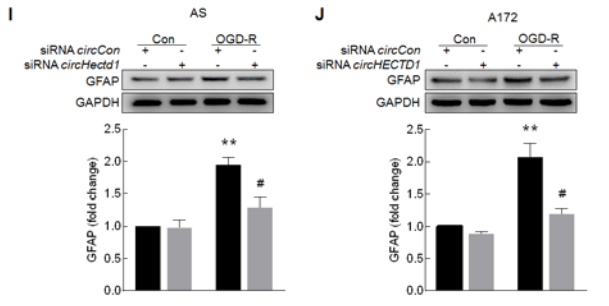
体外对小鼠星型胶质细胞AS和人胶质瘤细胞A172给予氧葡萄糖剥夺和再灌注(OGD-R)处理可以模拟体内缺血损伤后活化的模型。体外给予细胞OGD-R处理,胶质细胞活化标志物GFAP蛋白水平随时间明显升高(A-B),同时circHECTD1的表达水平升高,而HECTD1(mRNA)表达水平降低(C-D);circHECTD1 siRNA具有特异性,可以明显下调circHECTD1的表达水平,而不影响HECTD1(mRNA)表达水平(E-F),而RNase R处理只会降解线性HECTD1 mRNA,而不影响circHECTD1表达水平(G-H)。circHECTD1 siRNA会明显抑制OGD-R诱导的胶质细胞的GFAP蛋白的升高,即体外敲低circHECTD1的表达会抑制星型胶质细胞的活化。
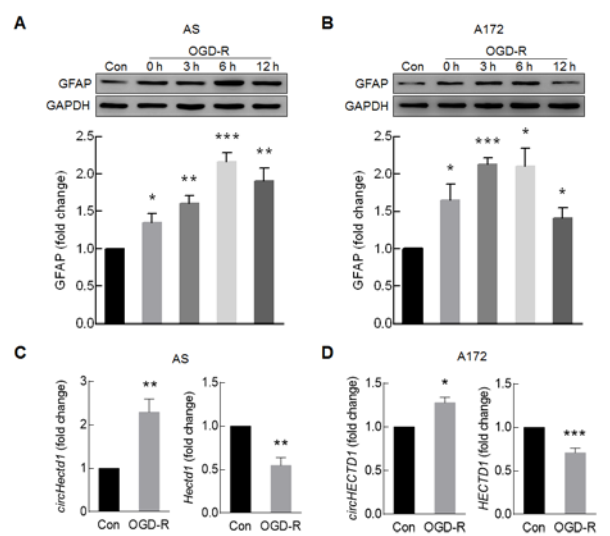
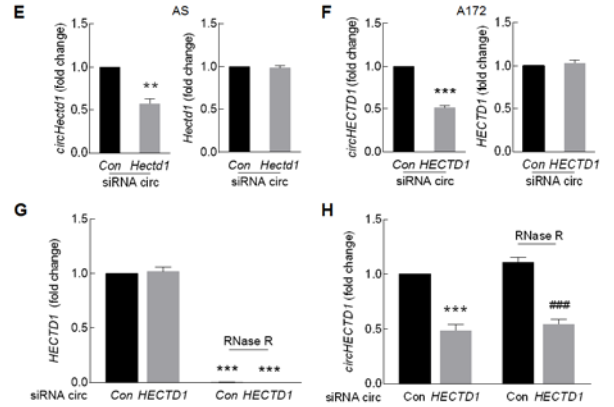
5. circHECTD1介导星型胶质细胞活化的具体机制?
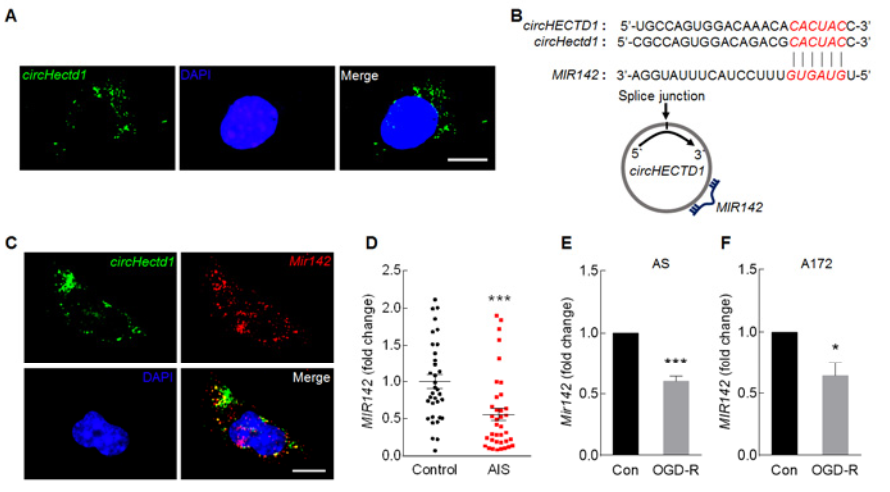
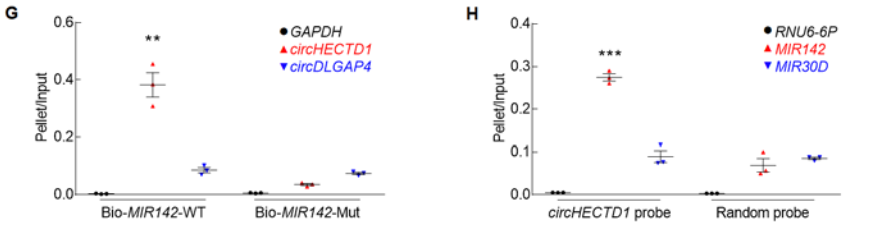
通过荧光原位杂交FISH实验证明, circHECTD1主要分布在胞浆(A),这促使作者联想circHECTD1是否会作为内源竞争性RNA,通过互补碱基配对结合miRNAs,从而影响miRNAs调控某个基因的转录表达。通过RNA杂交的生物信息系统分析,发现circHECTD1包含靶向MIR142的序列位点(B),FISH实验也证明circHECTD1与MIR142在胞浆中的共定位(C)。同时AIS病人血浆中MIR142的水平要远远低于健康人群的(D);体外经OGD-R诱导活化,胞内MIR142的表达水平明显下调(E-F);通过体外正反亲和吸附分离实验,证明biotin标记的野生型MIR142可以亲和分离circHECTD1,而不能分离阴性对照circDLGAP4;biotin标记的互补配对序列突变的MIR142无法结合分离两者(G)。biotin标记特异性circHECTD1探针可作为circHECTD1可以特异性分离MIR142,而无法分离MIR30D(H)。以上结果证明circHECTD1可以结合MIR142。
6. circHECTD1-MIR142通路通过什么分子机制调节胶质细胞的活化?
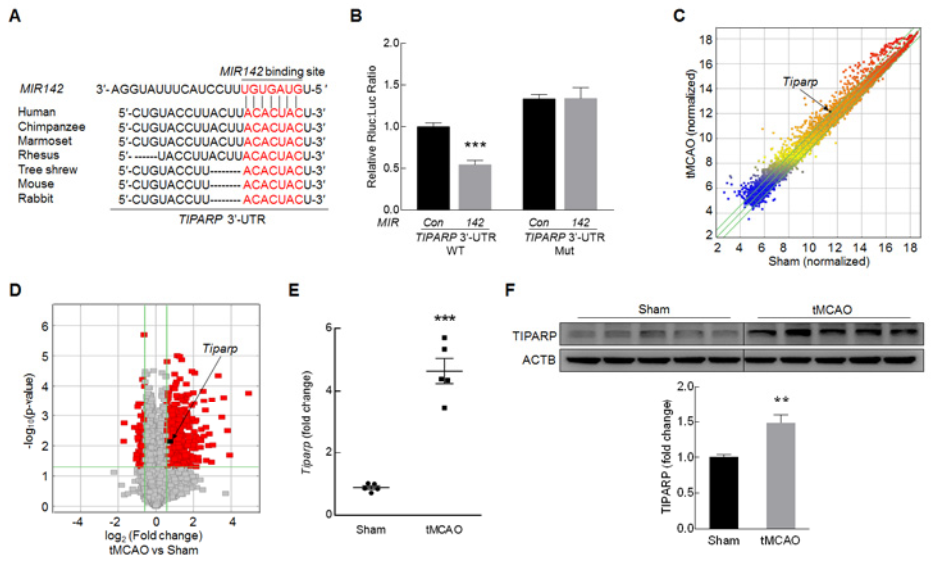
通过TargetScan筛选MIR142的候选靶基因,发现大多数物种中MIR142可结合TIPARP的3′-UTR保守序列的情况(A),荧光素酶报告基因实验也证明了这个结合能力(B);同时基因组表达谱、RT-PCR和WB检测分析,同样证明在tMCAO小鼠模型中TIPARP的表达水平是上调的(C-F);在小鼠大脑皮质中GFAP 和TIPARP蛋白的共定位情况(G);体外敲低MIR142可以促进TIPARP的蛋白表达水平,而给予MIR142模拟物可以降低TIPARP的蛋白表达水平(H-I)。tMCAO小鼠模型中,给予circHectd1 siRNA慢病毒注射可以抑制原本上调的TIPARP的蛋白表达水平(J),以上结果提示circHECTD1-MIR142通路下游的靶基因是TIPARP。
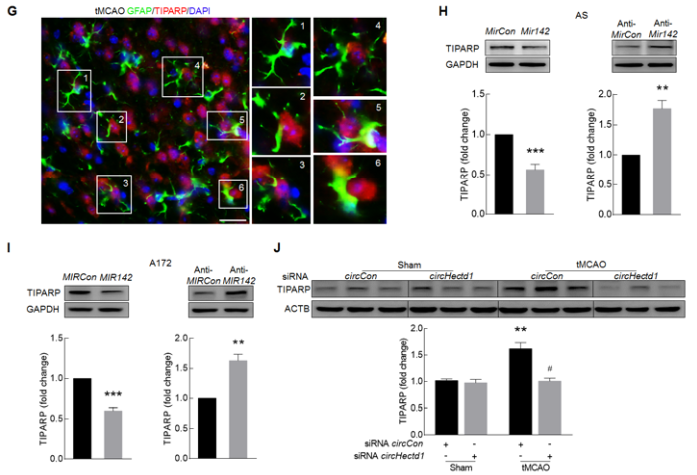
7. circHECTD1-MIR142轴通过下游的TIPARP分子促进星型胶质细胞的活化
体外给予AS和A172细胞OGD-R处理后,胞内TIPARP的蛋白表达水平明显上调(A-B),但如果同时敲低circHECTD1表达,胞内TIPARP的蛋白表达水平会受到抑制(C-D);为了进一步证明circHECTD1通过MIR142调控TIPARP的表达,敲低circHECTD1的表达会抑制原本被anti-MIR142诱导表达上调的TIPARP蛋白的表达(E);过表达circHECTD1会促进原本被MIR142模拟物诱导表达下调的TIPARP蛋白的表达(F)。那到底TIPARP分子在促进星型胶质细胞的活化过程中发挥什么作用?作者敲低TIPARP会明显降低OGD-R诱导星型胶质细胞的GFAP蛋白表达,即细胞的活化;转染anti-MIR142到细胞可以诱导胶质细胞的活化,而敲低circHECTD1会抵消该效果(G-I)。
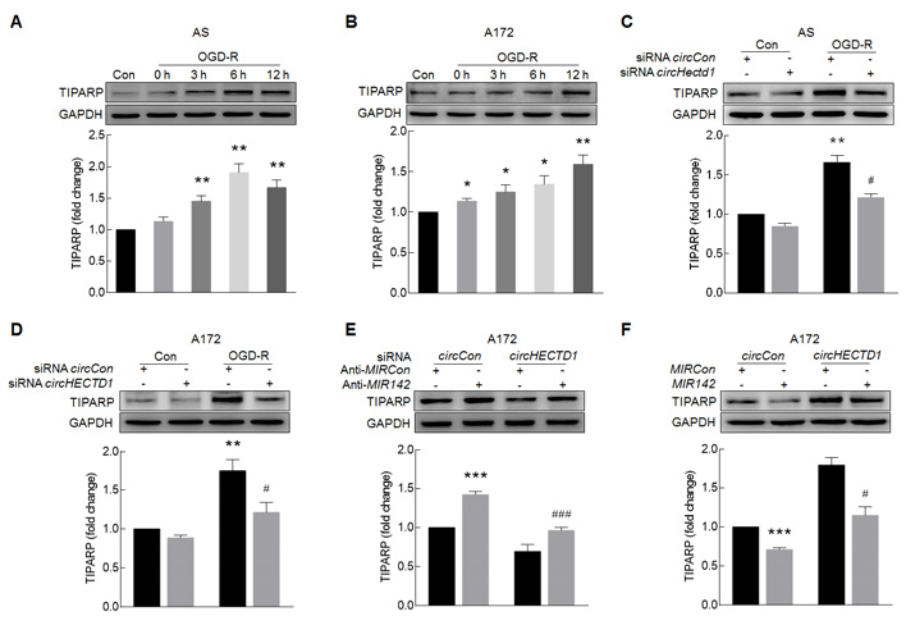
8. 自噬参与星型胶质细胞的活化过程,那circHECTD1对自噬有什么影响?
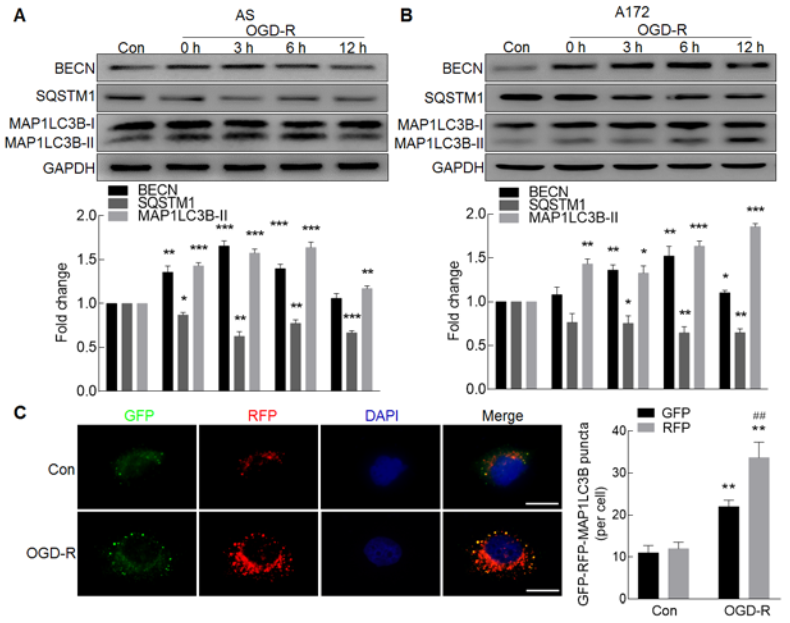
体外给予AS和A172细胞OGD-R处理后,胞内自噬相关Beclin 1和LC3B-II蛋白水平上调,p62蛋白水平下调,提示细胞内自噬流增加(A-B);通过转染胶质细胞mRFP-GFP-MAP1LC3B腺病毒,confocal成像追踪细胞活化后自噬流的变化,OGD-R处理细胞后自噬溶酶体增加,自噬流增加(C);体外敲低circHectd1表达抑制OGD-R诱导MAP1LC3BII的蛋白表达,即抑制细胞的自噬(D-F);体内敲低circHectd1表达抑制tMCAO小鼠中MAP1LC3BII的蛋白表达,以上结果证明了抑制circHECTD1的表达会抑制星型胶质细胞的活化。
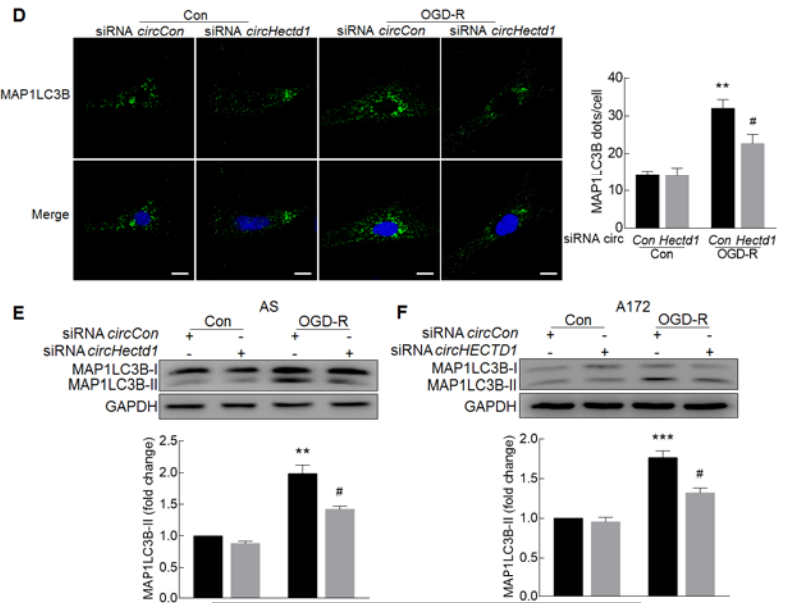
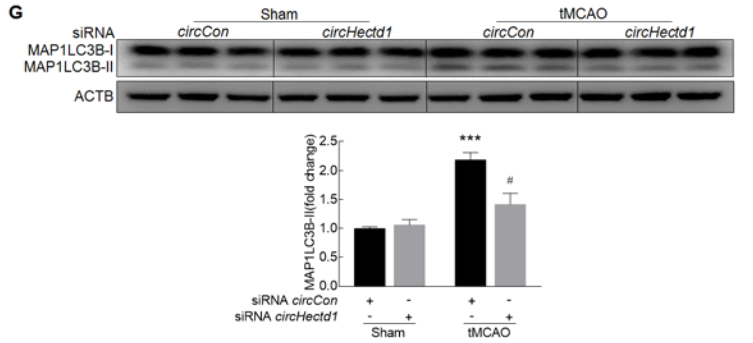
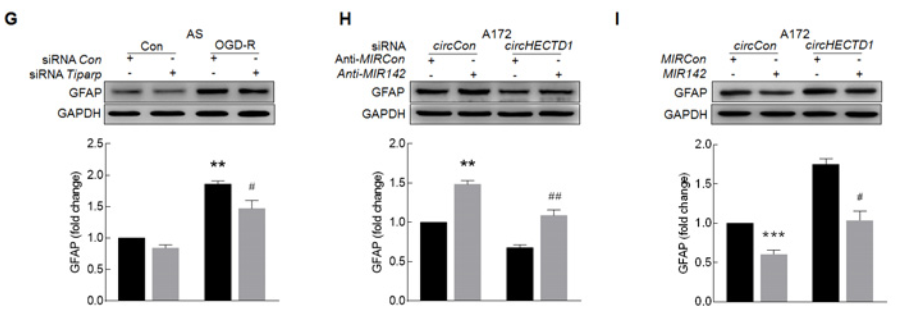
9. circHECTD1-MIR142可以调节星型胶质细胞的活化,那这个轴是否通过TIPARP影响细胞的自噬过程?
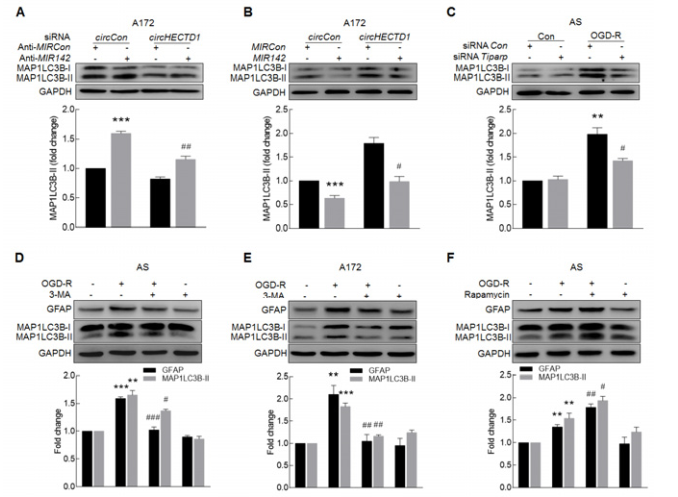
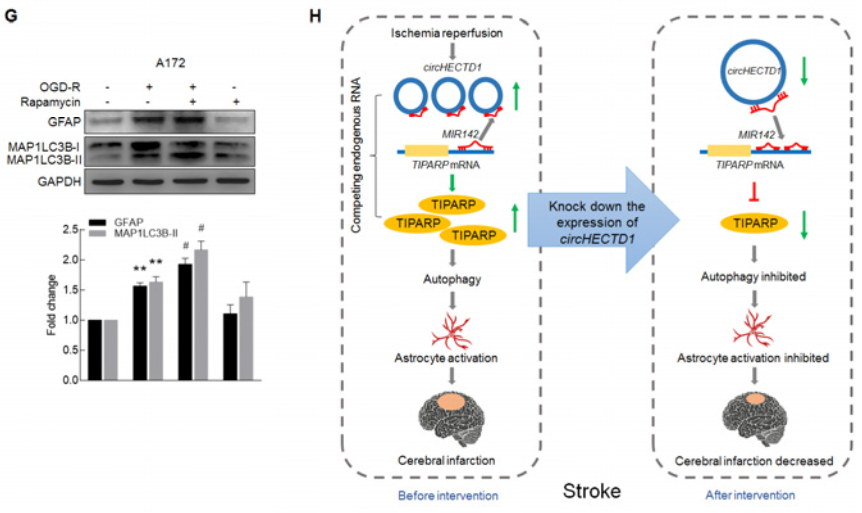
转染anti-MIR142会促进细胞自噬,而敲低circHECTD1的表达会抑制该效果(A);MIR142模拟物会抑制细胞自噬,而过表达circHECTD1会抵消这个抑制效果(B);而Tiparp siRNA会明显抑制OGD-R诱导星型胶质细胞的自噬(C)。那胶质细胞的自噬到底对其活化有什么影响?利用自噬抑制剂3-MA抑制早期自噬体形成,会明显降低OGD-R诱导的GFAP和MAP1LC3B-II蛋白表达水平(D-E);相反,利用自噬诱导剂雷帕霉素,可以明显增强OGD-R诱导的GFAP和MAP1LC3B-II蛋白表达水平,即胶质细胞的活化(F-G)。H图是整篇文章的思路总结。
参考文献
1. Han B, Zhang Y, Zhang Y, et al.. Novel insight into circular RNA HECTD1 in astrocyte activation via autophagy by targeting MIR142-TIPARP: implications for cerebral ischemic stroke. Autophagy. 2018 Jul 20:1-21. doi: 10.1080/15548627.2018.1458173.
.png)
