细胞培养是指从体内组织取出细胞模拟体内环境,在无菌、适当温度及酸碱度和一定营养条件下,使其生长繁殖,并维持其结构和功能的一种培养技术。细胞培养主要应用于以下三个方面:
1. 药物研究与开发
- 新药筛选
- 疫苗研究与开发
- 基因工程药物研究与开发
- 细胞工程药物研究与开发
2. 基础研究
- 药物作用机理
- 基因功能
- 疾病发生机理
3. 生物制药
- 疫苗生产
- 基因工程药物生产
- 诊断用和药用单克隆抗体生产
- 细胞工程药物生产
培养细胞的生长方式:
贴壁生长:
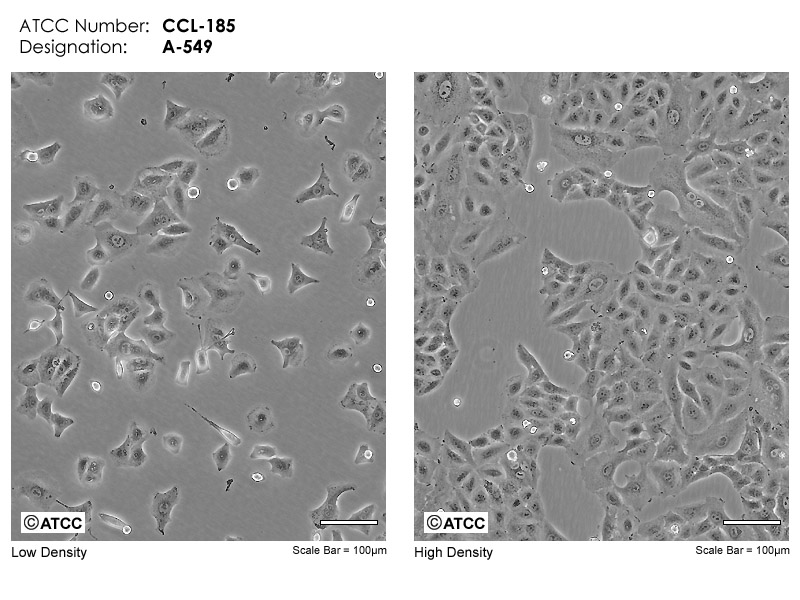
必须贴附于支持物表面才能生长。见于各种实体组织来源细胞、上皮细胞,如下面左图。
悬浮生长:
于悬浮状态下即可生长,不需要贴附于支持物表面。见于各种造血系统肿瘤细胞,如下面右图。

细胞培养的环境:
1、温度环境:37℃。偏离这一温度范围,细胞的正常代谢会受到影响,甚至死亡。培养细胞对低温的耐受力较对高温强。
2、气体环境: 95%空气加5%二氧化碳
3、酸度环境:大多数细胞的适宜PH 为7.2-7.4,细胞耐酸性比耐碱性大一些。
4、 细胞培养基:合成培养基、天然培养基。
5、细胞培养的仪器与设备:CO2培养箱、超净工作台、倒置显微镜、培养瓶、培养皿、液氮罐、无菌水、PBS、培养基、胰蛋白酶液等。
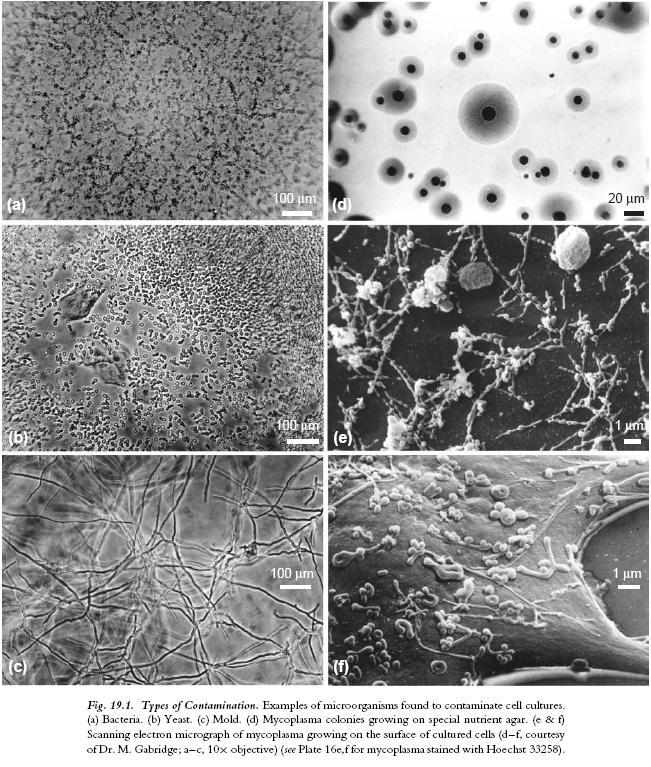
6、无污染环境:微生物污染一直是细胞培养的主要问题,严格遵守无菌操作技术。
原代培养:细胞分离之后至第一次传代之前的细胞培养阶段。
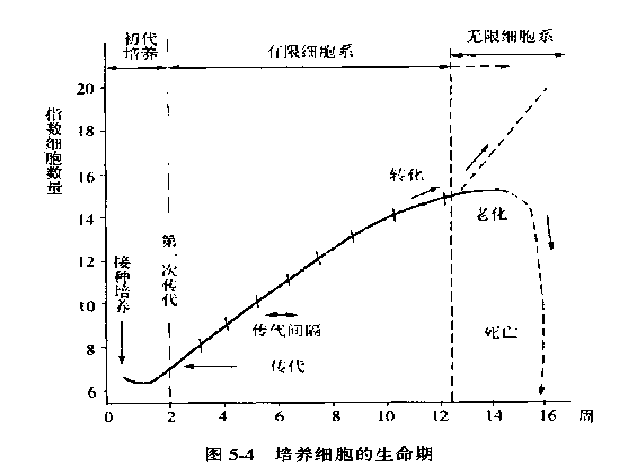
传代培养:培养物分割成小的部分,重新接种到另外的培养器皿(瓶)内,再进行培养。这个过程就称为传代(passage)或者再培养(subculture)。
传代培养的要诀
1.勤观察
- 每天肉眼观察培养基颜色是否异常,有无混浊
- 观察培养基颜色变化速度是否异常:变化过慢意味着细胞生长过于缓慢;变化过快而细胞密度并不大,表明有污染的可能性。
- 镜下观察细胞形态、生长速度。
- 观察培养箱水盘中的水是否干净。
- 观察CO2压力表。
- 观察液氮罐内液氮体积
2.严格无菌操作
轻柔:避免机械力损伤细胞,重悬细胞时尽量用50ml离心管,通过晃动离心管分散细胞,尽量避免过力吹打。离心力不可超过300g(普通台式离心机水平转子1000rpm)。
快速:防止因过分小心导致操作时间过长,增加污染概率。
何时换液?
- pH降低。培养基颜色由红变橙要警惕,变成黄色之前一定要换液。pH降至6.5时,细胞停止生长;降至6.0,细胞失去活性。无法挽救。
- 发现细胞出现形态衰退时须勤换液
- 若培养物密度过低或者生长缓慢,则更换一半培养基。
贴壁细胞换液的操作:吸出或倒出旧培养基;加入同体积新培养基。
悬浮细胞换液操作:将培养液移入离心管中,1000rpm×5min 离心,弃上清,加入新培养基重悬细胞,移入培养瓶,继续培养。
每代贴附生长细胞的生长过程:
- 游离期:细胞接种后在培养液中呈悬浮 状态.也称悬浮期。此时细胞质回缩,胞体呈圆球形。10分钟一4小时
- 贴壁期:血清中有促使细胞贴壁的冷析球蛋白和纤粘素、胶原等糖蛋白(生长基质),这些带正电荷的糖蛋白的促贴壁因子先吸附于底物上,悬浮细胞再与吸附有促贴壁因子的附着。进口塑料培养瓶涂有生长基质(化学合成的功能基团)
- 潜伏期:此时细胞有生长话动,而无细胞分裂。细胞株潜伏期一般为6~24小时。
- 对数生长期:细胞数随时间变化成倍增长,活力最佳,最适合进行实验研究。
- 停止期(平台期)细胞长满瓶壁后,细胞虽有活力但不再分裂。 机制:接触抑制、密度抑制。尽量避免细胞进入平台期。
何时传代?
在对数生长末期传代,不可在潜伏期传代。
贴壁细胞何时传代?
- 细胞密度,90%汇合度。若继续放置超过24h,细胞将脱离细胞周期,再接种需要很长时间才能恢复。
- 须频繁更换培养基时。
- 理想的传代频率:1:2~1:4传代,接种密度104~105/ml, 每7天传代一次。
- 常规传代最好依据严格的时间表进行。
贴壁生长细胞传代方法
- 吸尽培养瓶中的培养液。
- 用PBS(或Hank’s)洗涤细胞两次,吸光缓冲液。
- 加入0.25%的胰蛋白酶液(0.1ml/cm2)到培养瓶细胞面对侧。
- 翻转培养瓶,使胰酶完全覆盖细胞层,静置2-10 min(室温或37度,显微镜下动态监测,至细胞变圆隆起)。
- 轻拍培养瓶使细胞自瓶壁脱落,加入含血清培养基以终止消化反应。
- 用吸管吸取瓶内培养基,反复吹打瓶壁细胞,形成细胞悬液。
- 收集细胞悬液于离心管内,1000rpm×5min离心,弃上清。
- 加入培养基重悬细胞。
- 吸取适量细胞悬液,接种于新的培养瓶内。
- 加适量新鲜培养基于接种了细胞悬液的新培养瓶内。
- 将新培养瓶放入培养箱中培养。
悬浮细胞传代
- 细胞密度:超过1×106/ml,需要频繁更换培养基时。
- 离心法传代:离心(1000rpm×5min)去上清,沉淀物加新培养液后混匀传代。
细胞计数
- 制备单细胞悬液,吹打均匀后,转移一小部分样本(500ul)至1.5mlEP管中,加入等体积0.4%台盼蓝染液。
- 75%酒精清洗计数板表面,注意不要划伤计数表面。
- 将已染色待测细胞悬液吹打均匀,然后用移液器吸取20ul细胞悬液沿盖片边缘缓缓滴入,要保证盖片下充满悬液,液体刚好流到计数板凹槽边缘。注意盖片下不要有气泡,也不能让悬液流入旁边槽中。
- 将计数板平放在显微镜载物台上计数。
- 统计角上四个大格的活细胞数。对于压线细胞的处理:数上不数下,数左不数右细胞团按照一个细胞计。结果计算:(细胞悬液的细胞数)/ml= ( 四个大格子细胞数之和/4) ×104×2

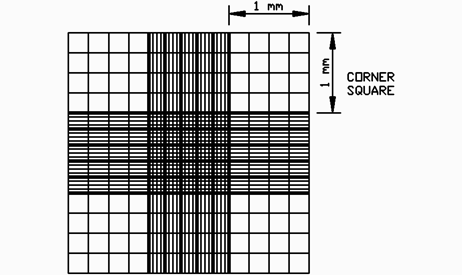
细胞计数板 深度1mm,每个大方格是0.1mm3
细胞冻存
- 细胞低温冷冻贮存是细胞室的常规工作。细胞冻存与细胞传代保存相比可以减少入力、经费,减少污染,减少细胞生物学特性变化。
- 细胞冻存和复苏过程中,对细胞最大伤害的是细胞内水形成的冰晶。所以最重要的就是要减少冰晶的形成。
1. 冻存和复苏的原则:慢冻快融
- 当细胞冷到零度以下,可以产生以下变化:细胞器脱水,细胞中可溶性物质浓度升高,并在细胞内形成冰晶。
- 如果缓慢冷冻,可使细胞逐步脱水,细胞内不致产生大的冰晶;相反.结晶就大,大结晶会造成细胞膜、纲胞器的损伤和破裂。复苏过程应快融,目的是防止小冰晶形成大冰晶,即冰晶的重结晶。
2. 加入细胞保护剂(DMSO、甘油等)
常用的低温保护剂是二甲基亚砜(DMSO),它是一种渗透性保护剂,可迅速透入细胞,提高胞膜对水的通透性,降低冰点,延缓冻结过程,能使细胞内水分在冻结前透出细胞外,在胞外形成冰晶,减少胞内冰晶,从而减少冰晶对细胞的损伤。有毒!强渗透性。可以渗入乳胶手套。
- 使用浓度:5%~10%,一般用10%。
- 复苏时需1:20稀释,从10%稀释到0.5%。
- 如果进出细胞速度过快,会对细胞产生渗透性损伤。所以冻存和复苏时要尽量降低细胞内外DMSO的浓度差。
- DMSO与细胞混合后室温下不能放置超过30分钟
- 溶于水时放热,对细胞损害大。不能将纯DMSO直接加入细胞悬液。
- 少数细胞系对DMSO敏感,冻存时改用甘油。
满足冻存标准的细胞
- 形态学健康
- 生长良好
- 处于对数生长晚期
- 无污染。
- 细胞浓度至少1×106/ml,最好1×107/ml。
- 溶液成分:40%血清+5%~10%DMSO+50%合成培养基。血清含量越高,对细胞保护越好。含量最高可提高到90%。
冷冻方法一
- 先将冻存管放入4℃冰箱,约30min
- 接着置于-20℃冰箱,约30-60min
- 置于-80 ℃超低温冰箱中放置过夜
- 置于液氮罐中长期保存
- —20 ℃放置时间不可过长,否则细胞存活率低。可略去这一步,4 ℃30min后直接放入-80 ℃超低温冰箱
 程序降温盒
程序降温盒
冷冻方法二
- 将冻存管放于程序降温盒中。
- 将程序降温盒置于-80 ℃超低温冰箱中放置过夜。
- 置于液氮罐中长期保存。
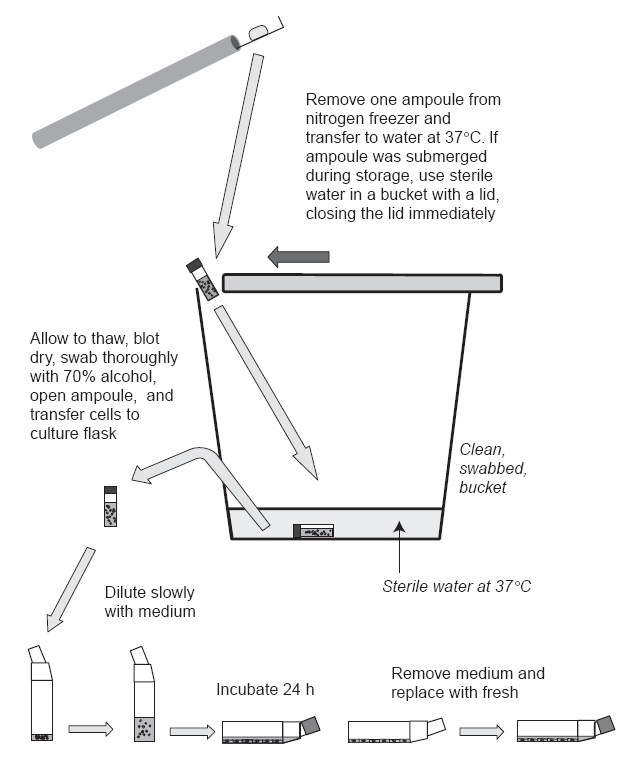
细胞复苏的方法
- 从液氮中取出冷冻管,迅速放入37~38 ℃水浴中,使其融化(1分钟左右),
水面不可没过盖子,防止水污染细胞。注意,冻存管可能爆炸!
- 培养液稀释至原体积的20倍。滴加,10ml/2分钟,先慢后快,边加边摇晃培养瓶。防止DMSO渗透性损伤。
细胞的运送
冻存细胞用干冰运输,鲜活细胞要灌满培养基。
细胞库推荐
1.American Type Culture Collection(ATCC) https://www.atcc.org/
2.中国科学院典型培养物保藏委员会细胞库http://www.cellbank.org.cn/
3.中科院昆明细胞库 http://www.ctcccas.ac.cn/
4.中国典型培养物保藏中心(武汉大学保藏中心) http://sub.whu.edu.cn/cctcc/
.png)
