欢迎各位来到“circRNA研究报道汇总”栏目,本期从pubmed中检索收集最新发布的circRNA文献21篇,下面我们一起来看看circRNA研究最近有哪些新进展。
1、环状RNA TLK1通过调控miR-335-3p/TIPARP途径加重缺血性中风后的神经元损伤和神经功能缺损
论文标题:Circular RNA TLK1 aggravates neuronal injury and neurological deficits after ischemic stroke via miR-335-3p/TIPARP
期刊:J Neurosci影响因子:6.074
通讯作者: 姚红红(东南大学)
近日东南大学医学院姚红红教授发表最新研究成果:发现circTLK1通过miR-335-3p/TIPARP途径加重缺血性中风后的神经元损伤和神经功能缺损。同时姚红红教授也是今年“第五届circRNA研究论坛”的演讲嘉宾之一。
环状RNA(circRNA)在脑中表达丰度通常较高,并且参与各种中枢神经系统疾病。然而,circRNA在缺血性卒中相关神经元损伤中的潜在作用仍然未知。该研究中,作者研究了circRNA TLK1(circTLK1)在这个过程中的重要功能。局灶性脑缺血再灌注小鼠脑组织中circTLK1水平显著升高。敲除circTLK1可显著降低梗死体积,减轻神经元损伤,改善神经功能缺损。此外,circTLK1作为内源性miR-335-3p海绵起到抑制miR-335-3p活性的作用,导致2,3,7,8-四氯二苯并二恶英(TCDD)诱导的聚(ADP-ribose)聚合酶表达增加和随后神经元损伤的恶化。临床研究证实急性缺血性卒中患者血浆中circTLK1水平升高(男性59例,女性12例)。该研究结果揭示了circTLK1在缺血性脑损伤中的不利作用。脑缺血后神经元损伤的程度是决定卒中结局的主要因素。然而,控制缺血性神经元死亡的分子开关知之甚少。虽然作者之前的研究表明circRNA参与缺血性卒中,但是circRNA在神经元损伤中的潜在作用仍然很大程度上未知。从缺血性卒中和患者的动物模型分离的脑组织和血浆中,circTLK1的水平显著增加。敲除circTLK1可显著降低梗死体积,减轻神经元损伤,并改善随后的长期神经功能缺损。这些结果提供了第一个明确的证据表明circTLK1对缺血性中风是有害的。
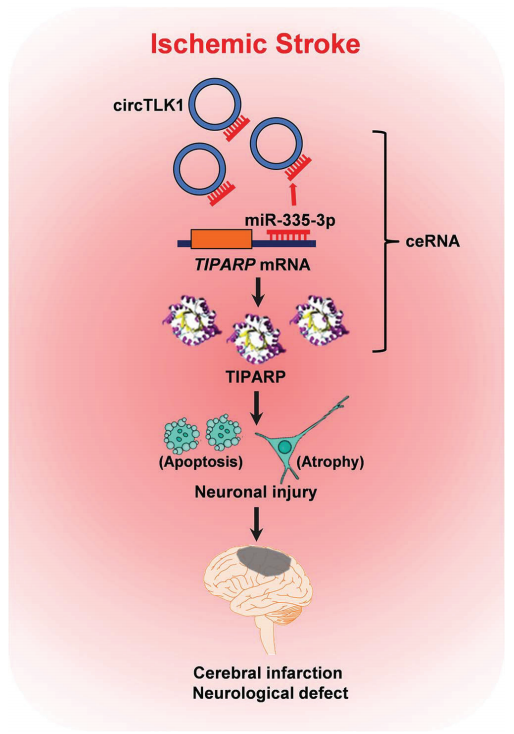
图注:circTLK1通过miR-335-3p/TIPARP途径加重缺血性中风后的神经元损伤和神经功能缺损的作用机制示意图
2、靶向circBMPR2/miR-553/USP4轴治疗乳腺癌的潜在方法
论文标题:Targeting the circBMPR2/miR-553/USP4 Axis as a Potent Therapeutic Approach for Breast Cancer
期刊:Mol Ther Nucleic Acids 影响因子:5.919
通讯作者:杨其峰(山东大学齐鲁医院乳腺外科)
该研究确定了一种新的circRNA-circBMPR2,在转移性的乳腺癌组织中低表达。此外,circBMPR2表达与乳腺癌细胞的运动性呈负相关,并在人乳腺癌组织中显著下调。在功能上,circBMPR2敲低有效地增强了细胞增殖,迁移和侵袭。此外,circBMPR2敲低通过抑制他莫昔芬诱导的细胞凋亡来促进乳腺癌细胞的他莫昔芬抗性,而circBMPR2过表达导致他莫昔芬抗性降低。在机制上,实验结果表明circBMPR2可以大量吸附miR-553,miR-553在乳腺癌中起肿瘤抑制剂的作用。并且过表达miR-553可以减弱由circBMPR2过表达引起的抑制作用。泛素特异性蛋白酶4(USP4)是miR-553的直接靶标,我们的研究结果表明,circBMPR2可能作为miR-553海绵,减轻USP4的抑制,从而抑制乳腺癌的进展和他莫昔芬耐药。因此可能circBMPR2/ miR-553/ USP4途径的发现,可能有助于我们为乳腺癌患者开发潜在的新疗法。
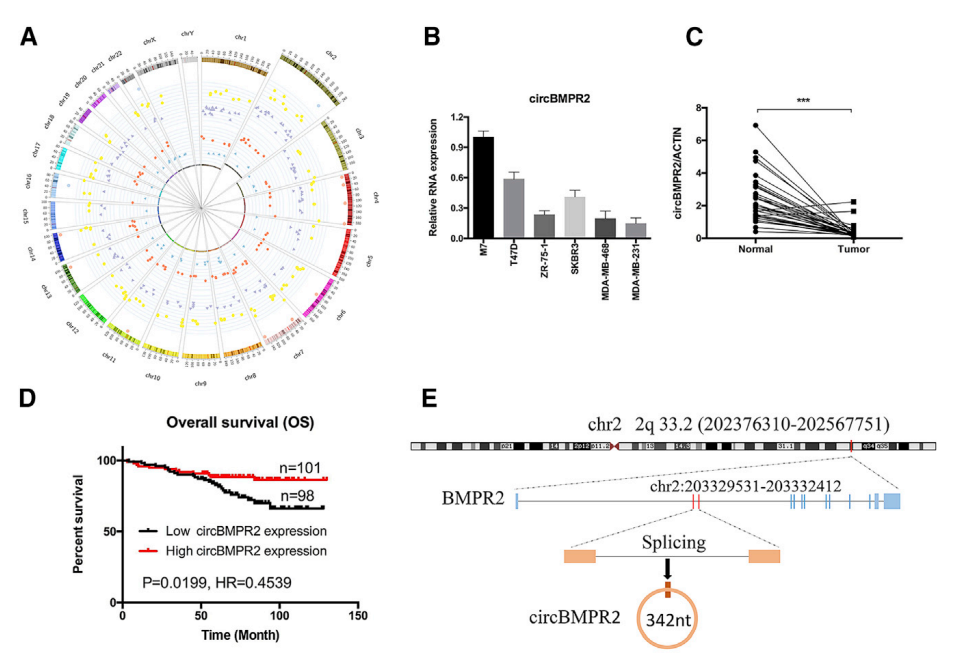
图注:circBMPR2在乳腺癌细胞和组织中显著低表达。
3、胃癌中hsa_circ_006100水平升高通过miR-195/GPRC5A信号传导促进细胞生长和转移
论文标题:Elevated levels of hsa_circ_006100 in gastric cancer promote cell growth and metastasis via miR-195/GPRC5A signalling
期刊:Cell Prolif 影响因子:5.039
通讯作者:郑燕芳(南方医科大学珠江医院)和 周新科(广州医科大学附属第五医院)
该研究主要研究了circRNA hsa_circ_006100在胃癌细胞和胃癌动物模型中的分子功能。研究者通过定量RT-PCR、 CCK-8、Hoechst染色、Transwell、克隆形成、细胞凋亡和裸鼠肿瘤模型等一系列实验。结果显示miR-195与hsa_circ_006100呈负共表达。hsa_circ_006100高水平或miR-195低水平的患者与肿瘤TNM的分期高,细胞分化差和淋巴结转移显著相关。miR-195被hsa_circ_006100靶向吸附并抑制。过表达hsa_circ_006100可增强细胞活力和增殖能力,而过表达miR-195后可抑制hsa_circ_006100增强的细胞生长并诱导MGC-803和AGS细胞中的细胞凋亡。表明miR-195可逆转hsa_circ_006100过表达的细胞功能效应。GPRC5A是miR-195的靶标并且在胃癌中表达上调。抑制miR-195后,GPRC5A可恢复细胞活力,增殖,迁移和侵袭能力,并抑制细胞凋亡。体内实验结果表明hsa_circ_006100的敲低延迟肿瘤生长,降低PCNA表达并上调miR-195和BCL-2表达,其由于GPRC5A/EGFR信号传导,而抑制miR-195可逆转上述过程,且改变裸鼠EMT表型,该研究表明,胃癌中hsa_circ_006100水平升高并通过miR-195/GPRC5A信号传导促进细胞生长和转移。
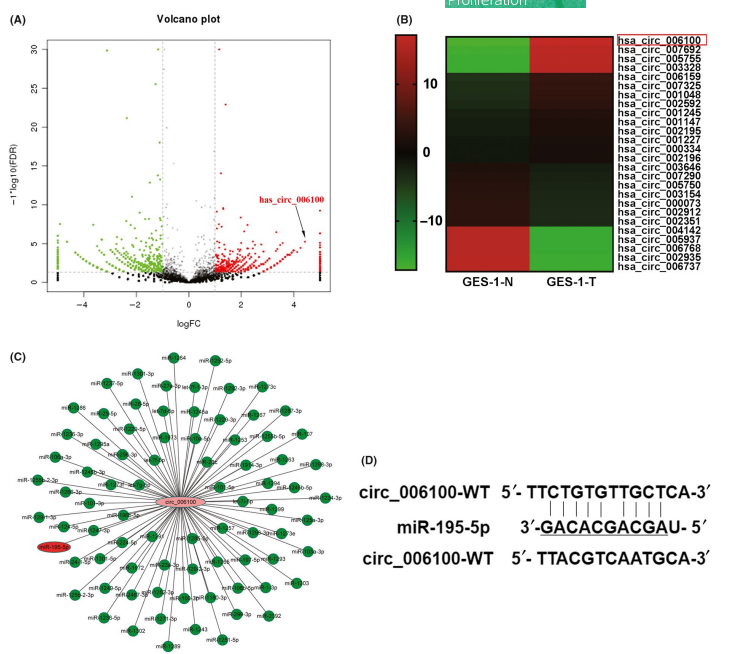
图注:hsa_circ_006100在胃癌中高表达及与miR-195-5p的结合位点。
参考文献列表
.png)
