风风火火做了几年circRNA下来,miRNA sponge功能都要被做烂了,深入的功能和机制研究也确实越来越难。大强发现有同学在必做的circRNA过表达中还能碰到一些问题,今天就再给大家唠叨唠叨。
首先是circRNA过表达的难度
我们都知道circRNA的生成复杂,表达序列来源可变,因此在以质粒为载体进行过表达时主要有这样几个难点:
1)成环效率不稳定:使用不同的促成环框架序列(Alu元件或反向互补序列),对于不同基因的过表达效率可能有差异,例如有序列偏长或偏短的circRNA其过表达成环效率可能会偏低。
2)成环准确率不稳定:在插入的circRNA序列侧翼使用促成环框架序列,这样的载体过表达circRNA成环是很容易的,但要保证在准确的AG-GT位点处剪切成环却不容易。
3)特殊情况:对于特殊序列来源或非AG-GT剪切环化模式的circRNA,使用现有的载体思路可能无法实现高效率成环或准确剪切。
再来看看构建circRNA过表达载体的三种方法
不同实验室构建circRNA过表达载体有不同的习惯,大强看到的主要有下面三种。值得注意的是,大强实验室也做过不少circRNA的过表达,发现确实有基因比较难做,但是换个方案一般都能成功,也提示我们有必要时可以同时用多个方案构建载体,然后挑效果最好的使用。
- pcDNA3.1(+) CircRNA Mini Vector
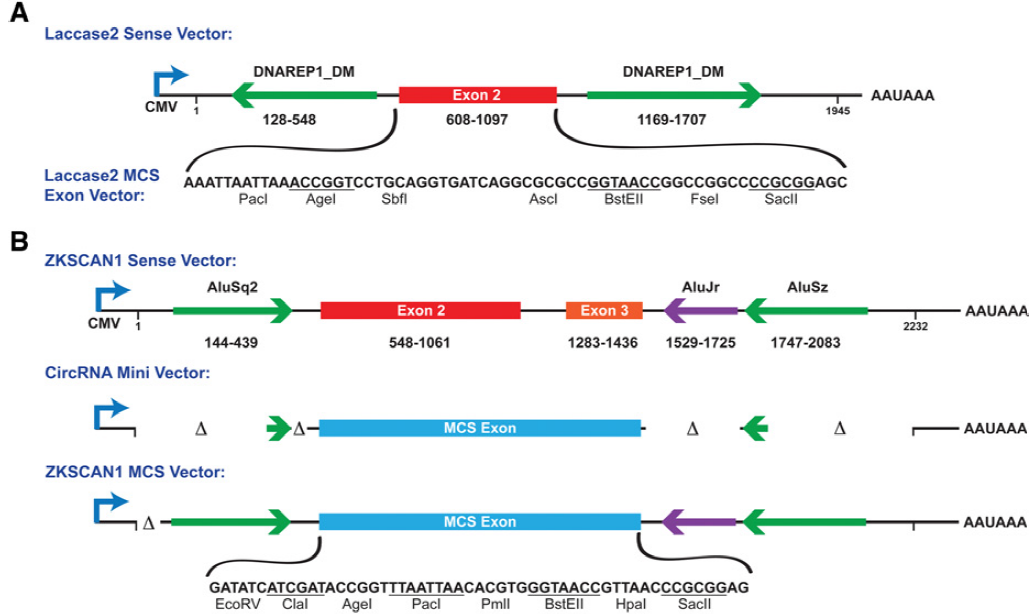
pcDNA3.1(+) CircRNA Mini Vector是文章(Liang et al., 2014)中提供的,该载体分析了circ-ZKSCAN1侧翼序列对成环的影响,删除简化序列后得到上游87nt加下游59nt的成环框架序列,使用pcDNA3.1(+)构建了一个含酶切位点的通用载体。
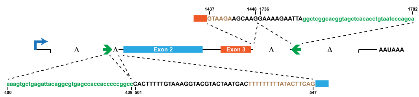
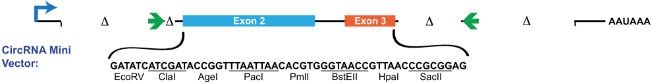
该载体是用酶切位点引入circRNA序列的,剪切成环时识别的AG-GT位点没有经过调整,所以过表达可能会成环错误。因此可以借用这个载体的促成环序列,而不使用其预留的酶切位点,直接合成或以Gibson Assembly将促成环序列加到circRNA的侧翼,然后连到真核表达载体上即可。
aaagtgctgagattacaggcgtgagccaccacccccggccCACTTTTTGTAAAGGTACGTACTAATGACTTTTTTTTTATACTTCAGNNNNNNNNNNGTAAGAAGCAAGGAAAAGAATTAggctcggcacggtagctcacacctgtaatcccagca
这个载体中促成环序列比较短,circRNA过表达的效率可能不稳定,针对不同基因序列或转染细胞的通用性可能也会受限。
另外文章(Kramer et al., 2015)中基于果蝇laccase2基因的侧翼序列改造了一个通用的载体,与pcDNA3.1(+) CircRNA Mini Vector进行对比,并探究了hnRNPs或SR蛋白对过表达成环的影响,对想研究过表达效率比较或调控的同学有一定的参考价值。
- 天然的circRNA侧翼序列
我们都知道体内circRNA的成环是和其侧翼序列密切相关的,因此对特定circRNA过表达可以将自身的上游和下游侧翼序列(常取200-1000nt)与circRNA序列一起克隆出来,连接到真核表达载体上即可。 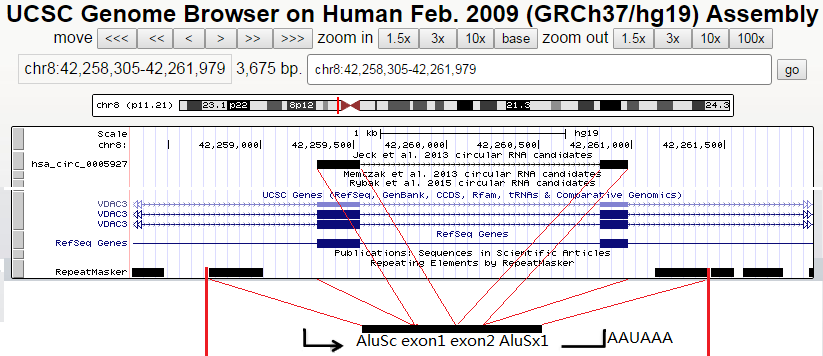
图片引用自微信公众号circRNA
这种方案可能需要分别克隆上游侧翼序列、circRNA序列和下游侧翼序列,将三段序列拼接后连接载体,克隆和构建载体比较麻烦,好处是一般都能成功过表达,且不会出现成环错误的情况。
- 商业化circRNA表达载体
大强看到很多文章方法描述里使用了商业化的circRNA表达载体,如pLCDH-ciR或pCD-ciR,据产品描述,载体均携带优化过的侧翼成环框架,含有精心改造的Alu元件、QKI等RBP的结合位点,并使用全新设计的环化介导序列,能保证插入的circRNA准确高效环化(吉赛生物官网)。
另外他们也推出了升级的第五代circRNA过表达载体,有pCD5-ciR、pCD25-ciR、pLO5-ciR、pLC5-ciR、pK5ssAAV-ciR和pK25ssAAV-ciR,能满足普通真核表达、慢病毒包装和腺相关病毒(AAV)包装等多种用途,优点有环化准确性更高、稳定性更高、通用性更强和可移植性更高(吉赛生物官网)。
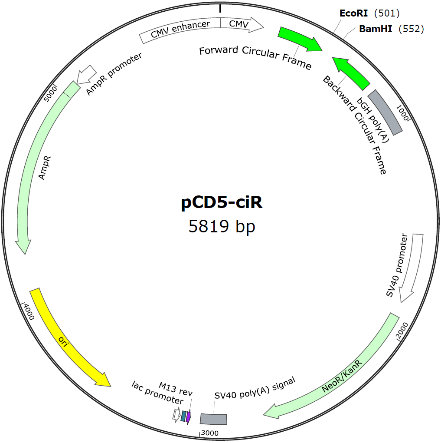
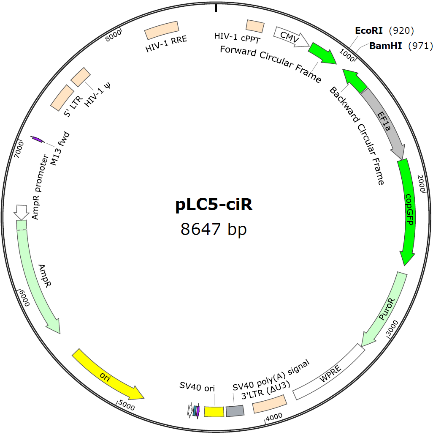
图片引用自吉赛生物官网
这些载体的原理应该也是一样的,不过可能使用了组合型的侧翼促成环框架序列,以保证稳定的过表达成环效率。一个特色是载体构建时引入了一对环化介导序列,据介绍是调控准确剪切的。这样的组合使用可能是为了避免酶切位点等对剪切识别的影响,即在使用酶切连接克隆方法的便利前提下充分保证目的circRNA能高效率准确环化过表达。
这些载体使用的话只需要克隆circRNA的序列(线性化)进载体中,和常规的载体构建一模一样,相对简便省事,且有很多文章引用背书,也是个很好的选择。
然后是circRNA过表达的验证
构建好的circRNA过表达载体一般是瞬转细胞后做RT-qPCR检测验证过表达是否成功,需要注意的是除了做qPCR检测过表达倍数外,还应该将PCR产物进行sanger测序,以验证序列是否准确,即验证过表达的剪切成环是否正确。
做qPCR验证的引物和进行PCR产物测序用的引物在大强实验室是分别设计两对的,因为circRNA的形成也涉及可变剪切,因此要格外注意使用的引物是否会非特异扩增到其他circRNA序列。在引物设计时,Divergent primers位置的不同,扩增的特异性和准确性明显是有差异的。
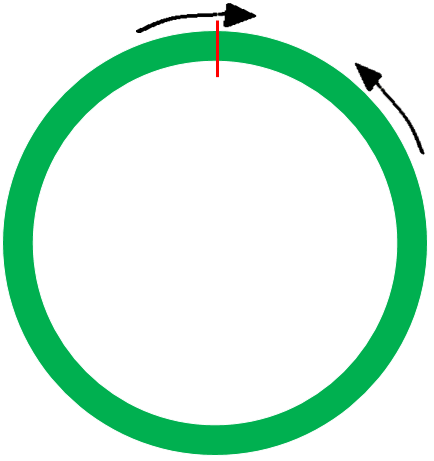
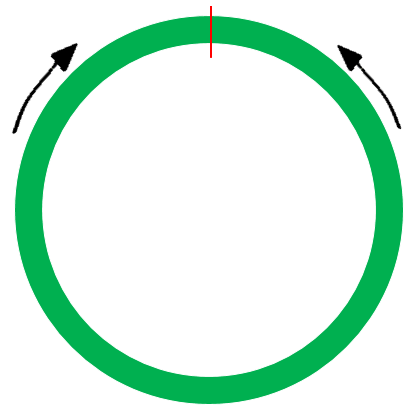
图片引用自微信公众号circRNA
上图左是设计的跨位点引物,即将一条引物放在junction位置,依靠引物3’端的准确或错配来区分特异和非特异扩增,3’端有错配时基本不能扩增,因此特异性是最高的,适合用来做qPCR计算过表达倍数。
上图右是设计的不跨位点引物,即将junction放在PCR产物的中间,这种引物有可能扩增其他的circRNA,特别是junction处有其他外显子的情况,因此特异性偏低一点,但适合用来做PCR后进行sanger测序,依靠PCR产物电泳检测大小和测序序列是否准确,可以判断过表达后剪切成环是否正确。
除了基于侧翼反向重复序列质粒的circRNA过表达外,也有以tRNA-TSEN连接得到circRNA的方法,但是对circRNA长度有一定限制,也不能得到环化准确的circRNA序列,因此用于circRNA过表达还有不足。另外也可以使用核酶(ribozyme) 在体外剪切得到circular RNA,或者在体外转录线性RNA后用T4 RNA ligase连接成环,这些方法文章还比较少,且很难得到环化准确的circRNA序列,就以后有机会再讲了。
参考文献:
- Liang D, Wilusz JE. Short intronic repeat sequences facilitate circular RNA production. Genes Dev. 2014;28:2233–2247.
- Kramer MC, Liang D, Tatomer DC, Gold B, March ZM, Cherry S, et al.. Combinatorial control of Drosophila circular RNA expression by intronic repeats, hnRNPs, and SR proteins. Genes Dev. 2015;29(20):2168-82.
- Zhang M, Zhao K, Xu X, Yang Y, Yan S, Wei P, et al.. A peptide encoded by circular form of LINC-PINT suppresses oncogenic transcriptional elongation in glioblastoma. Nat Commun. 2018 Oct 26;9(1):4475.
.png)
