肝细胞癌(HCC)在发展中国家(包括中国)特别流行,大多数病人死于HCC的转移,但是潜在的转移发生机制还不清楚。最新的肝癌转移模型证明来源于原发肝癌的循环肿瘤细胞(CTCs)会引发转移。但是原发肝癌与转移的关系也是不清楚的。即使少数CTCs溢出血管着床在某一部位,局部的免疫细胞会杀伤这些CTCs,所以有假说认为原发肝癌可能提供某些支持,促进转移灶形成。例如,原发肝癌分泌的外泌体(PTDEs)提前在转移灶创造适合转移癌生存的微环境,诱导免疫抑制、纤维化和炎症,但是PTDEs对于CTCs的作用有待探讨。
已有研究报道,活性氧ROS可以促进细胞粘附,而且CTCs中的ROS水平是升高的,高水平的ROS与增强的侵袭和转移能力相关。但是调节ROS水平与CTC粘附的关系有待进一步验证。

来自浙江大学医学院附属第二医院的梁廷波教授最近在Oncogene杂志上发表了题为“Primary tumor-derived exosomes facilitate metastasis by regulating adhesion of circulating tumor cells via SMAD3 in liver cancer”的有关外泌体促进肝癌转移的研究。研究发现,肝细胞癌(HCC)以旁分泌或者内分泌的方式促进癌细胞增殖和肺转移形成。而且HCC衍生的外泌体介导了这种现象,这些恶性外泌体可以增强细胞粘附。进一步的研究明确了活性氧(ROS)调节粘附分子。粘附的肝癌细胞释放含有SMAD3 mRNA和蛋白质的外泌体,传递给游离的HCC细胞,活化受体细胞的SMAD3-ROS信号通路,以促进其粘附能力。另外,作者发现HCC病人外周血中存在含有SMAD3丰富的外泌体,其水平与疾病分期和原发肿瘤中SMAD3的表达相关。总的来说,该研究揭示了原发HCC支持转移灶形成的可能机制,并提出了含有SMAD3的外泌体在介导原发HCC和循环HCC细胞的相互通讯中的重要作用。
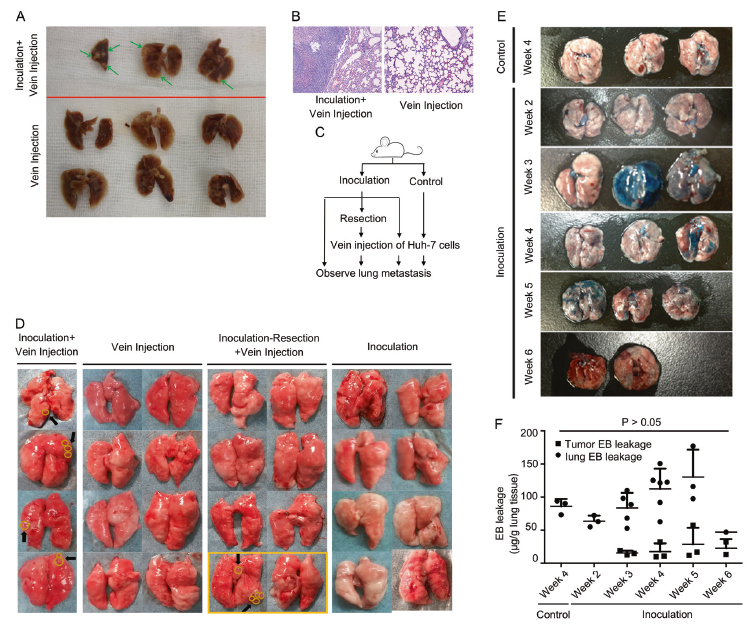
1. 原发肿瘤会促进肺转移
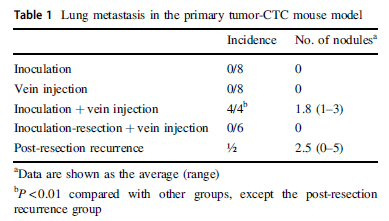
作者在皮下预先移植Huh7肝癌细胞,再通过尾静脉回输Huh7肝癌细胞,4周后观察到肺组织存在Huh7转移灶,而无预先移植Huh7组小鼠则没有发现肺转移(A, B)。假如预先在皮下移植Huh7细胞后再切除,接着尾静脉回输Huh7细胞,这时发现这组小鼠和无预先移植Huh7组小鼠的一样则没有发现肺转移,但是其中两只小鼠的皮下瘤去除不完全,会出现原部位肿瘤复发,而且其中一只小鼠出现肺转移(黄色圆圈),但这些小鼠没有肝和脑转移(C, D,table 1),说明原发肿瘤可以促进CTCs发生肺转移。
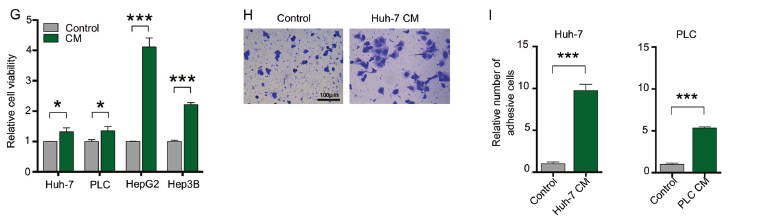
那原发肿瘤可以促进CTCs发生肺转移的机制是什么?Evans blue染色,发现皮下预先移植Huh7肝癌细胞会导致小鼠肺部血管随时间出现通透性增强的趋势,但是无统计学差异(E, F)。相比于用新鲜培养基,用Huh7细胞上清来培养不同的肝癌细胞,会增强这些细胞的存活、增殖能力和粘附能力(G-I)。
2. 原发肿瘤分泌的外泌体可以促进癌细胞的增殖和粘附
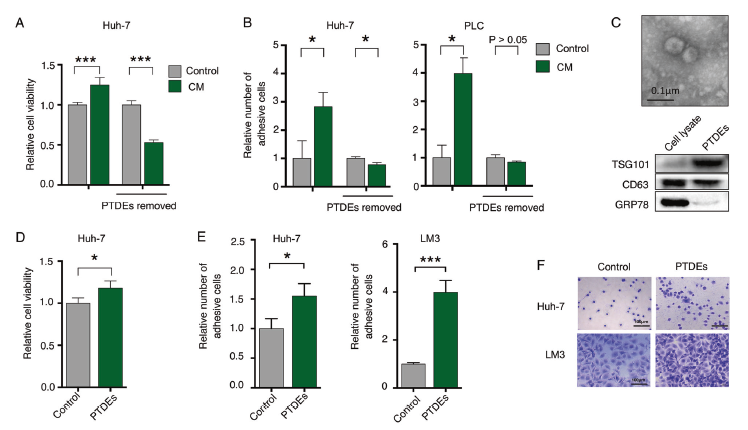
既然肝癌细胞培养上清有促进癌细胞存活、增殖和粘附的特性,作者将培养上清中外泌体成分去除,癌细胞的存活和粘附能力有明显的下降(A, B)。从上清中分离的外泌体电镜形态鉴定和WB鉴定exosome marker 蛋白,用这些原发肿瘤来源的外泌体(PTDEs)处理Huh-7细胞,会增加细胞存活(C, D);PTDEs也可以促进Huh-7和LM3细胞的粘附(E, F)。利用fibronectin和人脐静脉血管内皮细胞HUVECs包被的板子进一步验证了,PTDEs的确促进Huh-7粘附(G-I)。RT-PCR分析和WB鉴定了PTDEs处理后Huh-7细胞内介导细胞粘附的相关基因的mRNA表达和蛋白表达明显上调了(J, K)。
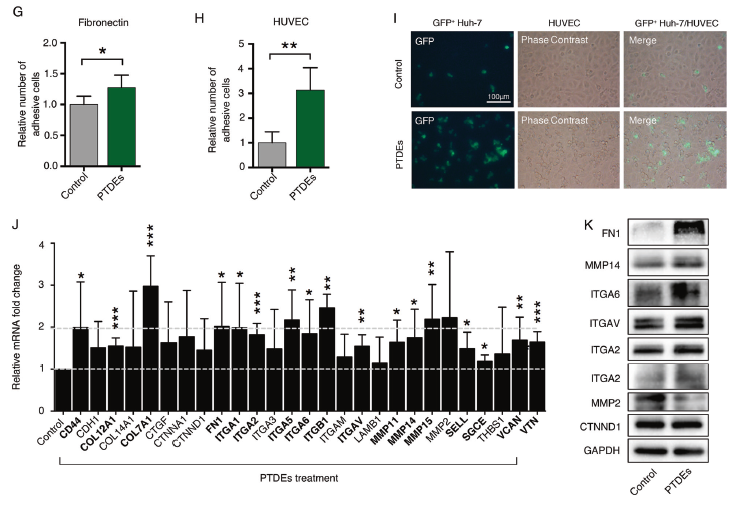
3. 原发肿瘤细胞通过外泌体传递了生物活性物质到CTCs细胞
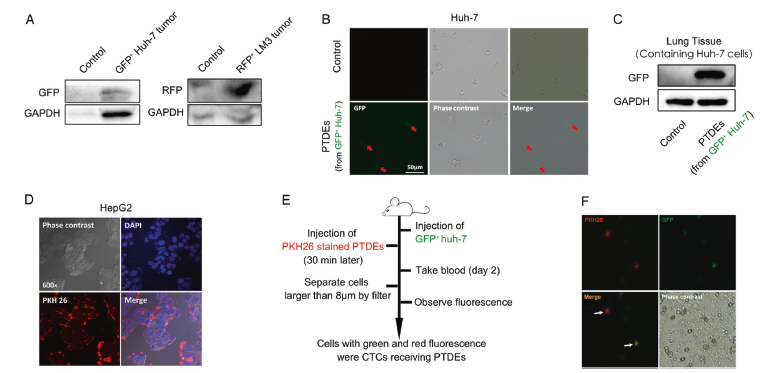
为了明确PTDEs可以被CTCs摄取,首先利用(GFP)+ Huh-7细胞和(RFP)+ LM3细胞皮下成瘤,2周后可检测到小鼠血清中存在GFP和RFP阳性外泌体(A)。GFP+ Huh-7来源的PTDEs处理Huh-7后,可在摄取了PTDEs的Huh-7受体细胞中检测到GFP荧光(B)。PKH26标记HepG2来源的PTDEs处理HepG2后,可在摄取了PTDEs的HepG2受体细胞中检测到红色荧光(D)。尾静脉回输Huh-7细胞和GFP+ Huh-7来源的PTDEs到小鼠,WB鉴定含有转移Huh-7细胞的肺组织表达GFP条带(C)。尾静脉回输GFP+ Huh-7细胞和PKH26 标记的 Huh-7来源的PTDEs到小鼠,confocal显微成像证明血中存在带红色和绿色荧光的Huh-7细胞(E, F)。
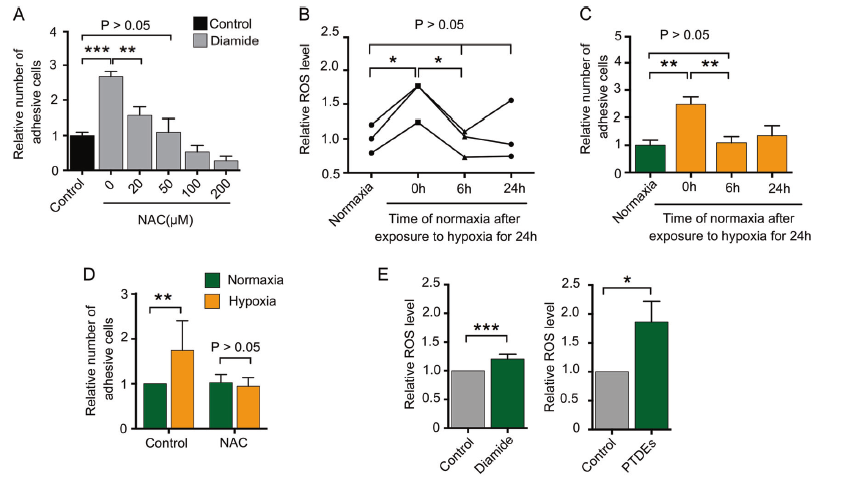
4. PTDEs上调ROS促进癌细胞的粘附
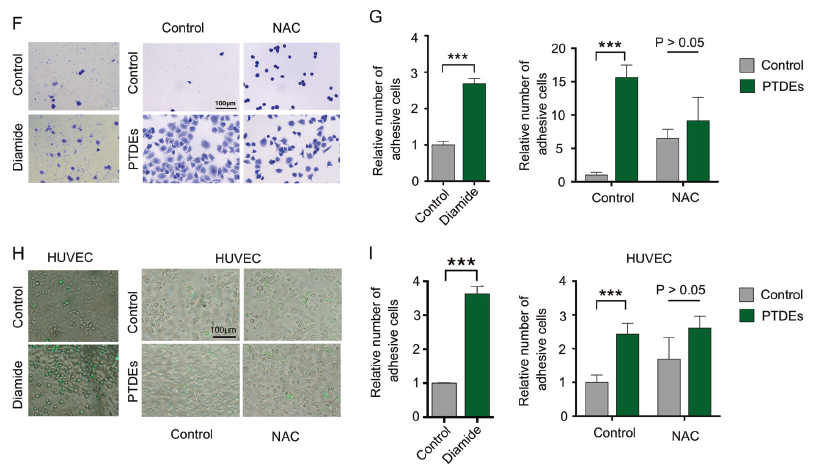
由于ROS在介导癌细胞粘附中其重要作用,而且缺氧的肿瘤微环境也会上调ROS水平。用ROS诱导剂diamide可以增加癌细胞粘附,而ROS清道夫NAC可以明显抑制癌细胞粘附,并呈现剂量依赖性(A)。缺氧24h后,癌细胞中的ROS水平和粘附能力上调,但是恢复氧供给相应时间后,癌细胞中的ROS水平和粘附能力下调(B,C),而且ROS清道夫NAC可以明显消除缺氧诱导癌细胞增强的粘附能力(D)。在不同粘附条件下,Huh7细胞来源的PTDEs可以提高Huh7细胞的ROS水平和粘附能力,而NAC则会抵消PTDEs的促粘附效果(E-I)。
5. PTDEs通过增强癌细胞中SMAD3信号通路诱导ROS的产生
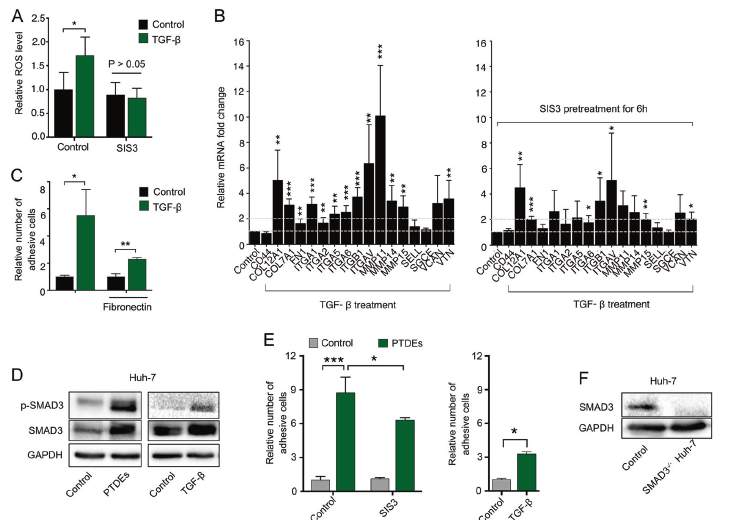
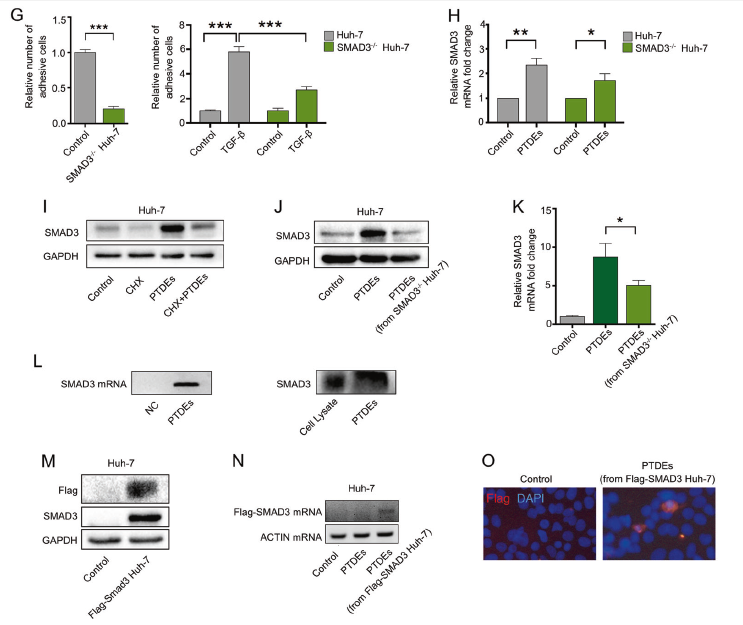
TGF-β可以提高癌细胞ROS水平,上调不同的粘附相关基因和细胞粘附能力,而SIS3抑制SMAD3信号通路会明显抑制这些促效应(A-C)。PTDEs可以上调Huh7细胞内的SMAD3和其磷酸化蛋白的水平(D);给予受体细胞Huh7 SIS3预处理,会明显抑制TGF-β和PTDEs诱导粘附增强的现象(E),另外TGF-β和PTDEs诱导SMAD3-/- Huh7细胞粘附增强的效果也有所减弱(F);但是PTDEs不仅可以上调Huh7细胞的,还会上调SMAD3-/- Huh7细胞的SMAD3 mRNA,提示PTDEs可能转移了SMAD3 mRNA到受体细胞(H);放线菌酮CHX可以抑制mRNA翻译,CHX处理组的SMAD3蛋白下调,而PTDEs处理可以抵消一点CHX的效果,上调了SMAD3蛋白水平,提示PTDEs可能转移了SMAD3蛋白到受体细胞(I)。相比于正常细胞来源的PTDEs,SMAD3-/- Huh7来源的PTDEs无法上调SMAD3蛋白水平(J,K)。RT-qPCR分析和WB鉴定PTDEs存在SMAD3的mRNA和蛋白(L)。为了更好滴区分供体和受体细胞的SMAD3蛋白,已明确SMAD3的转移可能性,作者在Huh7中过表达FLAG-SMAD3后,收集含有FLAG-SMAD3的外泌体与Huh7细胞共孵育,发现受体细胞中存在外源性FLAG-SMAD3 的mRNA和蛋白(M-O)。以上结果提示,癌细胞通过分泌含有SMAD3 的mRNA和蛋白的外泌体转移到受体细胞中,活化SMAD3信号通路,上调ROS的表达。
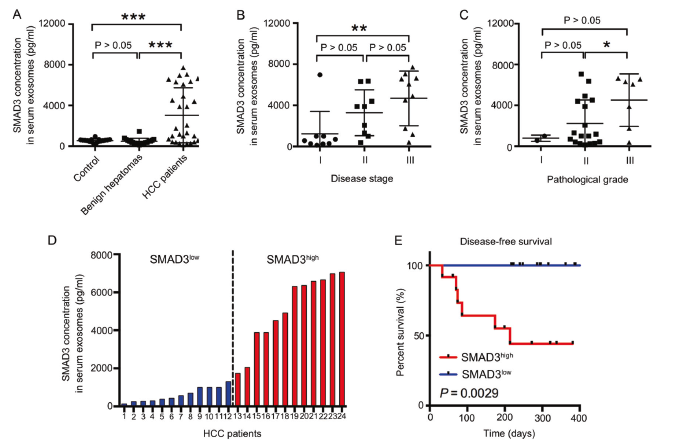
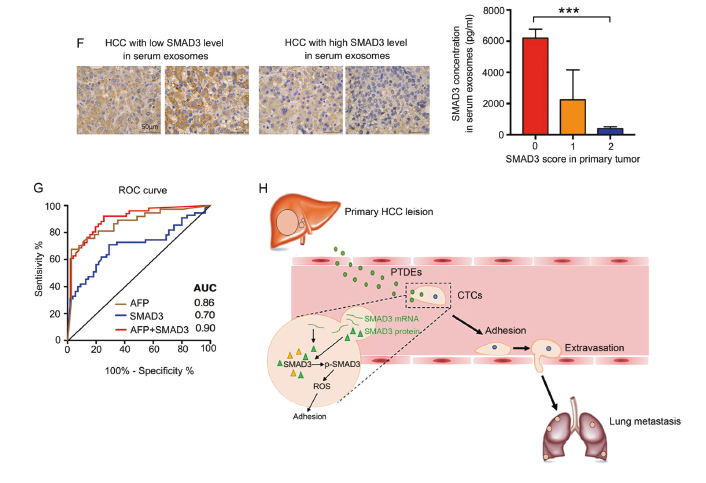
通过临床样本分析,发现相比于正常人和有良性病变的病人,肝癌病人血清中含有更高水平的含有SMAD3的外泌体(A),而且这个水平与疾病的分期、病理严重程度成正相关,与肝癌手术后的无疾病存活期呈负相关(B-D)。另外,HCC病人血清中含有SMAD3的外泌体水平越高,原发肿瘤中SMAD3的表达越低,提示原发肿瘤可能分泌含有SMAD3的外泌体(F)。同时联合检测含有SMAD3的外泌体和α-fetoprotein两个指标,会提高人HCC的诊断准确率(G)。
参考文献
1. Fu Q, Zhang Q Lou Y, et al.. Primary tumor-derived exosomes facilitate metastasis by regulating adhesion of circulating tumor cells via SMAD3 in liver cancer. Oncogene. 2018 Jul 10. doi: 10.1038/s41388-018-0391-0.
.png)
