肝癌作为十大恶性肿瘤之一,由于其恶性程度和危险性,其有着“癌中之王”的称号。肝癌发展迅速,往往确诊时患者已经处于中晚期,死亡率极高。目前急切需要寻找特异性的生物标志物和新治疗靶点,用于诊断和治疗早期肝癌,降低患者的死亡率和改善患者的预后。之前的研究大多集中在肝癌中晚期的研究,本研究则主要聚焦在肝癌早期的研究工作,以寻找合适的生物标志物和治疗靶点。
这次要和各位分享的是一篇发表在HEPATOLOGY(IF= 14.079)杂志上的关于Circ-CDYL—miRNAs—mRNAs调控网络在早期肝癌中特异性表达的研究,为早期肝癌的诊断和治疗提供了新的潜在的生物标志物和治疗靶点,通讯作者为第二军医大学东方肝胆外科研究所的王红阳院士和Liang Li研究员。

如何筛选和鉴定候选circRNA?
首先,研究人员通过微芯片对早期肝癌组织和邻近正常组织的mRNA, circRNA和miRNA表达谱进行了全面的差异表达分析。根据Yvonne Tay等人的研究[2]中介绍的竞争性内源RNA(ceRNA)的特性,作者利用(①候选circRNA和mRNA具有共同的miRNA反应元件(MREs);②在癌组织和正常组织中候选circRNA和mRNA表达水平呈现正相关的模式;③排除调控circRNA-mRNA相互作用的在癌组织和正常组织中差异表达的活性miRNAs)这三个标准,筛选出200种表达模式呈现正相关的circRNA-mRNA对。最终作者聚焦在肿瘤组织中表达上调最高的Circ-CDYL,经miRBase和TargetScan预测,其可能通过海绵miR-892a和miR-328-3p的方式,与肝癌来源生长因子HDGF和缺氧诱导因子天冬酰胺羟化酶HIF1AN相互作用。
相比于肝癌中晚期(B和C期)的组织,肝癌早期(0和A期)组织中Circ-CDYL,HDGF和HIF1AN表达水平均明显上调。Circ-CDYL其实来源于基因CDYL的2号外显子,在11种HCC细胞中表达上调,而在正常肝细胞中表现为低表达。Circ-CDYL在胞浆和胞核均有表达,但主要定位在胞浆,提示其可能作为miRNA海绵,调控下游mRNAs的表达。
Circ-CDYL的生理功能是什么?
其次,体外敲低Circ-CDYL表达,可明显抑制细胞的增殖,降低肝癌启动细胞(T-ICs)和EPCAM+ T-ICs细胞比例,抑制肿瘤成球生长,抑制肝癌细胞的克隆形成和减轻癌细胞对化疗药的耐受性;而Circ-CDYL过表达则出现相反的结果。体内成瘤实验也证明,敲低Circ-CDYL表达可明显抑制肿瘤生长和形成,Circ-CDYL过表达则促进肿瘤的生长。
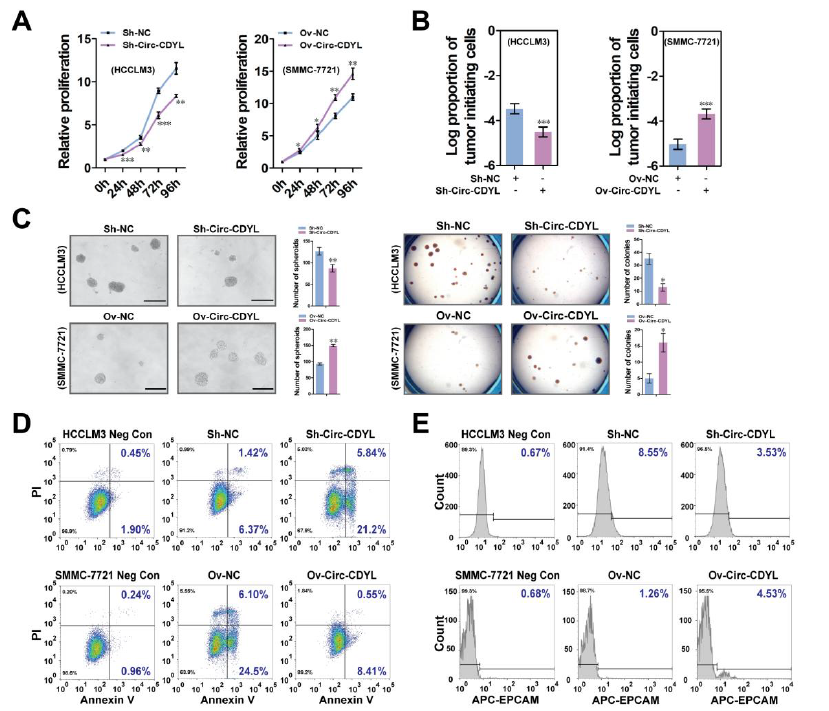
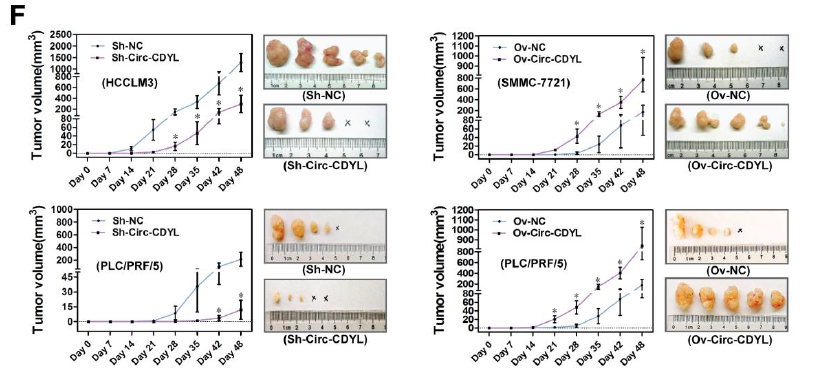
体内和体外Circ-CDYL均可促进HCC细胞的生长【1】
Circ-CDYL是否会sponge miR-892a和miR-328-3p?
为验证miRBase和TargetScan数据库的预测(miR-892a与HDGF、miR-328-3p与HIF1AN之间是否存在相互结合),lucifearse报告基因和pull-down实验证明miR-892a与HDGF、miR-328-3p与HIF1AN、Circ-CDYL与miR-892a 和miR-328-3p之间分别都存在相互结合作用。分别过表达miR-892a 和miR-328-3p,可分别抑制HDGF和HIF1AN的表达,而同时给予位点protector(阻断miRNA与靶基因3’UTRs的结合)处理细胞后,HDGF和HIF1AN的表达可被大部分恢复。
有趣的是,miR-892a不仅可以抑制HDGF的表达, 还可抑制HIF1AN 和Circ-CDYL的表达;miR-328-3p在抑制HIF1AN表达的同时,也可抑制HDGF和Circ-CDYL的表达,这提示miR-892a和miR-328-3p共同调控circ-CDYL, HDGF和 HIF1AN组成的ceRNA网络。
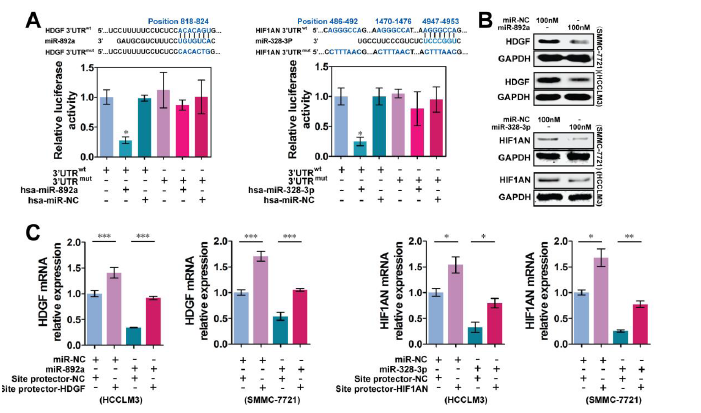
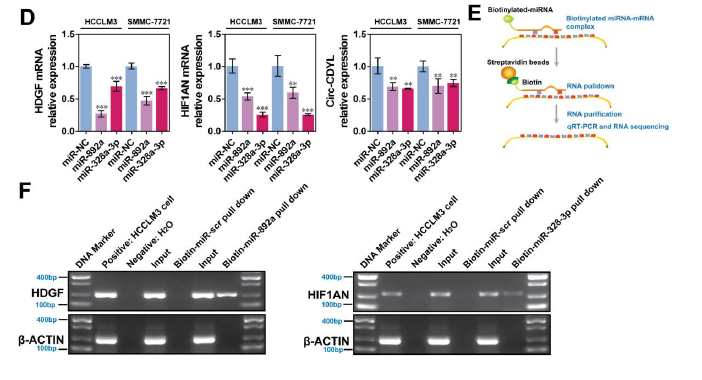
验证miR-892a和miR-328-3p的靶基因是HDGF和HIF1AN【1】
Circ-CDYL 与HDGF 和HIF1AN之间的机制关系?
CeRNA调控网络由lncRNA、circRNA、miRNA和mRNA组成。基于前面的结果,但在早期HCC组织中作者无法观察到,miR-892a与HDGF、miR-328-3p与HIF1AN的表达呈现负相关的模式,而发现Circ-CDYL 与HDGF 和HIF1AN的表达呈现正相关的情况只会特异性出现在早期肝癌组织中,说明这几种分子之间存在复杂的调控关系。当敲低HDGF表达也抑制HIF1AN表达,敲低HIF1AN表达也抑制HDGF表达,同时敲低HDGF和HIF1AN表达可抑制Circ-CDYL,可以解释为:当敲低HDGF表达时,释放的miR-892a会更多地与circ-CDYL结合,一定程度上降低circ-CDYL表达,导致miR-328-3p更多地与HIF1AN结合,抑制其表达,是ceRNA网络调控的经典表现。肿瘤中高表达的circ-CDYL与高表达的miR-892a和miR-328-3p存在明显的共定位,而且Circ-CDYL调控HDGF和HIF1AN的表达,依赖于HDGF和HIF1AN 3’UTRs处的miRNA结合位点(MREs)。
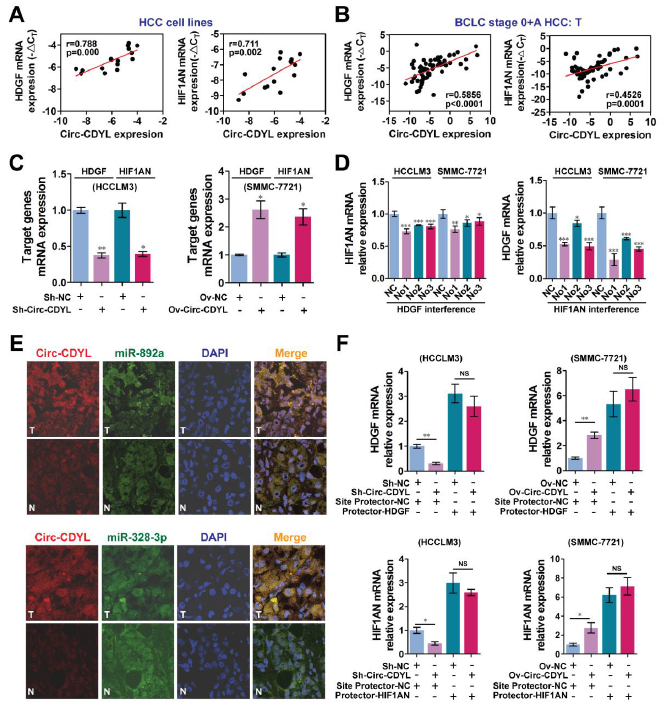
Circ-CDYL通过ceRNA网络,调控 HDGF 和HIF1AN 的表达【1】
Circ-CDYL 调控HDGF 和HIF1AN表达,分别影响到下游什么信号通路?
进一步体外和体内实验的机制研究,显示Circ-CDYL过表达,可明显上调HDGF及其受体NUCLEOLIN表达,两者的结合可活化PI3K P85和 P110,促进AKT Thr308 和Ser473位点的磷酸化,PI3K/AKT通路的活化可促进mTOR (Ser 2448)磷酸化和P70 S6K (Ser 371 和 Thr 389)磷酸化;另一方面,Circ-CDYL过表达可促进GSK3β (Ser9)磷酸化,抑制GSK3β活性,导致β-Catenin活化转录的c-myc表达增加,从而提高肿瘤的增殖能力。
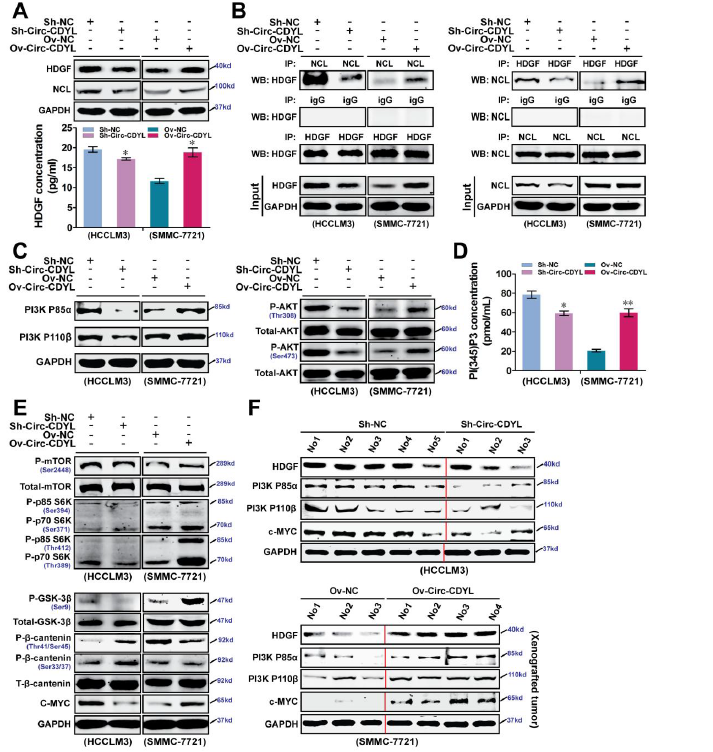
Circ-CDYL调节PI3K-AKT-mTORC1-P70 S6K 和 GSK-3β-β-catenin通路【1】
Circ-CDYL过表达,可明显上调HIF1AN表达,抑制了NOTCH2活性(HEY-1表达下调)和NOTCH2胞内区域(N2-ICD)的核易位,导致SURVIVIN转录表达明显上调,促进HCC的发生发展。无论过表达还是敲低Circ-CDYL,DLL4活化NOTCH2可明显抑制SURVIVIN的表达,进一步说明NOTCH2信号通路对于Circ-CDYL调控SURVIVIN表达的重要性。
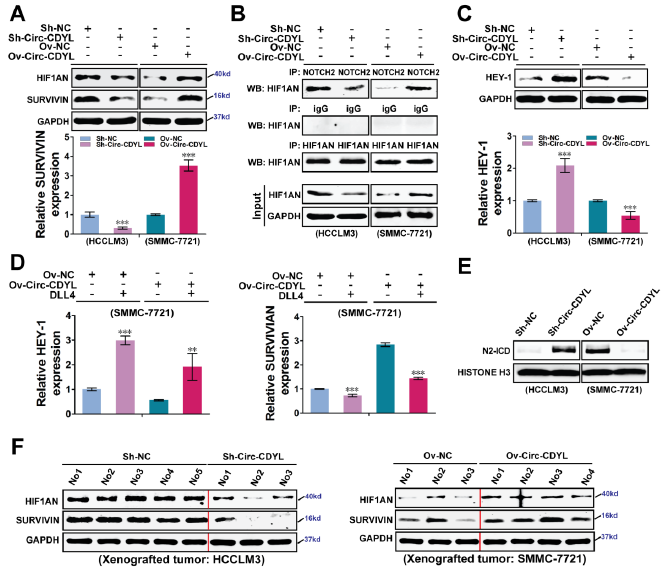
Circ-CDYL调节HIF1AN-NOTCH2-SURVIVIN通路【1】
抑制下游通路活化是否会影响Circ-CDYL的促肿瘤功能?
考虑到HDGF-NCL-PI3K-AKT和HIF1AN-NOTCH2通路对于Circ-CDYL调控HCC肿瘤发生的重要性,作者利用wortmannin和NOD分别抑制PI3K和HIF1AN的活性后,发现之前Circ-CDYL上调干细胞相关蛋白C-MYC和SURVIVIN表达的效应,可以分别被这两种抑制剂所抵消,而且两种抑制剂联用抑制两种蛋白的效果更好。如果还同时敲低Circ-CDYL表达,抑制C-MYC和SURVIVIN蛋白表达的效果达到最好,而且可明显降低EPCAM+ T-ICs 的比例,体内和体外实验均证明在敲低Circ-CDYL表达的前提下,应用两种抑制剂治疗可明显抑制肝癌细胞的增殖和生长。
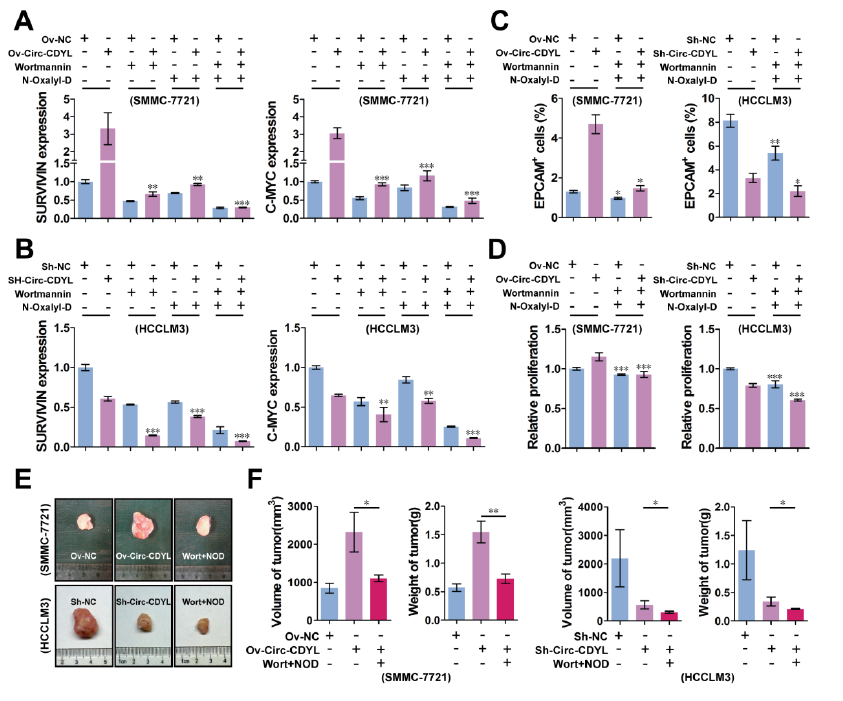
敲低Circ-CDYL表达和应用经典抑制剂对HCC生长的影响【1】
Circ-CDYL的临床意义是什么?
基于Circ-CDYL, HDGF和 HIF1AN在早期肝癌的高表达情况,ROC分析这三个分子在诊断早期肝癌中呈现不错的灵敏性和特异性,但三者联用诊断早期肝癌时效果最好,其灵敏性高达75.36%和特异性高达66.67%,但在诊断晚期肝癌时的灵敏性和特异性则大大降低。而相反的是,相比于诊断早期肝癌,AFP在诊断晚期肝癌中效果更好,其灵敏性高达50.72%和特异性83.78%。
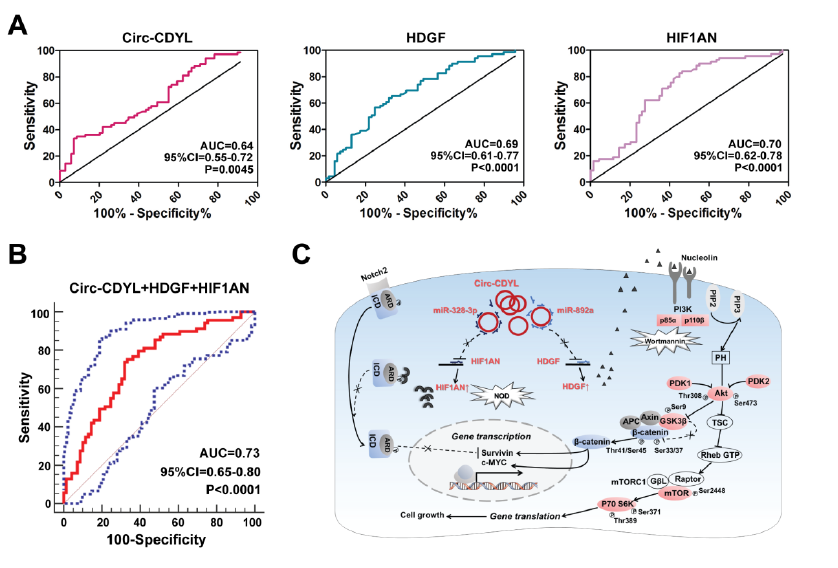
Circ-CDYL 联合 HDGF、HIF1AN分子诊断早期肝癌【1】
小结:作者对早期肝癌组织进行全面的mRNA, circRNA和microRNA表达谱分析,筛选到在早期肝癌中特异性表达上调的Circ-CDYL,经miRBase和TargetScan数据库预测,Circ-CDYL通过miR-892a and miR-328-3p介导的ceRNA调节网络,调控HDGF 和 HIF1AN mRNAs表达,体内和体外实验验证了Circ-CDYL调控 HDGF下游的NCL-PI3K-AKT和HIF1AN下游NOTCH2信号通路的活化,上调致癌蛋白c-myc和SURVIVIN表达,促进早期肝癌的发生发展。联合应用靶向PI3K 和HIF1AN分子的抑制剂wortmannin和NOD,可有效下调c-myc和SURVIVIN表达,抑制肝癌细胞的生长。结合临床样本分析,验证联合Circ-CDYL、HDGF 和 HIF1AN三个生物标志物可有效诊断早期肝癌,提高了其诊断的灵敏性和特异性。
 王红阳是中国工程院院士,第二军医大学东方肝胆外科研究所常务副所长、教授。曾任德国Max-Planck研究所生化所P.I。现任全国政协委员、第二军医大学东方肝胆外科医院信号转导研究中心主任。上海交通大学医学院癌基因及相关基因国家重点实验室主任,教授,博士生导师。长期从事肿瘤的基础与临床研究,对肿瘤信号转导有重要建树。97年学成回国创办国际合作生物信号转导研究中心和综合治疗病区,形成基础与临床结合的创新基地。在分子诊断方面,研发了新的肝癌诊断标志物及血清检测单克隆抗体,获国家专利;克隆新的肝癌相关基因4个并阐明功能;首次发现新的抑制性受体对肝癌细胞生长、凋亡的调控机制和癌基因P28在肝癌的异常信号通路,为肝癌防治提供了新的靶标;分离新的磷酸酶3种,提出新的酶分类法;发现了磷酸酶PCP-2调控β-catenin介导的肿瘤信号通路,与同行合作提出新的抑制性受体调控机制在多器官存在的新概念。在Gastroenterology、Nature、Hepatology和Oncogene等发表论文75篇,影响因子190分,SCI引用527次;申报专利9项(国际1项),授权4项。获何梁何利科技进步奖、军队科技进步一等奖和上海医学科技一等奖。
王红阳是中国工程院院士,第二军医大学东方肝胆外科研究所常务副所长、教授。曾任德国Max-Planck研究所生化所P.I。现任全国政协委员、第二军医大学东方肝胆外科医院信号转导研究中心主任。上海交通大学医学院癌基因及相关基因国家重点实验室主任,教授,博士生导师。长期从事肿瘤的基础与临床研究,对肿瘤信号转导有重要建树。97年学成回国创办国际合作生物信号转导研究中心和综合治疗病区,形成基础与临床结合的创新基地。在分子诊断方面,研发了新的肝癌诊断标志物及血清检测单克隆抗体,获国家专利;克隆新的肝癌相关基因4个并阐明功能;首次发现新的抑制性受体对肝癌细胞生长、凋亡的调控机制和癌基因P28在肝癌的异常信号通路,为肝癌防治提供了新的靶标;分离新的磷酸酶3种,提出新的酶分类法;发现了磷酸酶PCP-2调控β-catenin介导的肿瘤信号通路,与同行合作提出新的抑制性受体调控机制在多器官存在的新概念。在Gastroenterology、Nature、Hepatology和Oncogene等发表论文75篇,影响因子190分,SCI引用527次;申报专利9项(国际1项),授权4项。获何梁何利科技进步奖、军队科技进步一等奖和上海医学科技一等奖。
(信息来源:https://js.ifeng.com/a/20170302/5429312_0.shtml)
参考文献
- Wei Y, Chen X, Liang C, et al. A Noncoding Regulatory RNAs Network Driven by Circ-CDYL Acts Specifically in the Early Stages Hepatocellular Carcinoma. Hepatology. 2019 May 30. doi: 10.1002/hep.30795.
- Tay Y, Kats L, Salmena L, Weiss D, Tan SM, Ala U, et al. Coding-independent regulation of the tumor suppressor PTEN by competing endogenous mRNAs. Cell. 2011;147(2):344-57.
.png)
