图片摘要:circMET通过miR-30-5p / snail / DPP4轴驱动肝癌的免疫逃逸和抗PD1治疗耐药性
2020年5月19日,复旦大学中山医院的柯爱武、施国明和周俭教授为共通讯作者在Molecular Cancer(IF=10.679)杂志上发表了一篇题为“Circular RNA circMET drives immunosuppression and anti-PD1 therapy resistance in hepatocellular carcinoma via the miR-30-5p/snail/DPP4 axis”的文章,阐述了肝细胞癌中高表达的circMET,通过miR-30-5p / snail / DPP4轴降解CXCL10来诱导癌细胞的免疫抑制。并发现DPP4的抑制剂西格列汀可以提高PD1阻断免疫疗法的疗效([1])。

肝细胞癌(HCC)是最常见的肝恶性肿瘤,预后较差。迄今为止,治愈肝癌的唯一方法是手术切除或肝移植,但是大多数患者被诊断时即为晚期肝癌,不适合手术。此外,肿瘤通常会在术后复发,术后5年生存率很低。因此,迫切需要更深入地了解其作用机制并研发出新的治疗药物。染色体7q21-7q31的扩增与肿瘤的复发和多药耐药性有关,该区域的几个基因在HCC发生过程中具有驱动基因的功能。作者旨在研究该区域中调节HCC起始和发育的关键环状RNA(circRNA)。
circMET在HCC中高表达,并可以作为OS和术后复发的独立预测分子
作者推测chr.7q21-7q31来源的circRNA可能作为肝癌的原癌基因或抑癌基因。为了验证这一假设,使用qRT-PCR方法检测来自chr.7q21-7q31的43种circRNA在四对肝癌组织和癌旁组织中的表达差异。在这些circRNA中,与癌旁组织相比,circMET(hsa_circ_0082002,长度为1214个bp的环状RNA)的表达在HCC组织中最显著且持续上调。
为了阐明circMET在HCC患者中的临床意义,作者使用qRT-PCR检测circMET在90对HCC样本和匹配的癌旁组织中的表达差异,在由209个HCC组织组成的TMA中进行原位杂交。与癌旁组织相比,circMET的表达在肿瘤组织中显着增加,并且它主要位于细胞质中。此外,circMET过表达与微血管浸润、肿瘤包膜缺失、多瘤和晚期肝癌显著相关。
circMET的表达还与总生存期(OS)和累积复发率相关。circMET低表达组的2年和5年总生存率明显高于circMET高表达组,同样,circMET低表达组的2年和5年累积复发率明显低于circMET高表达组。多因素分析证实了circMET可以作为OS和术后复发的独立预测分子。此外,circMET和c-Met的表达有一定的相关性。综上所述,这些结果表明circMET的高表达可能在HCC的进展中起作用。
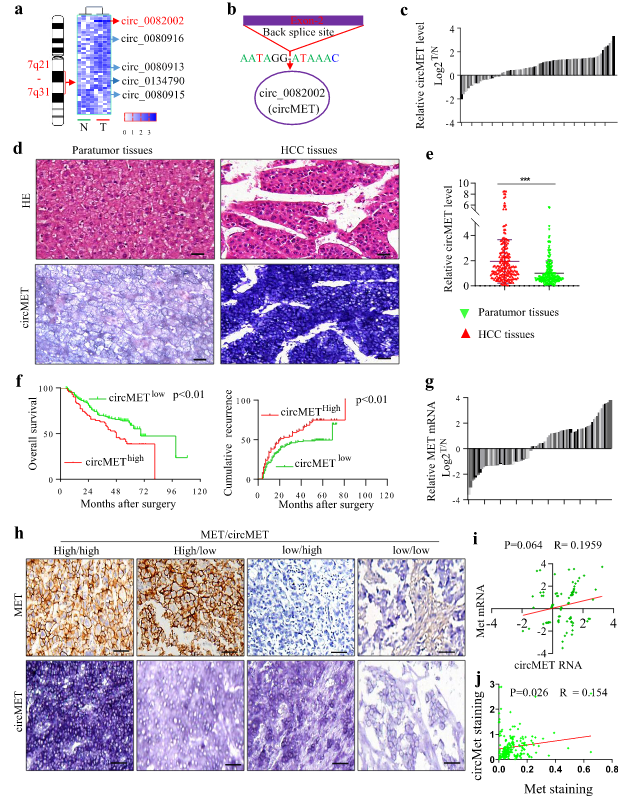
图1 circMET在HCC中高表达,并可以作为OS和术后复发的独立预测分子
circMET促进肝癌细胞的侵袭和转移
为了更好地了解circMET在肝癌发生发展中的生物学功能,作者使用qRT-PCR方法检测circMET在HCCLM3、HuH7、Hep3B和HepG2细胞中的表达水平。高转移性的HCCLM3细胞中,circMET的表达最高,而低转移性的HepG2细胞中,circMET的表达最低。之后,作者构建了circMET过表达和敲低的慢病毒质粒用于下一步实验。Transwell实验显示,circMET的过表达/敲低会导致肝癌细胞侵袭能力的增强/降低。划痕实验显示circMET的过表达/敲低会导致肝癌细胞伤口愈合加快/延迟。在克隆形成实验中,异位表达circMET促进集落形成,而抑制circMET表达会减少集落形成。在细胞增殖和细胞周期分析中,circMET的表达对肝癌细胞增殖和细胞周期没有明显的影响。综上所述,这些结果表明circMET是HCC的正性调节因子。
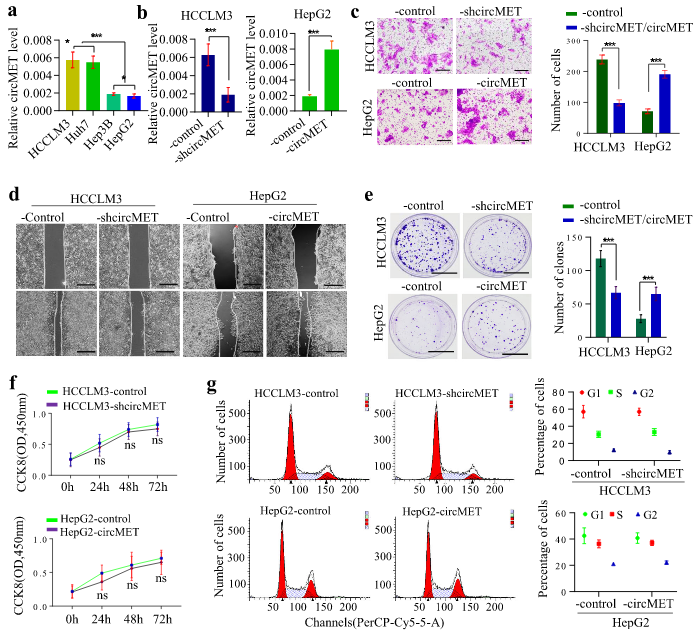
图2 circMET会促进HCC的进展
circMET的高表达诱导上皮向间充质转化(EMT)并增强肿瘤微环境的免疫抑制性
为了研究circMET促进肝癌转移的机制,作者使用RNA-seq技术检测转染circMET的HepG2细胞和HepG2对照细胞的基因表达差异,发现364种上调的基因和225种下调的基因。GO和KEGG分析表明,差异表达的基因在肿瘤通路、趋化因子信号通路、TNF信号通路、PI3K-Akt信号通路、细胞黏附、血管生成、细胞趋化、炎症反应、趋化和蛋白水解等途径中显著富集。
接下来,为了进一步确定circMET在EMT和肿瘤免疫反应中的作用。作者分析了表达不同水平circMET的HCC细胞形态。低表达circMET的肝癌细胞表现出正常上皮细胞的典型鹅卵石样外观,而高表达circMET的肝癌细胞表现出纺锤状的成纤维细胞形态,未发现两组MET相关的mRNA有表达差异。此外,高表达circMET的肝癌细胞表现出上皮标记基因E-钙粘蛋白的下调、转录因子Snail、间充质基因纤连蛋白1(Fn 1)和波形蛋白的上调,低表达circMET的肝癌细胞与之相反。
为了确定circMET在肿瘤免疫应答中的作用,建立转染circMET的Hep1–6细胞和Hep1–6对照细胞,并将这些细胞皮下植入C57BL / 6小鼠中。植入Hep1–6-circMET细胞的小鼠荷瘤比植入Hep1–6对照细胞的小鼠更大。然后,使用液体蛋白芯片(LiquiChip)检测两组小鼠的血清细胞因子表达谱,其中CXCL10、CXCL16、CCL11、IL17、瘦素、CCL9、CCL17、Timp-1和TNFRSF1B的表达存在显着差异,之后通过ELISA进行验证。
重要的是,体内实验表明,在对照组小鼠的肿瘤细胞中,肿瘤浸润的CD8+淋巴细胞密度明显高于过表达circMET的肿瘤细胞。此外,临床数据表明,circMET的高水平与肝癌组织中肿瘤浸润性CD8+淋巴细胞的低密度相关,而它的低密度预示着HCC患者的预后不良。因此,作者提出circMET通过诱导细胞EMT并增强肿瘤微环境的免疫抑制性来促进HCC的发展。
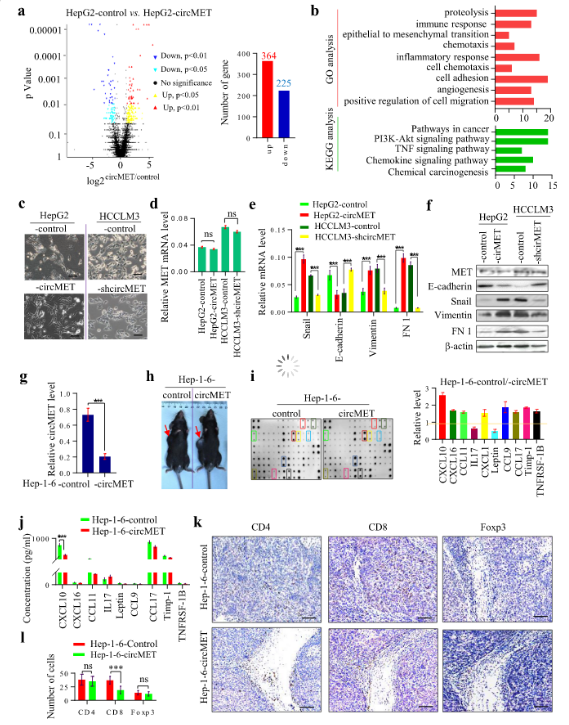
图3 circMET通过诱导细胞EMT并增强肿瘤微环境的免疫抑制性来促进HCC的发展
circMET作为miR-30-5p家族的分子海绵来促进HCC的发展
考虑到circRNA具有充当miRNA海绵的分子机制,作者评估circMET是否可以作为某些miRNA的海绵来影响HCC的发展。为此,使用StarBase v3.0预测了385种候选的miRNA分子,再通过circRIP+qRT-PCR实验进行验证,结果显示,circMET可以特异性富集miR-30-5p(miR-30a-5p、miR-30b-5p、miR-30c-5p、miR-30d-5p和miR-30e-5p)。
为了进一步验证miR-30-5p和circMET的直接作用,采用RNA pull-down和双萤光素酶报告基因实验,均表明miR-30-5p和circMET存在直接的相互作用。此外,在HCCLM3和Huh7细胞中进行FISH,表明circMET与miR-30a-5p在细胞质中共定位。体外的transwell实验表示,在高表达circMET的HCC细胞中敲低miR-30a / e-5p会导致侵袭能力增强。因此,circMET可以作为miR-30-5p的分子海绵来促进HCC的发展。
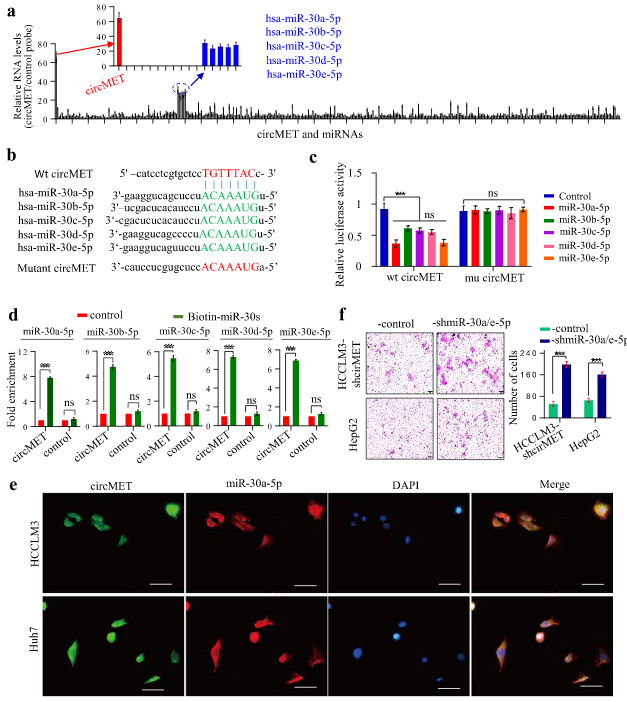
图4 circMET作为miR-30-5p的分子海绵来执行功能
circMET通过miR-30-5p / snail / DPP4轴诱导HCC的免疫抑制
为了确定miR-30-5p促进肝癌进展的下游机制,将RNA-seq的结果进行分析,作者推测Snail可能是人类miR-30-5p的靶标。下一步预测了Snail中可能与miR-30a-5p结合的位点。双萤光素酶报告基因分析证实Snail确实是通过该位点与miR-30a-5p相互作用。为了进一步阐明miR-30-5p在circMET诱导信号转导中的作用,构建过表达/敲低miR-30-5p和circMET的慢病毒质粒分别转导至HCCLM3和HepG2细胞中来检测Snail表达,结果表明circMET过表达和miR-30a-5p敲低会促进Snail的表达,而circMET敲低和miR-30a-5p过表达会抑制Snail的表达。这些结果表明Snail是miR-30-5p的靶标,circMET可能通过miR-30-5p/Snail轴促进肝癌的进展。
之前的数据表明,circMET在EMT和免疫抑制方面起着重要的调控作用,但具体机制尚不清楚。考虑到Snail是一种转录因子,作者进行了CHIP-seq,来确定HepG2-circMET细胞中Snail结合位点的谱系,在9470种基因中共鉴定出42,479个高置信度的Snail结合位点。在基因启动子区域(距转录起始区1kb以内、1-2kb和2-3kb)发现了2.22、2.17和1.94%的结合位点,34%的结合位点位于基因内含子区域,56.72%的结合位点位于远端的基因间隔区。
将含有Snail结合位点的9470种基因和,HepG2-circMET细胞与HepG2对照细胞差异表达的589种基因取交集,获得189种基因。通过GO分析,发现仅仅有27种基因与免疫相关并且可以被Snail调控。结合这些基因在更大的肝癌样本队列中的表达数据,这些数据来自癌症基因组图谱(TCGA)和RNA测序数据。作者通过排除COL1A1、COLEC11、CXCL12和MBL2进一步缩小了Snail调控基因的范围,发现DPP4、PDGFB1和CSPP1可能是参与Snail介导免疫抑制的候选基因。使用双萤光素酶报告基因实验发现Snail通过与DPP4的增强子元件相互作用而显著上调DPP4的表达,而另外两个基因没有受到Snail的直接或轻微调控。此外,还确定了Snail与DPP4之间的正相关,以及Snail与HCC组织中CD8+ T细胞之间的负相关。因此,作者得出结论,circMET过表达通过miR-30-5p / Snail / DPP4轴诱导HCC的免疫抑制。
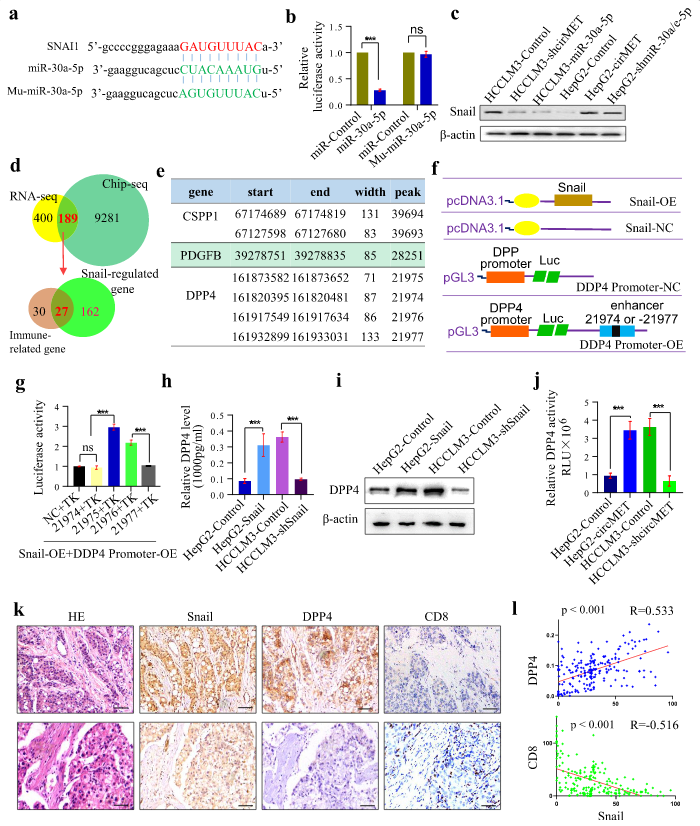
图5 circMET通过miR-30-5p / Snail / DPP4轴诱导HCC的免疫抑制
miR-30-5p / snail / DPP4轴通过降解CXCL10诱导免疫抑制
有研究报道DPP4可以阻断趋化因子或其它免疫分子,因此,作者寻找DPP4的下游底物,并使用DPP4抑制剂西格列汀来探索miR-30-5p / Snail / DPP4轴在肝癌进展中的机制。在Hep1-6细胞中,circMET、Snail过表达或miR-30-5p敲低均可上调DPP4的表达。植入Hep1-6-circMET、−Snail和-shmiR-30a/e-5p细胞的小鼠肿瘤体积明显大于对照组。
液相芯片分析显示,植入Hep1-6-circMET、−Snail和-shmiR-30a/e-5p细胞的小鼠血清中CXCL10(MCXCL10)水平明显降低,ELISA进一步证实了这一结果。趋化指数表明CXCL10在CD8 +淋巴细胞转运中起重要作用。接下来发现DPP4抑制剂西格列汀增加了CD8+淋巴细胞转运。因此,得出结论circMET通过miR-30-5p/Snail/DPP4/CXCL10轴下调CD8+淋巴细胞转运来抑制免疫应答过程。
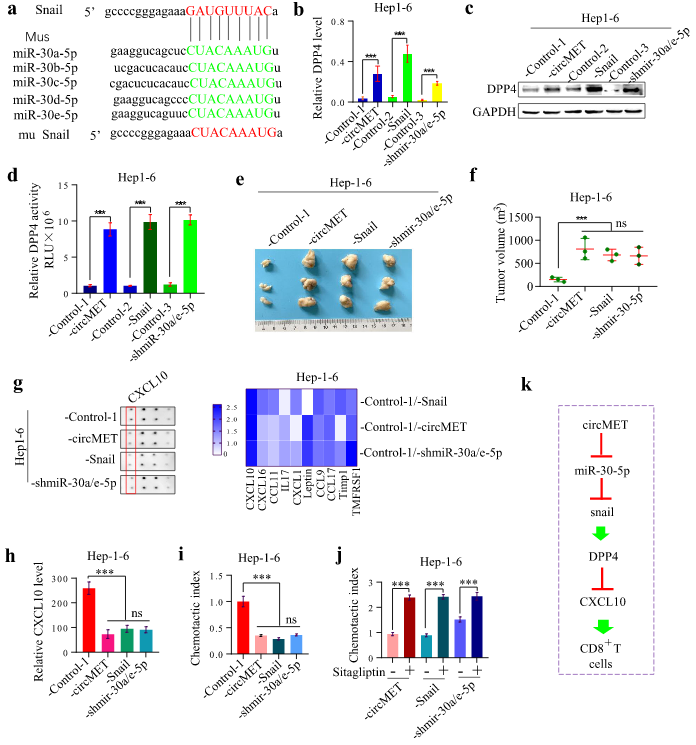
图6 miR-30-5p/Snail/DPP4轴通过降解CXCL10诱导免疫抑制
西格列汀可以改善部分肝癌患者的抗PD1免疫治疗反应
DPP4属于一个由6个多向丝氨酸蛋白酶组成的家族,它们可以在蛋白和肽的N端裂解两个氨基酸。第一种口服胰岛素增强剂,西格列汀,一种选择性的DPP4抑制剂,已被证实用于糖尿病的治疗。抗PD1阻断免疫疗法和其它疗法的联合应用已被证实可以改善肿瘤特异性T细胞免疫应答的疗效和持续时间。基于上述与西格列汀相关的数据,作者预测西格列汀在HCC的临床应用中可以增强淋巴细胞的转运,改善肿瘤对PD1阻滞的反应性。作者研究了西格列汀和PD1抑制剂在Hep1-6-circMET和Hep1-6-Snai肿瘤模型中的联合治疗作用。结果表明西格列汀或PD1单抗会导致肿瘤生长延迟,重要的是,西格列汀+抗PD1治疗组的肿瘤抑制率为100%。
在西格列汀处理的小鼠肿瘤中CD8+T细胞数量明显增加,西格列汀和抗PD1抗体联合西格列汀均对小鼠血清中DPP4活性有抑制作用。作者进行了一项回顾性队列研究,以确定西格列汀是否能增强肿瘤中CD8+T淋巴细胞的转运。这项研究包括8名在2018年1月至2019年7月期间接受西格列汀治疗的肝癌患者,以及32名未接受西格列汀治疗的肝癌患者(1:4匹配)作为对照组。结果表明,接受西格列汀治疗的肝癌组织CD8+T细胞浸润较高,而未接受西格列汀治疗的肝癌组织CD8+T细胞浸润明显较低。提示西格列汀有促进淋巴细胞转运的作用。因此,得出结论,circMET/miR-30-5p/Snail/DPP4轴参与了肝癌的免疫抑制,并且西格列汀可以提高PD1阻断免疫疗法的疗效。
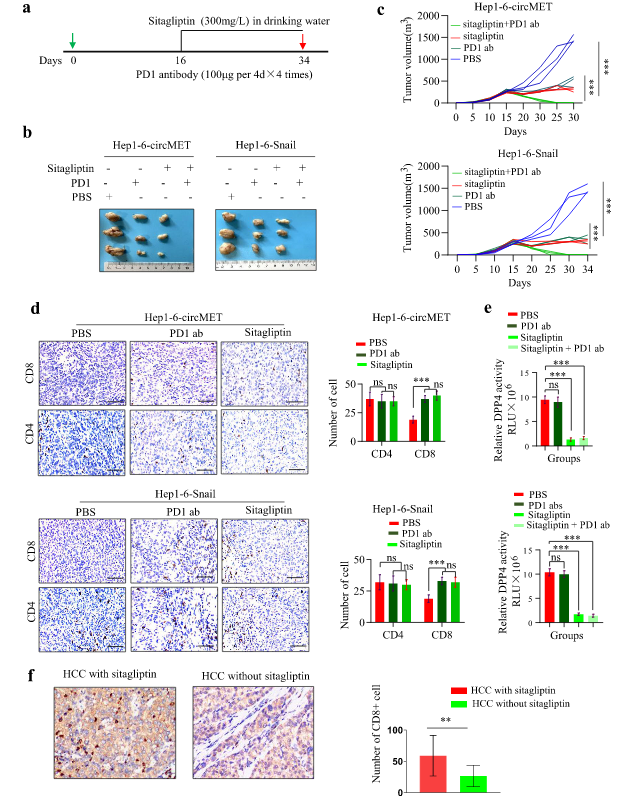
图7 西格列汀可以改善部分肝癌患者的抗PD1免疫治疗反应
参考文献
[1] Huang XY, Zhang PF, Wei CY, et al. Circular RNA circMET drives immunosuppression and anti-PD1 therapy resistance in hepatocellular carcinoma via the miR-30-5p/snail/DPP4 axis. Mol Cancer. 2020;19(1):92. Published 2020 May 19. doi:10.1186/s12943-020-01213-6
.png)