这些年的研究证实了circRNAs主要有以下几种功能:①充当miRNA海绵,竞争性结合miRNA;②作为蛋白质的海绵,竞争性结合蛋白;③参与蛋白翻译;④体内反转录后融合至基因组,形成假基因⑤定位于核内的circRNA参与调控基因的转录和RNA剪切过程
对于circRNA充当miRNA海绵的研究思路,主要分为两种。第一种,从测序数据或者已有研究报道中获取到与疾病相关的表达上调或者下调的circRNA,接着数据库预测并验证靶向sponge的miRNA及其下游基因,从而影响疾病的发展;第二种,从已有的miRNA和相关的信号通路(如EMT或者mTOR等)调控疾病发展出发,再通过数据库预测并筛选海绵这种miRNA的circRNAs,最后将这种circRNA和肿瘤联系起来。
这次我们将介绍circRNA充当蛋白质海绵的研究,文章show的数据虽然非常简单,但是提供了一个circRNA充当蛋白质海绵,并影响其下游基因表达的很好的例子。

多形性胶质母细胞瘤(GBM)是最致命的脑部肿瘤,患者被确诊后的总体存活率中值是14.6个月,而且大多数患者的预后非常差。尽管许多研究报道了在GBM中涉及circRNA和剪接,但是许多问题仍然没有解决。作者之前的研究【2】已经证实了,circSMARCA5可以通过影响富含丝氨酸和精氨酸的剪接因子1(SRSF1)的表达和功能, 进而调节GBM细胞迁移能力。SRSF1是一种富含丝氨酸和精氨酸的剪接因子1,已被报道在GBM中表达上调,正调控GBM细胞的迁移能力。除了参与剪接之外,SRSF1还具有其他的功能如下:(i)调节RNA代谢; (ii)调节mRNA翻译; (iii)调控miRNA加工;(iv)参与蛋白质SUMO化; (v)与应激反应有关。作者证明了GBM细胞中circSMARCA5与SRSF1之间的物理的相互结合作用,从而导致了临床相关血管内皮生长因子A(VEGFA)前mRNA的剪接产生的促血管生成亚型和抗血管生成亚型比例的变化,影响了GBM的发展。
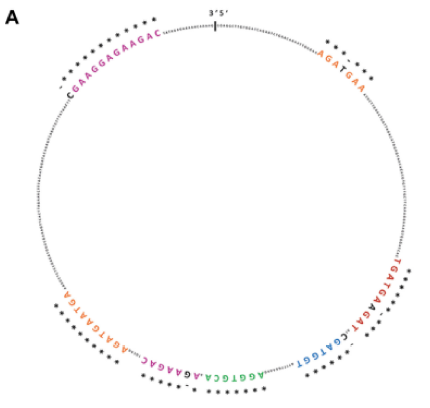
1. 基于作者前期的研究结果,经RBPMap数据库预测,CircSMARCA5至少含有七个不同的进化保守的SRSF1结合位点。SRSF1的RIP实验证明了CircSMARCA5 和 SRSF1的相互结合作用(SRSF3 mRNA是阳性对照)。
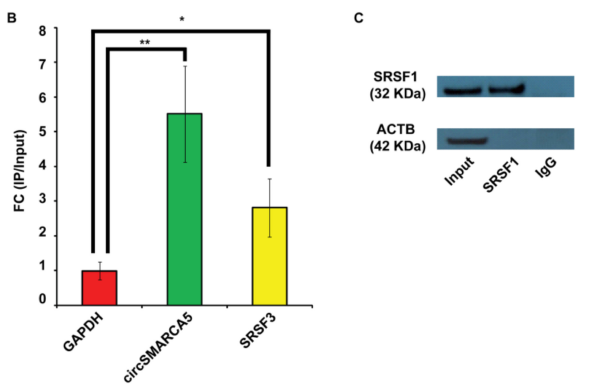
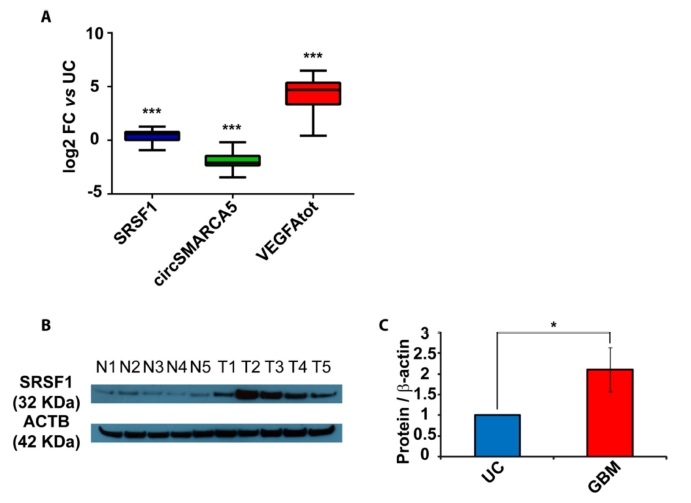
2. 相比于正常的脑实质,GBM组织中的SRSF1 mRNA和蛋白水平明显上调;由于SRSF1作为一个剪接因子,具有很多剪接靶基因,而作者主要聚焦在临床上与GBM相关程度较高的VEGFA分子。进一步检测发现,GBM组织中VEGFA mRNA水平出现明显的上调,而circSMARCA5的表达水平则出现明显下调。经过REMBRANDT和TCGA数据库分析证实,在GBM样本中SRSF1与VEGFA mRNA表达水平均出现上调,并呈现表达正相关的关系。
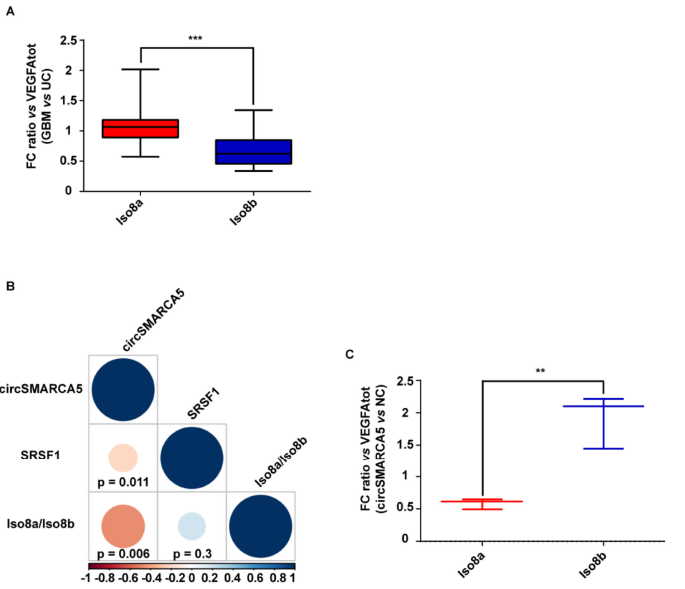
3. 为了明确circSMARCA5对于VEGFA mRNA剪切的影响,作者通过RT-qPCR检测了总的VEGFA mRNA,促血管生成和抗血管生成的VEGFA mRNA亚型(Iso8a和Iso8b)的表达水平。在GBM组织中,Iso8a/Iso8b表达水平的比例明显上调;而且circSMARCA5表达水平与SRSF1的表达、Iso8a/Iso8b表达的比例呈负相关的关系。在U87-MG细胞中过表达circSMARCA5后,Iso8a/Iso8b表达比例明显降低。
4. IHC染色结果证明了相比于正常的脑组织,GBM组织中的微血管密度(MVD)明显增高,经统计分析,发现MVD水平与组织中SRSF1 mRNA和Iso8a/Iso8b比例呈正相关,而与circSMARCA5的表达成负相关。 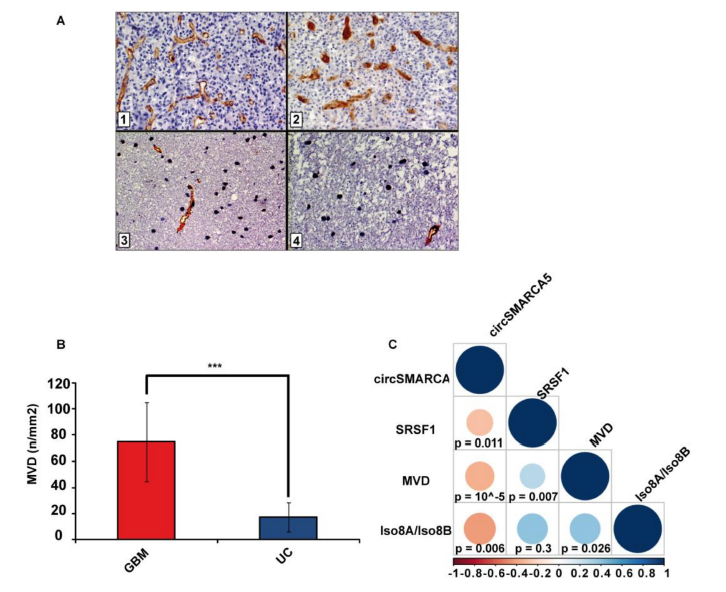
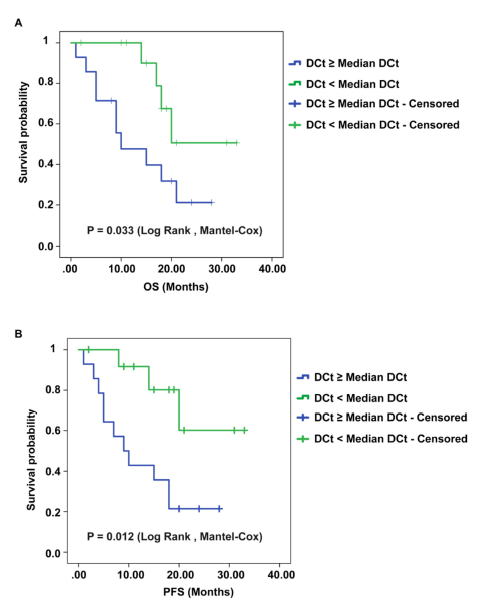
5. 作者对GBM患者的总体存活率OS和无进展生存期PFS指标进行分析,发现GBM患者的circSMARCA5表达水平越低,其OS和PFS则越短。Kaplan–Meier分析TCGA样本数据则证明了SRSF1表达水平与GBM患者的OS成负相关(补充数据)。
总的来说,这篇文章偏向对临床GBM组织和患者进展、预后的统计分析。作者对临床GBM样本中的circSMARCA5、SRSF1、总VEGFA mRNA,促血管生成和抗血管生成的VEGFA mRNA亚型(Iso8a和Iso8b)和MVD的水平及其之间关系,进行了大致的描述,只有circSMARCA5的表达水平出现明显下调,与GBM进展成负相关,而其他指标分子均是出现明显上调,则与GBM进展成正相关。缺点在于缺乏进一步的具体的分子机制的探究,和相关体内实验数据的支持。但还是提供了circSMARCA5分子对于GBM疾病发展具有一定影响的思路,以便后续研究人员对GBM的研究。
参考文献
1. Barbagallo D, Caponnetto A, Brex D, et al. CircSMARCA5 Regulates VEGFA mRNA Splicing and Angiogenesis in Glioblastoma Multiforme Through the Binding of SRSF1. Cancers (Basel). 2019 Feb 7;11(2). pii: E194. doi: 10.3390/cancers11020194.
2. Barbagallo, D, Caponnetto, A, Cirnigliaro, M., et al. CircSMARCA5 Inhibits Migration of GlioblastomaMultiforme Cells by Regulating a Molecular Axis Involving Splicing Factors SRSF1/SRSF3/PTB. Int. J.Mol. Sci. 2018, 19, 480.
.png)
