9月30日, Nature子刊Cell Death & Differentiation在线发表了一篇circRNA的研究文章,报道发现口腔鳞状细胞癌中circUHRF1显著高表达且具有促癌作用[1]。文章的通讯作者是天津医科大学口腔医学院的武杰,Zihao Liu和首都医科大学北京朝阳医院的王左敏。

文章作者通过挑选一些circRNA分子直接进行QPCR验证的方式筛选发现了circUHRF1口腔鳞状细胞癌(OSCC)细胞系中高表达。机制方面,作者发现circUHRF1通过竞争性结合miR-526b-5p正调控c-Myc,c-Myc可促进TGF-β1和ESRP1的表达,ESRP1可以通过结合circUHRF1的侧翼内含子,促进circUHRF1的生成,最终形成一个正反馈的调控环路。
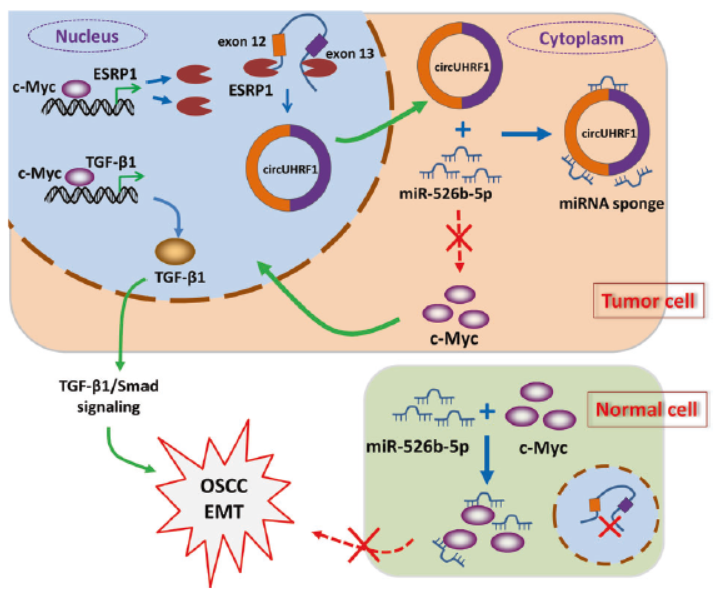
图1 OSCC中circUHRF1作用机制示意图 ([1])
circUHRF1在口腔鳞状细胞癌中表达显著升高
作者通过检索circBase数据库筛选了一批候选circRNA,然后通过QPCR的方法验证它们在OSCC细胞系中的表达情况,从中发现了circUHRF1。circUHRF1由UHRF1基因的12-13外显子构成,QPCR结果显示circUHRF1在OSCC细胞系中显著升高,临床标本检测结果表明高表达circUHRF1的患者预后更差。Sanger测序验证了接口位置的序列,Actinomycin D处理表明circUHRF1比UHRF1的mRNA表达更稳定,RNase R消化处理表明circUHRF1是环形RNA分子。FISH实验表明circUHRF1主要定位于细胞质中。
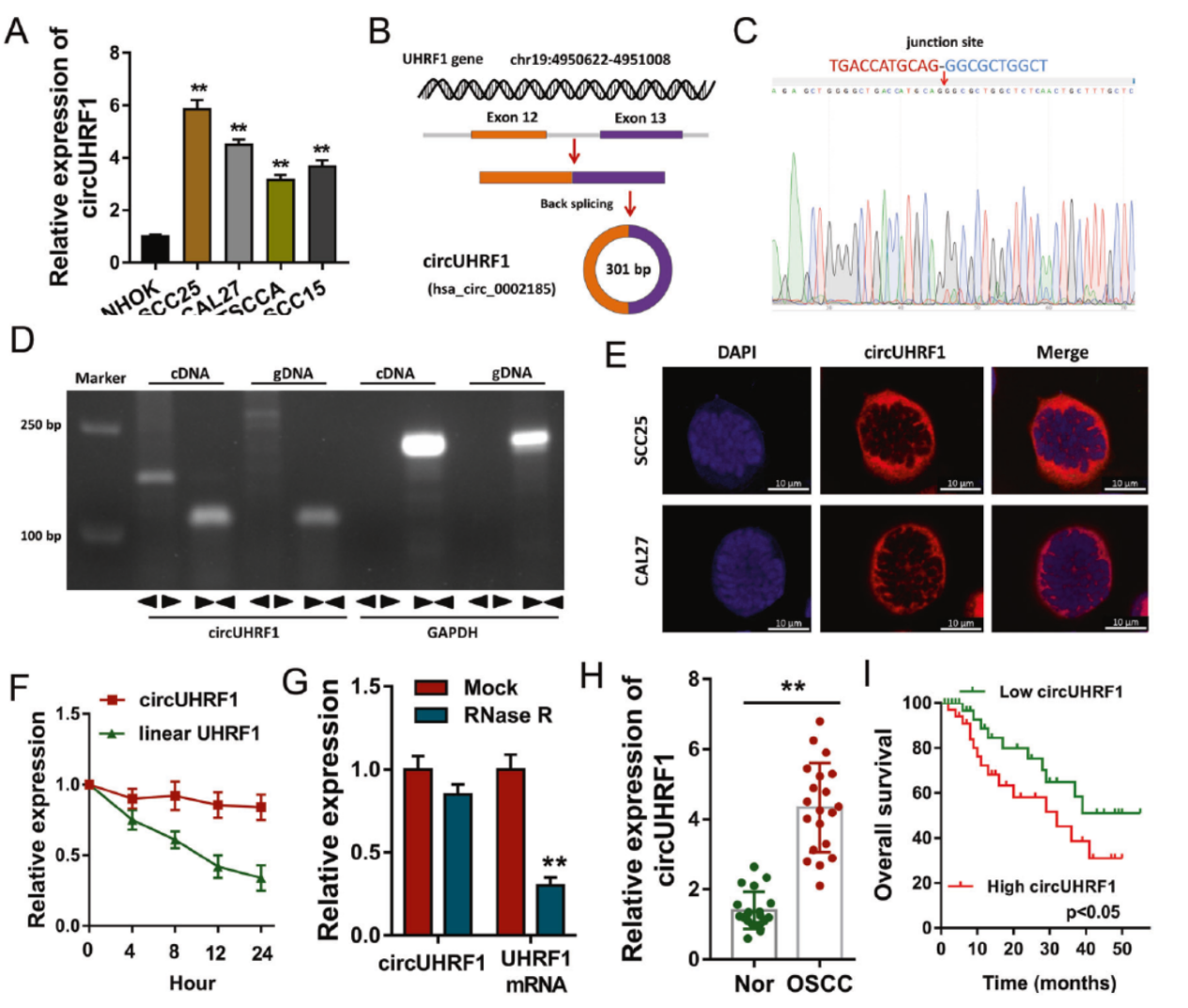
图2 circUHRF1在OSCC中高表达 ([1])
OSCC细胞中干扰circUHRF1抑制细胞增殖侵袭和EMT
功能实验表明,OSCC细胞中干扰circUHRF1可显著抑制细胞增殖,迁移侵袭,也可抑制EMT过程。
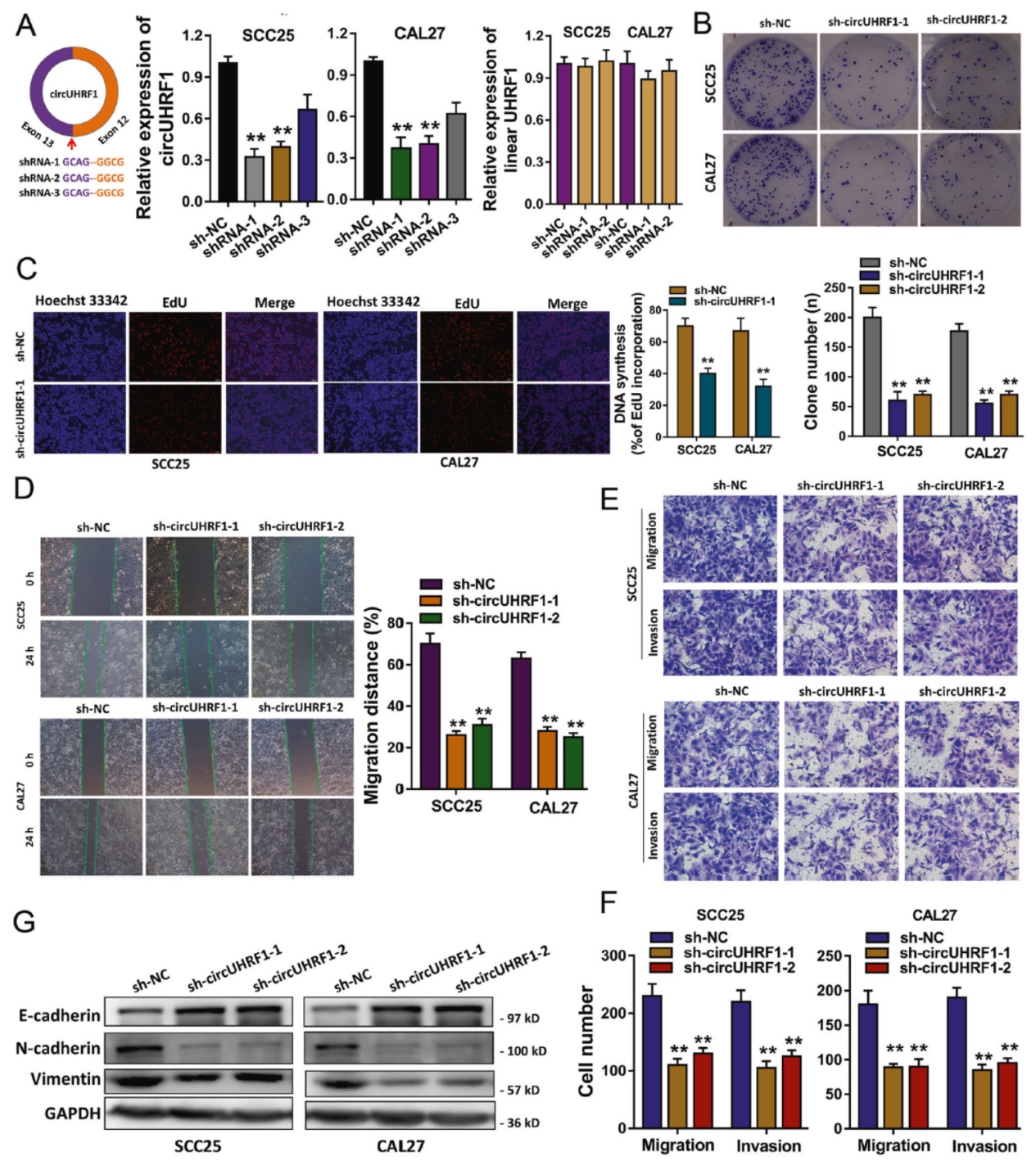
图3 OSCC中干扰circUHRF1抑制细胞增殖侵袭和EMT ([1])
circUHRF1竞争性结合miR-526b-5p
通过CircInteractome工具预测,作者发现了circUHRF1有可能与miR-526b-5p结合。Luciferase报告基因实验,RNA pull-down实验表明了circUHRF1可以竞争性结合miR-526b-5p。FISH共定位实验进一步确认了两者的相互作用。QPCR显示干扰circUHRF1可促进miR-526b-5p的表达丰度升高。
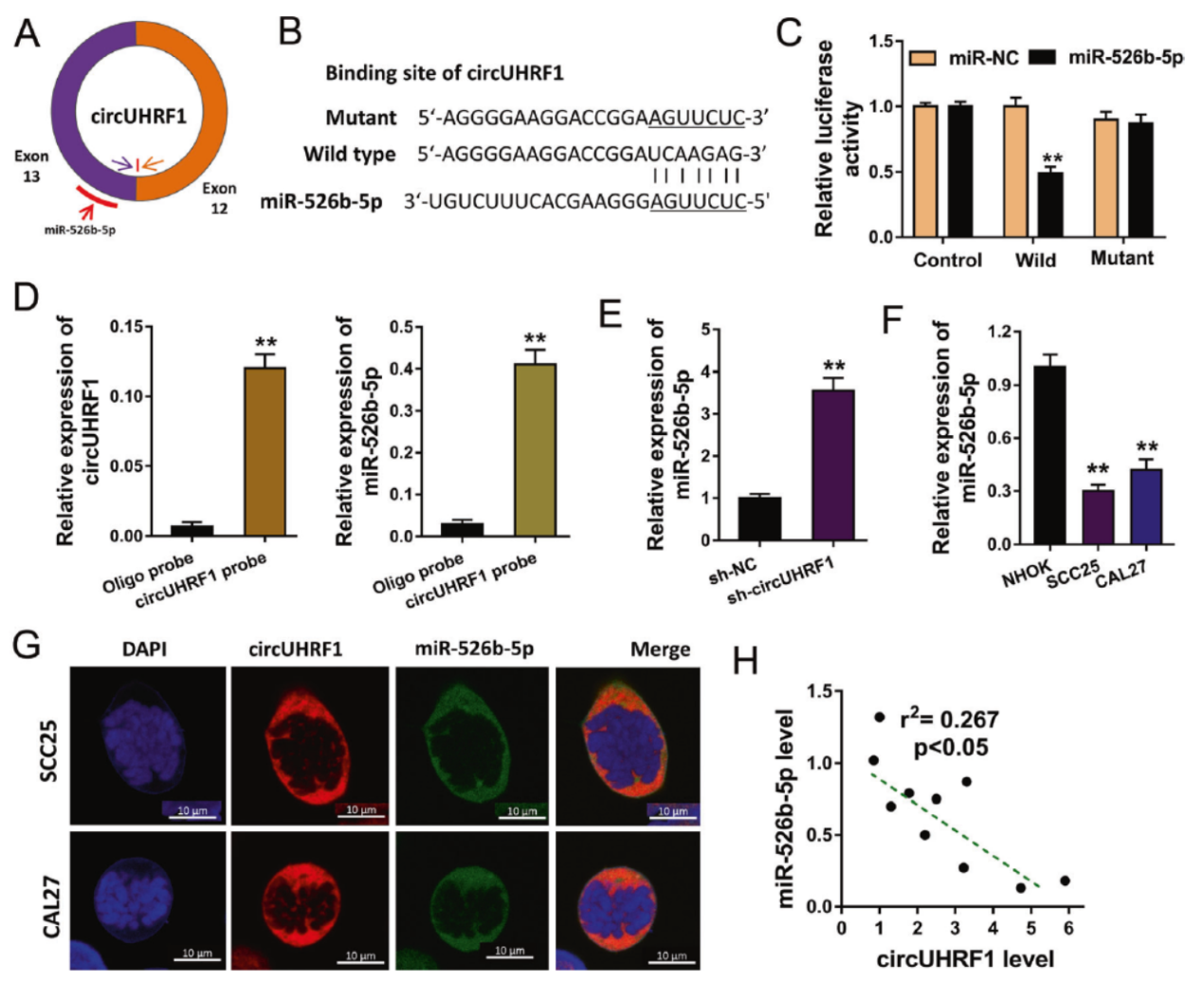
图4 circUHRF1竞争性结合miR-526b-5p ([1])
c-Myc是circUHRF1/miR-526b-5p调控的下游基因
序列分析显示c-Myc基因的3’-UTR存在miR-526b-5p的结合位点,构建Luciferase报告基因后显示,干扰circUHRF1后能显著抑制报告基因的表达,但相关序列突变后就不再有这一变化。Western实验也证明干扰circUHRF1后c-Myc的表达丰度会下调。
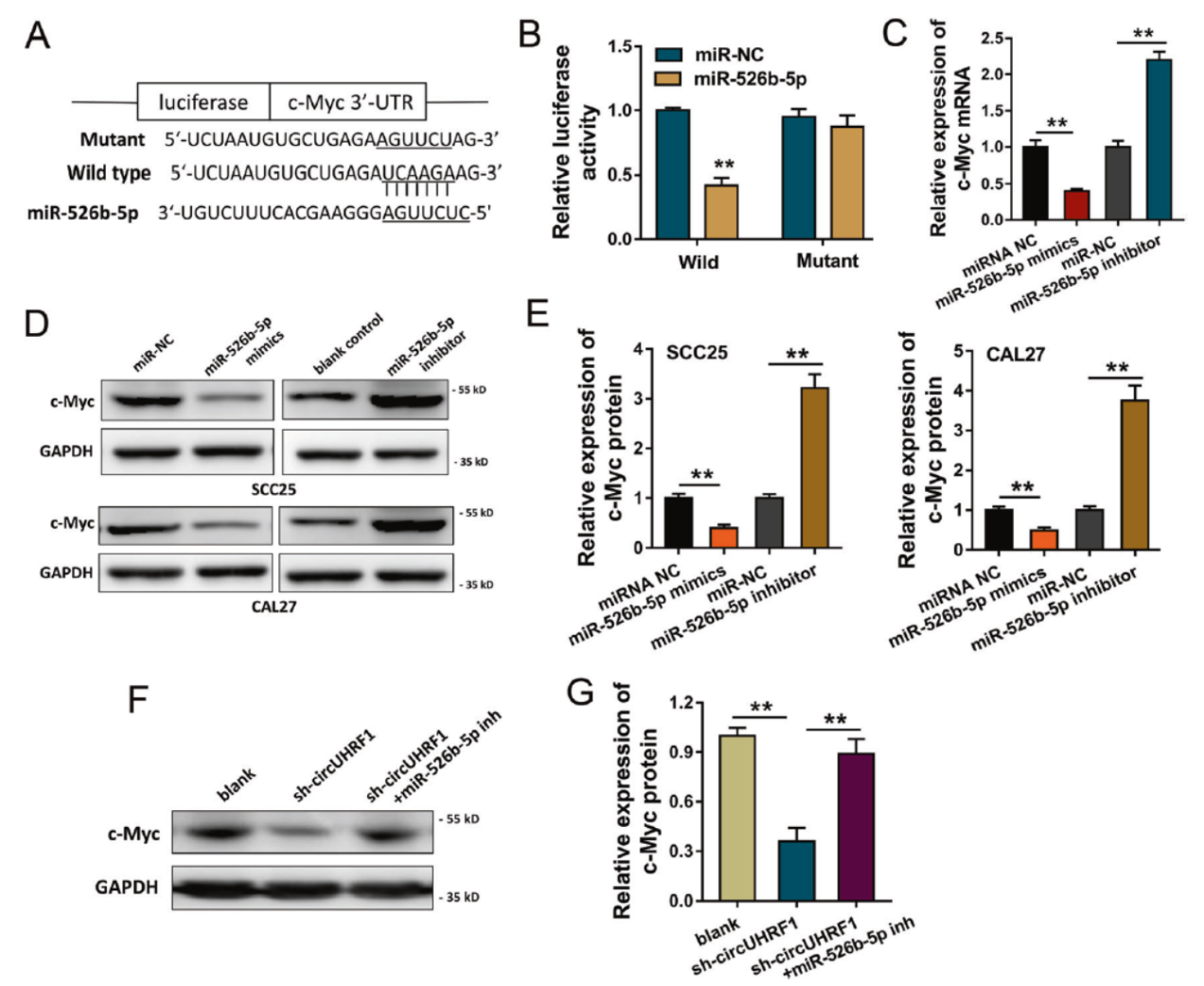
图5 c-Myc是circUHRF1/miR-526b-5p调控的下游基因 ([1])
c-Myc调控TGF-β1和ESRP1的转录表达
预测分析结果显示TGF-β1和ESRP1基因的启动子区均存在c-Myc的结合位点(由JASPAR和RegRNA工具预测完成)。ChIP-PCR和Luciferas报告基因实验验证了所预测的结果。
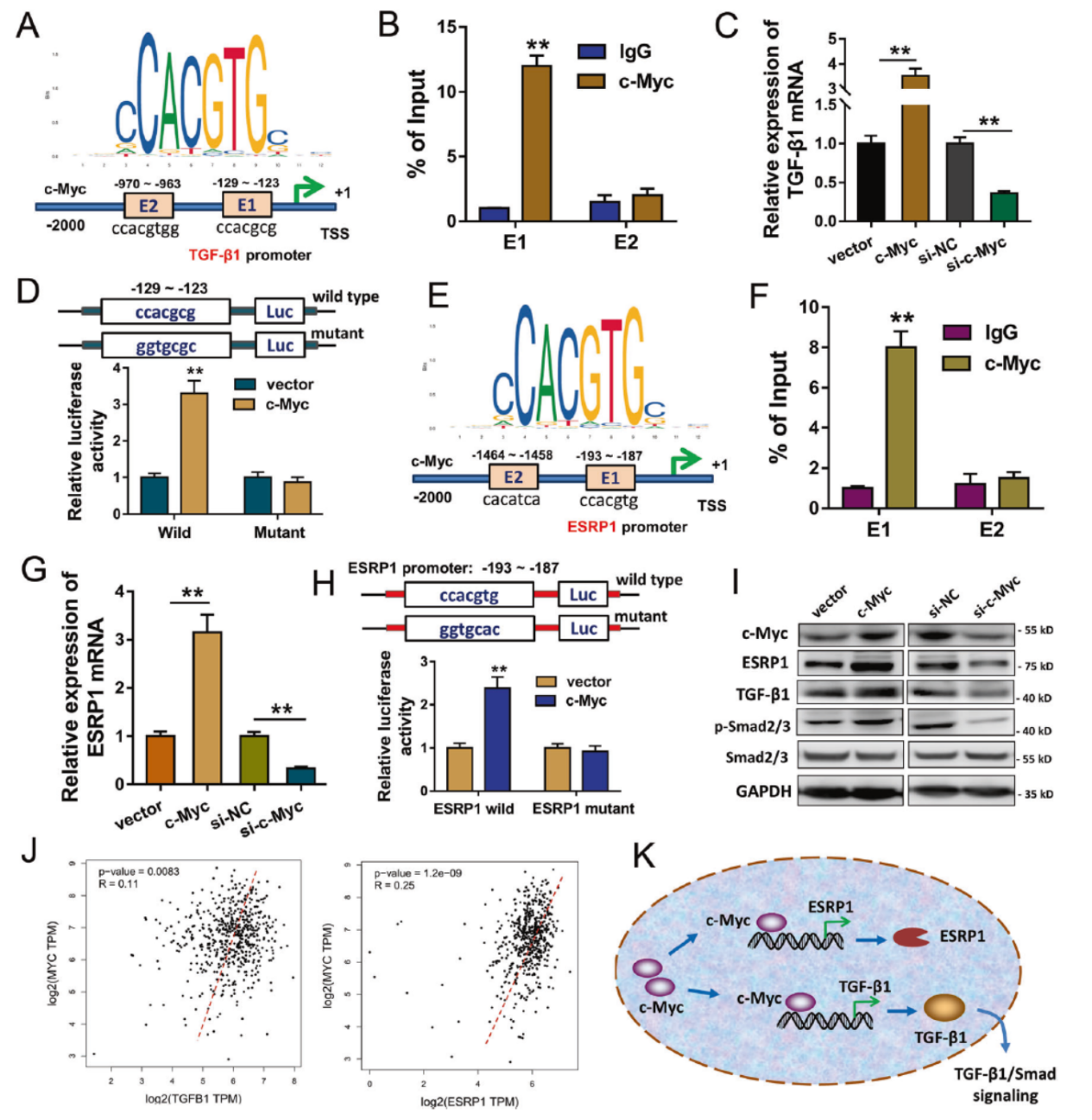
图6 c-Myc调控TGF-β1和ESRP1的转录表达 ([1])
ESRP1调控circUHRF1的生成
ESRP1是一种RNA结合蛋白,通过序列预测分析,作者发现circUHRF1的侧翼内含子中携带了ESRP1的结合位点,为分析ESRP1是否调控了circUHRF1的生成,作者通过构建模拟基因组的minigene报告系统进行了分析。设计了各种位点突变载体(详见下图A)。ChIP-PCR实验表明相关位点突变后ESRP1结合的效率会大大降低。干扰ESRP1也会降低circUHRF1的生成效率。
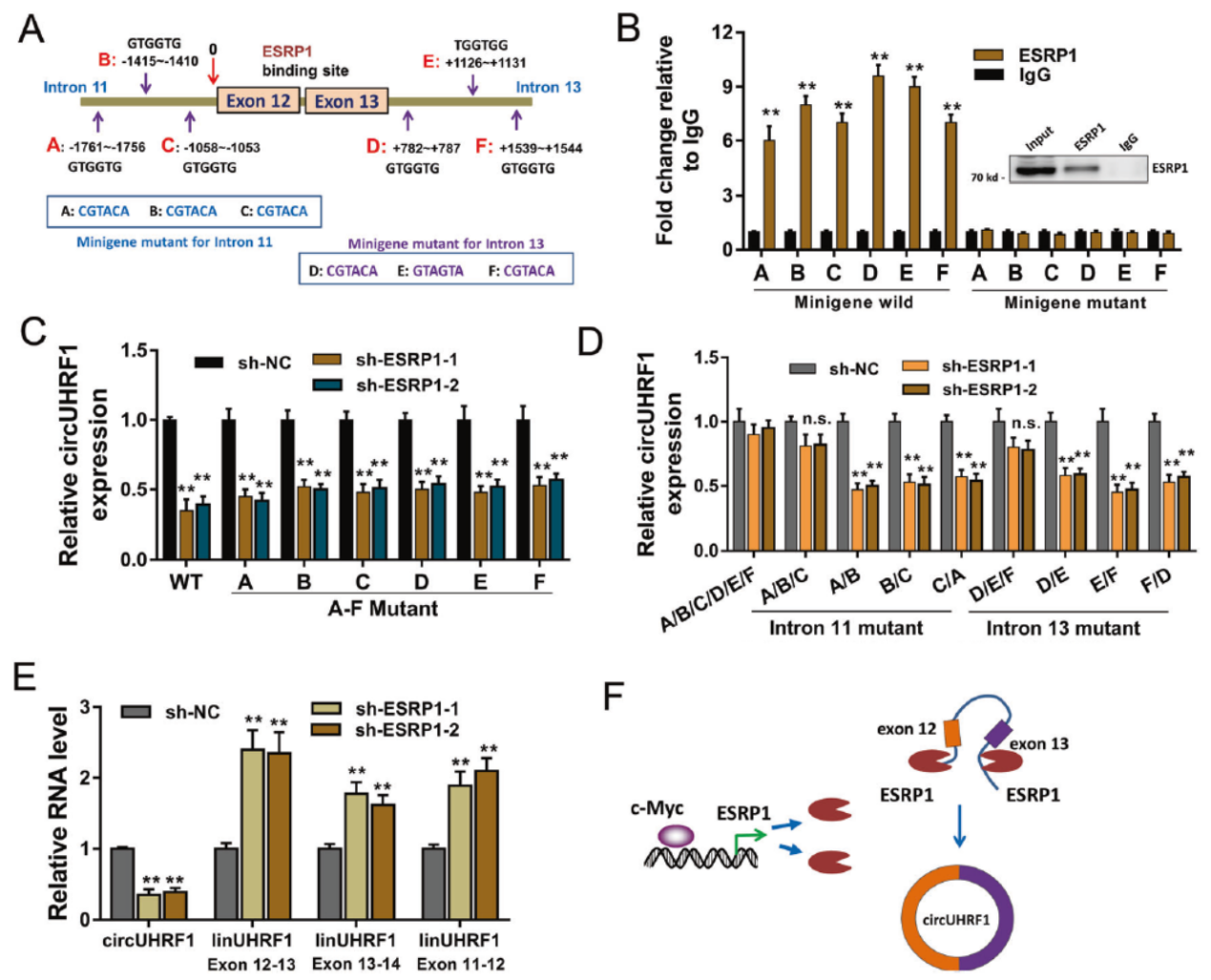
图7 ESRP1调控circUHRF1的生成 ([1])
OSCC细胞中circUHRF1/miR-526b-5p/c-Myc/TGF-β1/ESRP1反馈回路调控细胞侵袭
从上述的实验结果中可以勾勒出一个正反馈的调控回路:circUHRF1通过竞争性结合miR-526b-5p正调控c-Myc,c-Myc促进TGF-β1和ESRP1的表达,ESRP1通过结合circUHRF1的侧翼内含子,促进circUHRF1的生成,最终形成一个正反馈的调控环路。为验证这一反馈回路在OSCC中是否发挥作用,作者设计miR-526b-5p的inhibitor,circUHRF1的shRNA,c-Myc的siRNA及ESRP1的过表达这多个因素来分析该通路的功能。结果显示circUHRF1/miR-526b-5p/c-Myc/TGF-β1/ESRP1反馈回路可调控OSCC细胞的侵袭。

图8 circUHRF1/miR-526b-5p/c-Myc/TGF-β1/ESRP1反馈回路调控OSCC细胞的侵袭 ([1])
体内敲降circUHRF1抑制OSCC细胞成瘤
分子机制分析完成后还需要在体内验证circUHRF1的功能。作者通过构建稳定敲降circUHRF1的细胞系观测皮下成瘤能力的变化。结果表明稳定敲降circUHRF1可明显抑制体内成瘤的速度。

图9 体内敲降circUHRF1抑制OSCC细胞成瘤 ([1])
总结
本文的故事比较传统,但在OSCC中circRNA的研究并不多,本文的故事丰富了circRNA在不同肿瘤类型中的作用研究。本文还有个亮点就是找到了正反馈调控circUHRF1的回路,为探索疾病特异性circRNA表达状态的机制提供了借鉴。
参考文献
1. Zhao, W., et al., Splicing factor derived circular RNA circUHRF1 accelerates oral squamous cell carcinoma tumorigenesis via feedback loop. Cell Death Differ, 2019.
.png)
