
广州中山大学肿瘤防治中心的谢小明研究团队最近在Theranostics(IF= 8.537)杂志在线发表了题为“circEPSTI1 as a Prognostic Marker and Mediator of Triple-Negative Breast Cancer Progression”的研究,发现了circEPSTI1作为内源竞争性RNA和miRNA的sponge,结合miR-4753和miR-6809,上调了BCL11A的表达,促进了三阴性乳腺癌(TNBC)的增殖和抑制了其凋亡。该研究也指出circEPSTI1可作为一个TNBC患者的独立预后因素。
三阴性乳腺癌(TNBC)是指癌组织免疫组织化学检查结果为雌激素受体(ER)、孕激素受体(PR)和原癌基因Her-2均为阴性的乳腺癌。TNBC是侵袭性最强的乳腺癌类型,该疾病复发率高和致死率高。这类乳腺癌占所有乳腺癌病理类型的10.0%~20.8%,具有特殊的生物学行为和临床病理特征,预后较其他类型差。三阴性乳腺癌多发生于绝经前年轻女性,尤其是非洲裔美国妇女。与其他类型乳腺癌相比,化疗对三阴性乳腺癌的有效率较高,但如果只是常规的标准治疗,其预后依然很差。为了深入了解和改善TNBC病人的预后,急需发现新型的预后标志物和明确新的抗癌靶点。
虽然超过90%的人类基因组被活化转录,但是只有1-2%的基因组序列编码蛋白质,其余大部分序列都是表达非编码RNA。miRNA和lncRNAs是两种常见和被研究最多的ncRNA。这两种RNAs都可以调节靶基因的表达,介导肿瘤微环境中的信号转导。相比于以上两种RNAs,环状RNA(circRNA)是近几年研究热点的非编码RNA类型。circRNAs是一种无5’端帽子和3’端尾巴的共价闭合的单链RNAs。由于相比于mRNA,circRNAs更耐受RNase R的消化,因此也就具有更长的半衰期。随着生物信息学的发展和RNA-seq技术的发展,更多的研究发现circRNAs参与多种肿瘤的发生发展过程,在其中扮演着不同的角色,例如,可作为miRNA的sponge,可作为RNA结合蛋白的sponge,参与基因转录和表达的调控,可编码蛋白质等等。
1. 如何在TNBC中挖掘差异表达的新circRNAs——circEPSTI1
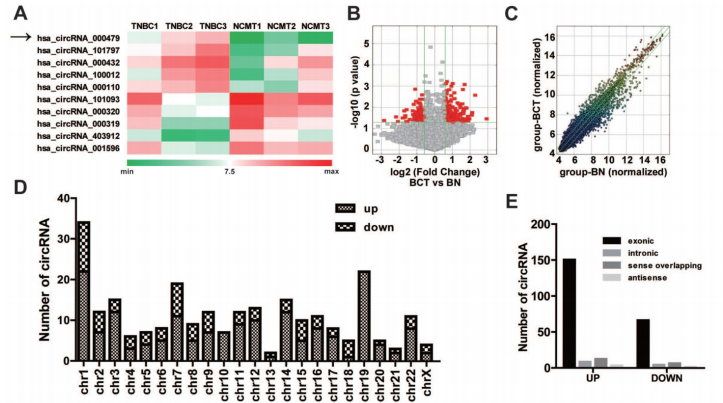
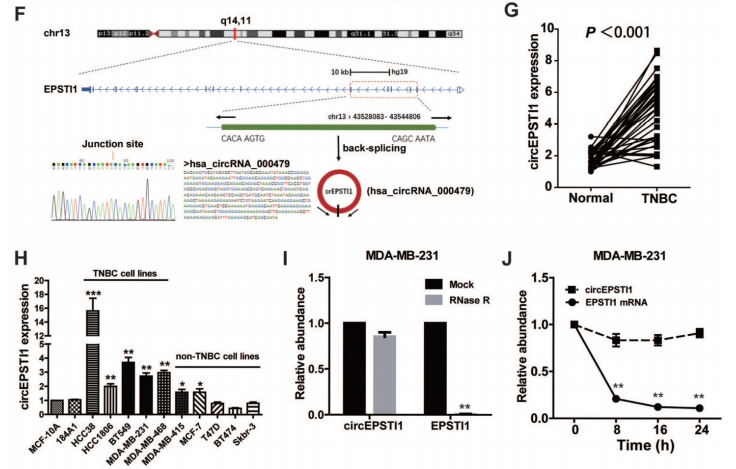
通过高通量的circRNA微芯片分析TNBC癌组织和非癌变的正常组织中差异表达的circRNAs,分级群聚揭示circRNAs的表达模式(A),火山图和散点图也展示circRNAs的表达模式(B-C)。差异表达的circRNAs在人类染色体上的分布情况(D)。差异表达的circRNAs来源不同类型基因组序列的分布情况(E)。作者对TNBC中上调倍数最高的circRNAs进行了RT-qPCR验证,锁定了circEPSTI1,同时通过outward-facing引物和Sanger测序对circEPSTI1的成环形态进行了证实(F)。在临床病人中,80% (33/38)的肿瘤中的circEPSTI1水平明显上调(G),体外的TNBC细胞系中circEPSTI1水平也明显上调,特别是在HCC38, HCC1806, BT549, MDA-MB-231 和 MDA-MB-468细胞中(H)。另外,作者利用RNase验证了circEPSTI1的耐受性强于EPSTI1的mRNA,利用放线菌素D验证了circEPSTI1的半衰期要长于EPSTI1的mRNA(I-J)。
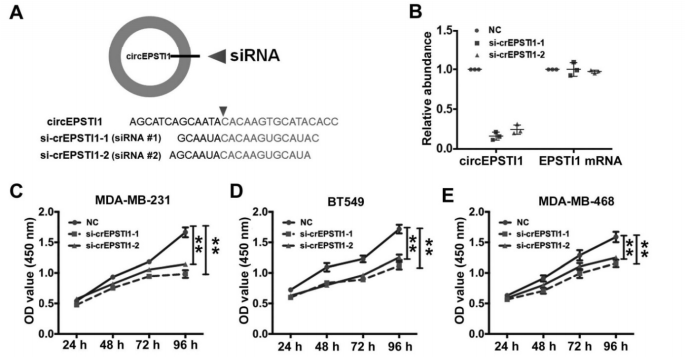
2. 那敲低原本高表达水平的circEPSTI1对于TNBC细胞有什么影响?
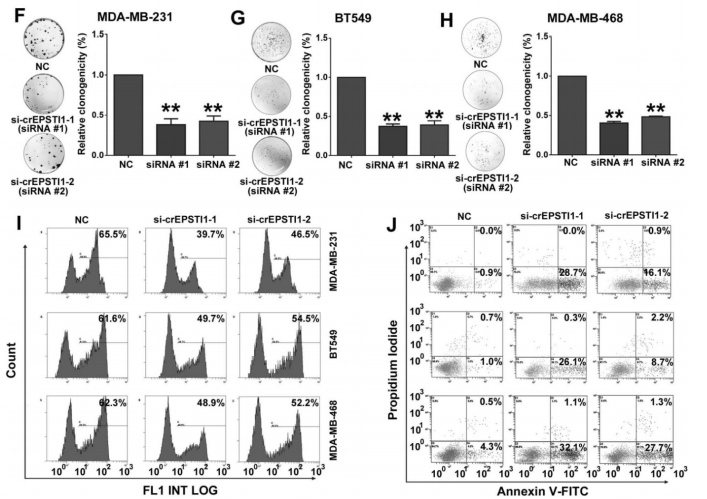
作者首先设计了siRNA敲低circEPSTI1的表达水平,而不会影响其mRNA的表达和其蛋白水平(A-B);随后发现敲低circEPSTI1水平会明显抑制MDA-MB-231, BT549和MDA-MB-468的生长(C-E),也明显抑制了这三种TNBC细胞的克隆形成能力(F-H),削弱了三种TNBC细胞的增殖能力,而诱导了这三种TNBC细胞的凋亡增加(I-J)。
3. circEPSTI1主要定位在胞浆,那是否会作为miRNAs 的sponge?
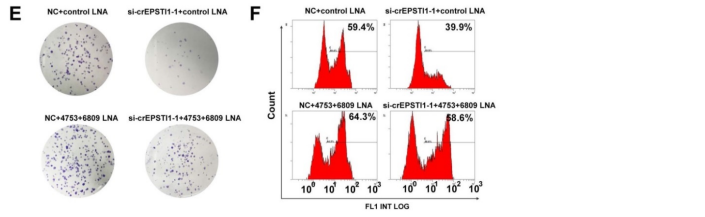
通过MREs分析和荧光素报告基因实验,作者筛选了miR-4753和miR-6809都存在两个与circEPSTI1结合的序列(A);转染miR-4753和miR-6809模拟物,会明显抑制荧光素酶的活性,而不会影响含有circEPSTI1突变序列的荧光素酶的活性(B)。当转染miRNA LNA分别抑制miR-4753和miR-6809时,荧光素酶的活性得到增强(C),进一步证实了miR-4753和miR-6809都可以直接与circEPSTI结合。但是qRT-PCR发现miR-4753和miR-6809不会下调circEPSTI的表达水平(D),说明circEPSTI不会被这两种miRNA消化,并作为其sponge。而且,敲低circEPSTI的水平会抑制敲低miR-4753和miR-6809后增强的克隆形成能力和增殖能力(E)。以上结果证明circEPSTI作为miR-4753和miR-6809的sponge。
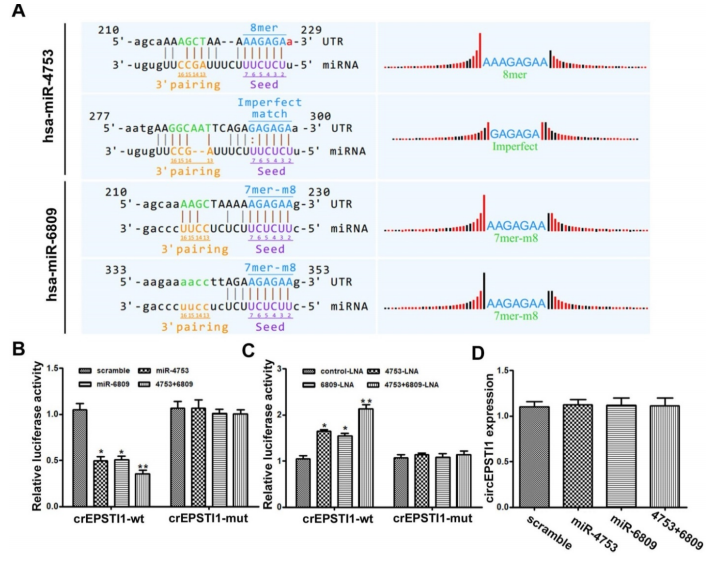
 4. circEPSTI1作为miR-4753和 miR-6809的sponge,那这两种miRNA的下游靶基因是什么?
4. circEPSTI1作为miR-4753和 miR-6809的sponge,那这两种miRNA的下游靶基因是什么?
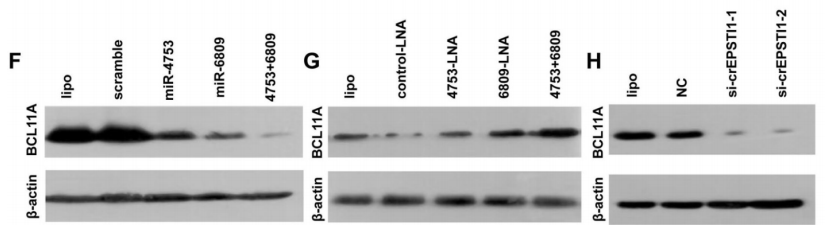
通过TargetScan、MIRDB和TARGETMINER数据库,算法筛选候选的靶基因(A-B)。通过pGL3- BCL11A wt-3’UTR和pGL3-BCL11A mut-3’UTR荧光素酶报告质粒,结合miR-4753 inhibitors和miR-6809 inhibitors,证实了miR-4753和 miR-6809可以结合到BCL11A(C-D);有趣的是,敲低或者上调miR-4753和 miR-6809水平不会改变BCL11A mRNA的水平,但是会相应的上调或者下调BCL11A蛋白水平(E-G),敲低circEPASTI1水平也会下调BCL11A蛋白水平(H),以上结果说明下调BCL11A是miR-4753和 miR-6809直接调控的靶基因,而且会被circEPSTI1敲低所抑制。
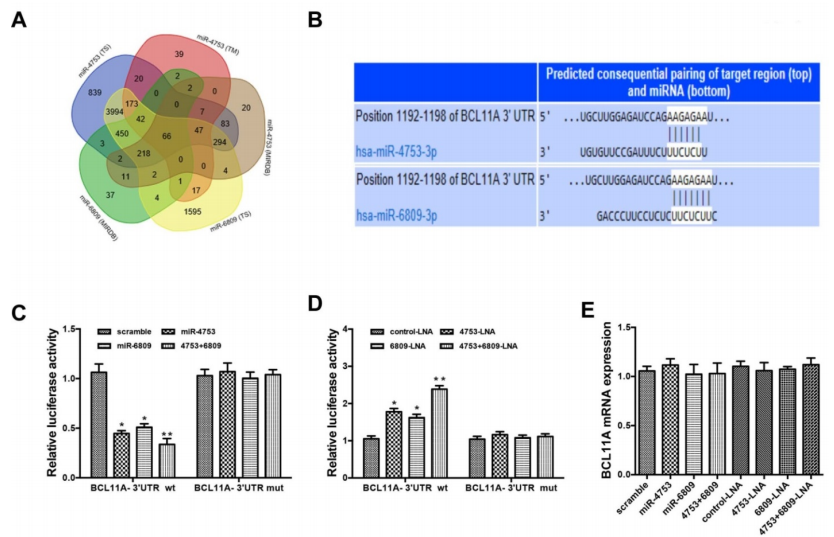
5. 体外验证过的circEPSTI1-miR-4753/6809-BCL11A轴在体内TNBC成瘤过程中的作用?
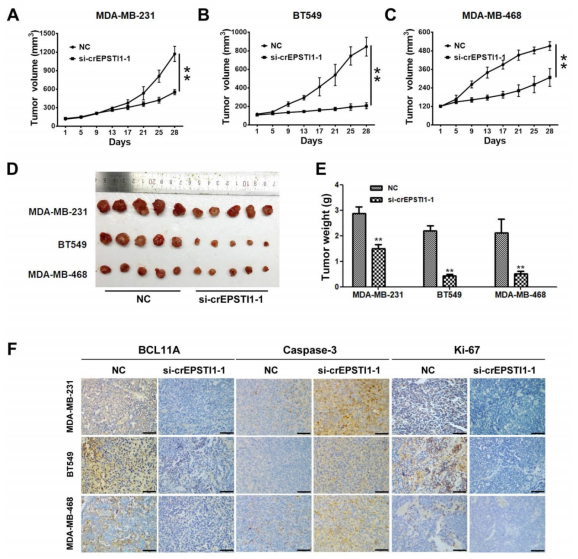
作者在裸鼠皮下植入MDA-MB-231, BT549和MDA-MB-468细胞成瘤,两周内不断瘤内给予si-cEPSTI1-1 siRNAs干预,发现si-cEPSTI1组小鼠的成瘤体积大小和肿瘤重量都明显减小,免疫组化结果也证明了si-cEPSTI1组小鼠的BCL11A表达水平和肿瘤细胞的增殖能力明显降低,而细胞的凋亡情况明显增加,说明circEPSTI1-miR-4753/6809-BCL11A轴在体内会影响TNBC的生长和增殖。
6. 那circEPSTI1的临床意义在于?
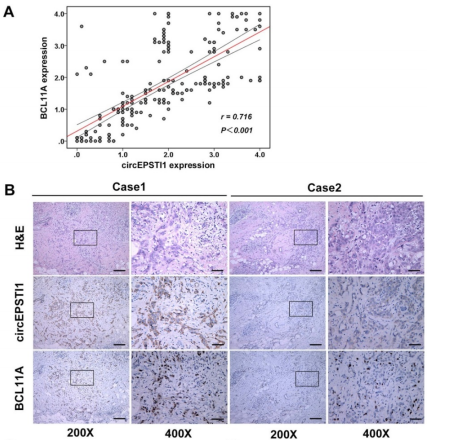
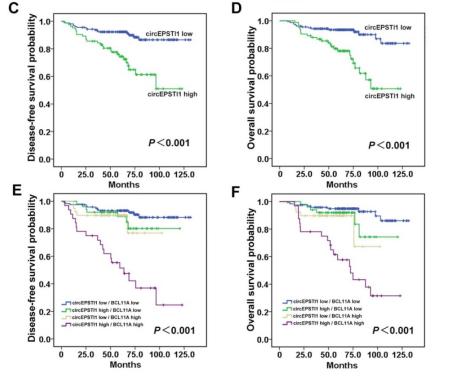
通过ISH分析和IHC分析,作者发现肿瘤样本中的circEPSTI1和BCL11A表达水平都有明显的上调,而且两者的水平在TNBC组织中成正相关(A)。H&E染色、肿瘤circEPSTI1原位杂交情况和免疫组化显示BCL11A的表达情况,发现同样的circEPSTI1和BCL11A表达上调的情况(B)。circEPSTI1表达水平高的病人具有更加低的月DFS和OS,而当病人的circEPSTI1 和 BCL11A的表达水平都很高时,病人的DFS和OS都会明显降低(C)。以上数据,提示circEPSTI1和BCL11A的表达水平成正相关,而且circEPSTI1可作为TNBC病人的预后因子。
参考文献
1. Chen B, Wei W, Huang X, et al. circEPSTI1 as a Prognostic Marker and Mediator of Triple-Negative Breast Cancer Progression. Theranostics. 2018 Jul 1;8(14):4003-4015. doi: 10.7150/thno.24106.
.png)
