

最近发表在JOURNAL OF NEUROSCIENCE期刊(IF=6.074)上的一篇circRNA与脑缺血后再灌注损伤有关的研究论文,报道了circTLK1表达在小鼠脑局部缺血和再灌注后明显上调,其通过海绵miR-335-3p并抑制miR-335-3p活性,继而上调TIPARP基因表达,增加梗死面积,加重神经元损伤和神经功能缺陷的症状。通讯作者是来自东南大学医学院药理学系的姚红红教授。姚红红教授是今年第五届circRNA研究论坛的特邀嘉宾,一直关注和从事circRNA与神经炎性相关神经系统疾病的关系研究,欢迎大家踊跃参加。
敲低circTLK1表达减少缺血后脑梗死面积
作者通过在建立短暂的大脑中动脉闭塞小鼠模型tMCAO后,对比假手术组和缺血梗死组的组织中circRNA表达谱差异,筛选出缺血梗死组组织中表达上调水平较高的circTLK1。RT-qPCR验证发现circTLK1在小鼠众多器官中表达,尤其在脑、脾和肺的表达水平较高。同时在小鼠血浆和梗死同侧皮质中发现表达上调的circTLK1,而TLK1 mRNA和蛋白水平却出现下降。为了研究circTLK1在缺血性中风疾病过程起什么作用,作者构建circTLK1 shRNA慢病毒载体注射到小鼠侧脑室,IF验证病毒转染神经元成功,RT-qPCR验证体内敲低效果明显,3周后在小鼠身上建立tMCAO缺血再灌注模型,结果显示敲低circTLK1表达虽然不影响到脑血流量和缺血面积,但是会明显减轻神经功能缺陷症状(表现为神经系统缺陷评分降低),减少缺血再灌注后脑梗死体积。
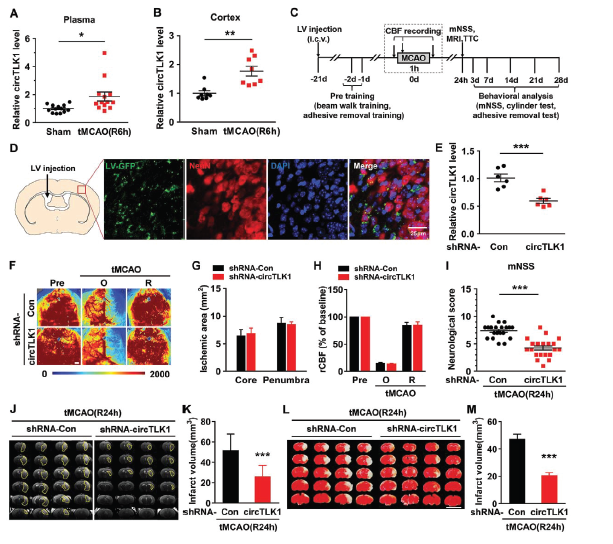
为了详细评估circTLK1对于小鼠中风后神经功能缺陷的影响,作者采用三个实验(神经系统缺陷评分、粘合剂去除试验和圆筒试验)进行评估tMCAO后第0, 3天和7天小鼠的早期症状。体内敲低circTLK1表达可明显减轻tMCAO后神经功能缺陷的症状(神经系统缺陷评分降低)和改善躯体感觉功能(粘合剂去除试验和圆筒试验)。而且敲低circTLK1表达可以明显减轻由tMCAO导致凋亡相关蛋白Bax/Bcl-xl和caspase-3/pro caspase-3比例上调的情况。
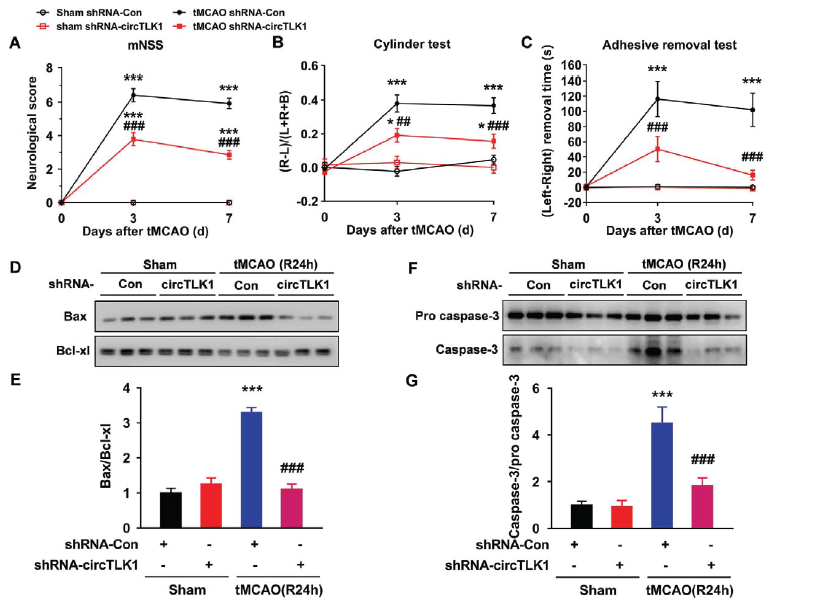
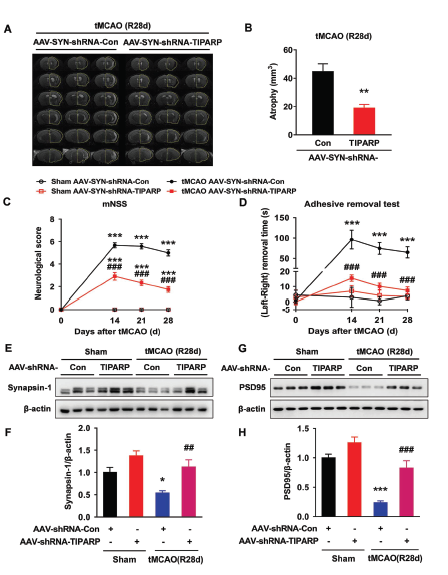
接着在评估tMCAO后第0, 14, 21和28天小鼠的晚期症状,发现敲低circTLK1表达依然可以改善tMCAO后神经功能缺陷的症状和改善躯体感觉功能,同时还可以减轻第28天脑萎缩的情况,增加梗死周边皮质的树突复杂性和树突棘的数目,rescue原本由tMCAO导致突触蛋白synapsin-1和PSD95蛋白水平下调的情况。
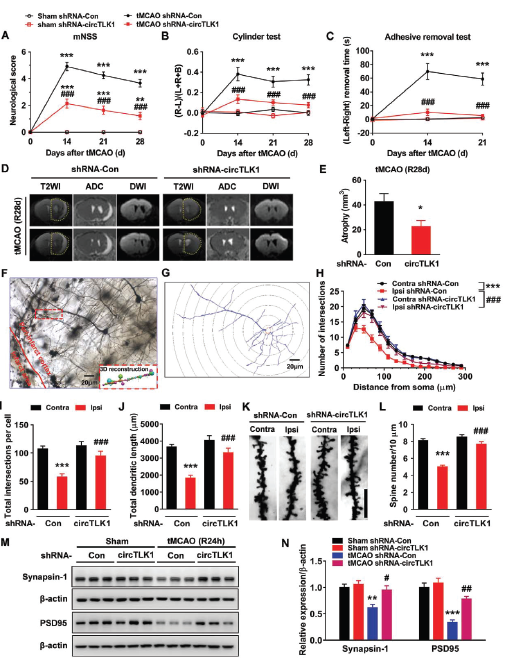
敲低circTLK1表达减轻脑中风导致的神经元损伤
在脑部众多细胞中,原代皮质神经元细胞中circTLK1的表达水平较高。神经元细胞经缺氧无糖后再灌注(OGD/R)处理模拟体内缺血再灌注后,circTLK1的表达水平明显上调,而TLK1 mRNA表达水平则下调。体外转染circTLK1 shRNA慢病毒可明显并特异地敲低circTLK1的表达,但不影响TLK1 mRNA表达。OGD/R处理可促进神经元细胞死亡,而同时敲低circTLK1表达则促进其存活。WB实验也证明了敲低circTLK1表达可明显降低Bax/Bcl-xl和caspase-3/pro caspase-3比例。
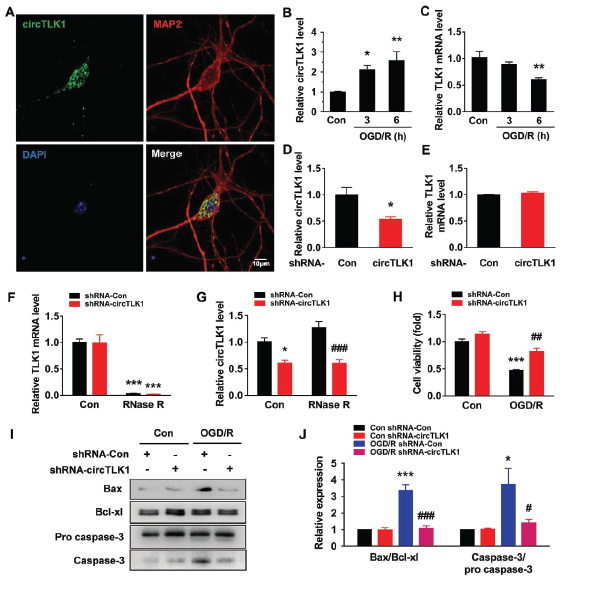
为了评估敲低circTLK1表达对于突触蛋白synapsin-1和PSD95的影响,转染circTLK1 shRNA可以明显上调OGD/R处理后神经元细胞中synapsin-1和PSD95蛋白水平,维持神经元marker– MAP-2水平和神经元突起的长度,保持轴突的长度和树突棘的数目,这些提示敲低circTLK1的表达对于神经元功能的维持和保护有重要的意义。
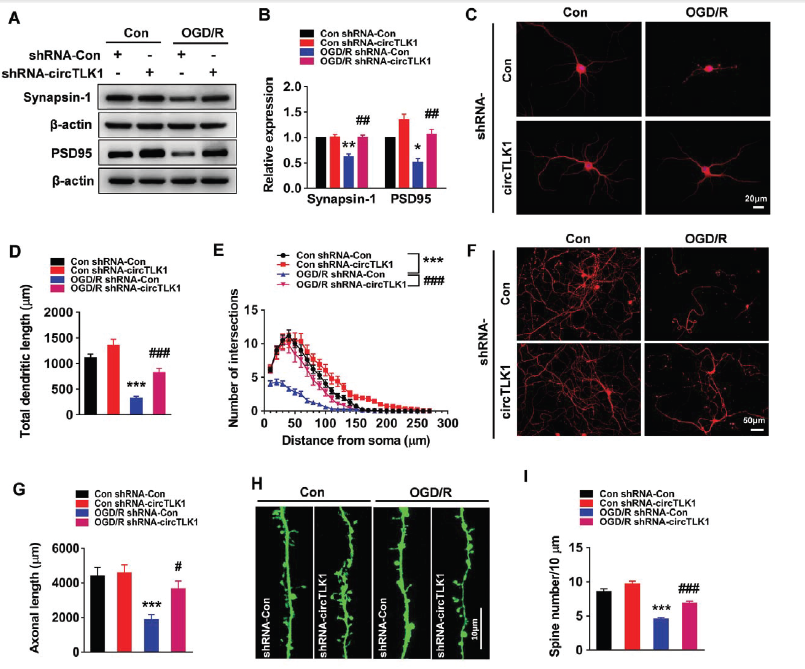
在神经元中特异性敲低circTLK1可有效保护神经元
作者构建含circTLK1 shRNA序列的腺病毒,注射到小鼠侧脑室,特异性敲低神经元circTLK1的表达,用于动态观察circTLK1在脑中风发生过程中的作用。特异性敲低神经元circTLK1的表达,虽然不影响到脑血流量和缺血面积,但是会明显减轻tMCAO后第3, 7天的神经功能缺陷症状和改善躯体感觉功能。
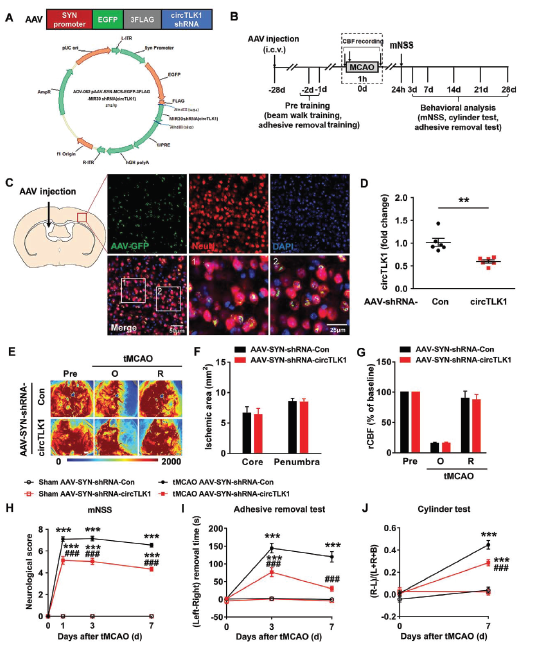
通过观察tMCAO后第14, 21和28天小鼠晚期症状,发现敲低神经元circTLK1的表达可明显减轻脑萎缩的症状,还可以改善神经功能缺陷症状和躯体感觉功能,进一步提示敲低神经元circTLK1的表达对于中风早期和晚期的重要保护意义。
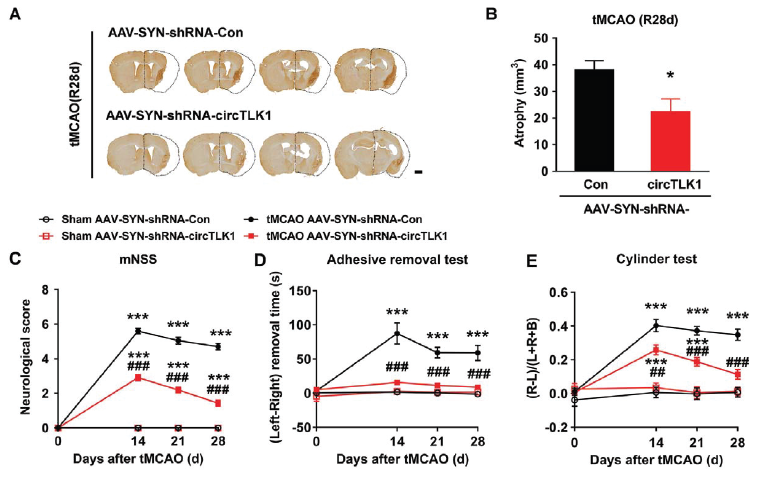
敲低circTLK1表达保护神经元的机制是什么?
通过对比tMCAO组和假手术组的小鼠脑组织mRNA表达谱,发现脑梗死区域和周边区域的TIPARP mRNA水平明显下调。已有研究报道过,TIPARP参与缺血性脑损伤的发生过程。下一步作者通过数据库寻求靶向TIPARP和circTLK1的miRNAs,只有miR-335-3p, miR-320-3p 和miR-129-5p这三个候选分子。而经tMCAO后6h后缺血皮质中miR-335-3p的表达水平是明显下调的。那miR-335-3p与circTLK1是否存在结合作用呢?RNA-pull down证明miR-335-3p可以富集并结合circTLK1;而反向亲和分离实验证明circTLK1也可捕获并富集miR-335-3p。FISH实验证明miR-335-3p与circTLK1共定位于原代皮质神经元的胞浆中。
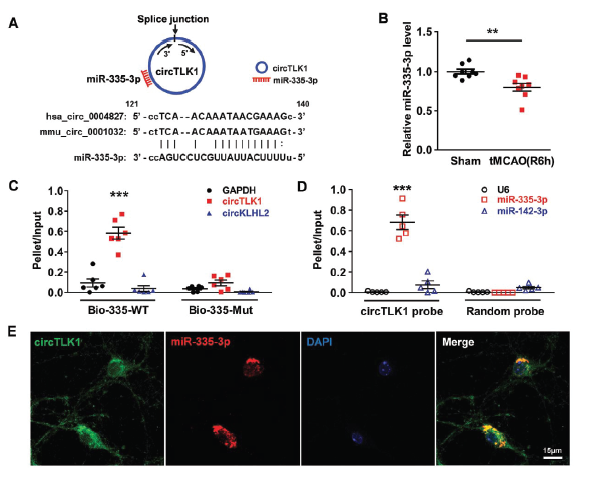
另一方面,那miR-335-3p与TIPARP是否存在结合作用呢?经数据库预测TIPARP mRNA 3’-UTR区域包含miR-335-3p结合位点。同时luciferase报告基因实验证明miR-335-3p与TIPARP 3’-UTR存在相互结合作用。体内实验发现经tMCAO处理12h 至第7天,缺血组织中TIPARP水平明显上调。经OGD/R处理后 ,皮质原代神经元中TIPARP表达水平也明显上调。另外,无论是否给予OGD/R处理,同时过表达miR-335-3p时,神经元中TIPARP表达水平则明显下调;当抑制miR-335-3p表达时,则出现相反的结果。这些结果提示circTLK1/miR-335-3p/TIPARP调控轴的存在。
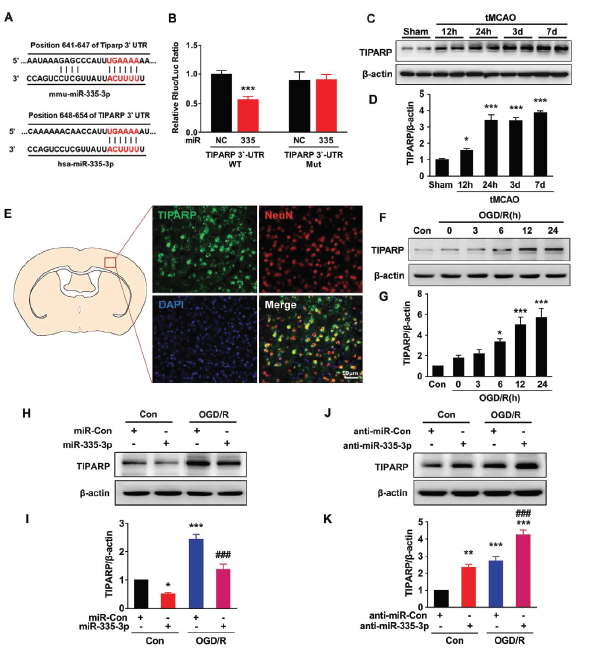
circTLK1/miR-335-3p/TIPARP轴对于神经元损伤的意义
OGD/R处理可以促进神经元的死亡,同时过表达miR-335-3p则会维持神经元的存活,这可能与上调突触相关蛋白synapsin-1 和PSD95表达有关 ;而同时抑制miR-335-3p表达则无法维持其存活,这可能与synapsin-1 和PSD95表达下调有关。敲低circTLK1表达可明显抑制由OGD/R处理引起上调的TIPARP蛋白水平。敲低circTLK1表达可下调TIPARP蛋白水平,维持神经元存活的效应,会被anti-miR-335-3p处理所逆转,进一步说明circTLK1通过miR-335-3p调控TIPARP的表达。另外,敲低TIPARP表达会明显维持经OGD/R处理的神经元存活。体内实验也证明,tMCAO小鼠在敲低circTLK1表达后,脑组织中的TIPARP的表达也出现明显下调。
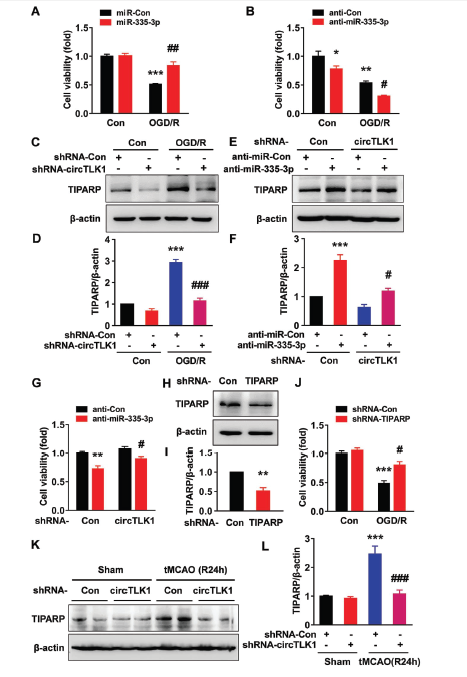
敲低miR-335-3p表达下调PSD95蛋白水平和降低树突棘密度的效应,会被敲低circTLK1表达所逆转。另外敲低TIPARP表达可逆转OGD/R处理所诱导PSD95蛋白下调的效应。体外OGD/R模型的基础上利用rescue实验验证circTLK1/miR-335-3p/TIPARP轴的相互调控关系。
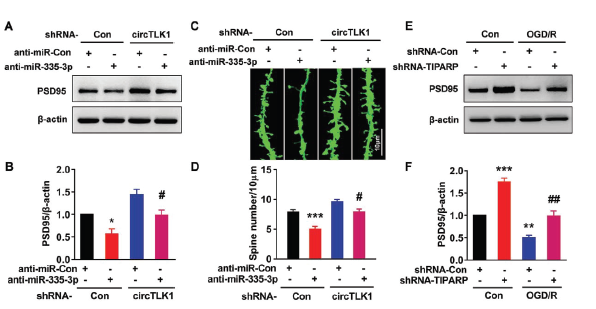
在神经元中特异性敲低TIPARP表达可有效改善神经系统缺陷
构建含TIPARP shRNA序列的腺病毒注射入小鼠侧脑室28天后,在神经元中TIPARP表达可被特异性敲低。接着诱导tMCAO后,发现脑血流量和缺血面积不受影响,但是脑梗死体积明显减少,神经系统缺陷评分和躯体感觉功能得到明显改善。
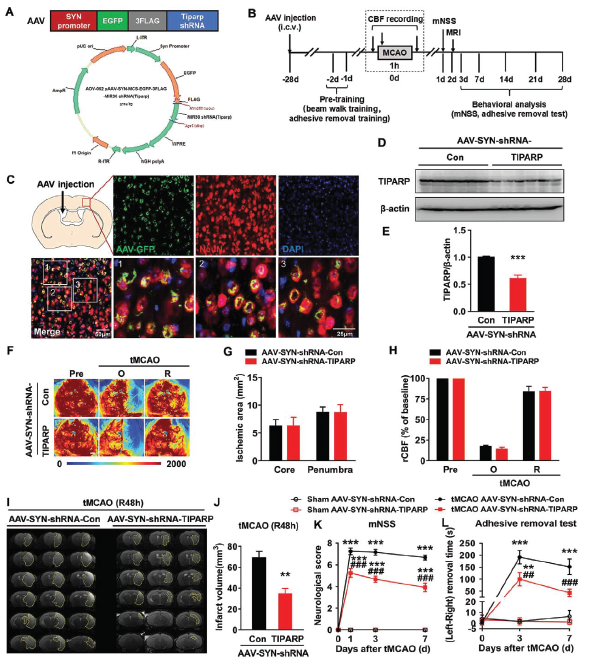
经过长期观察(tMCAO后第28天),TIPARP敲低组小鼠脑萎缩的情况得到明显的改善,神经系统评分和躯体感觉功能也得到明显改善。原本在tMCAO后突触相关蛋白synapsin-1 和PSD95表达下调的情况,在同时敲低TIPARP表达后,这两种蛋白出现明显上调。
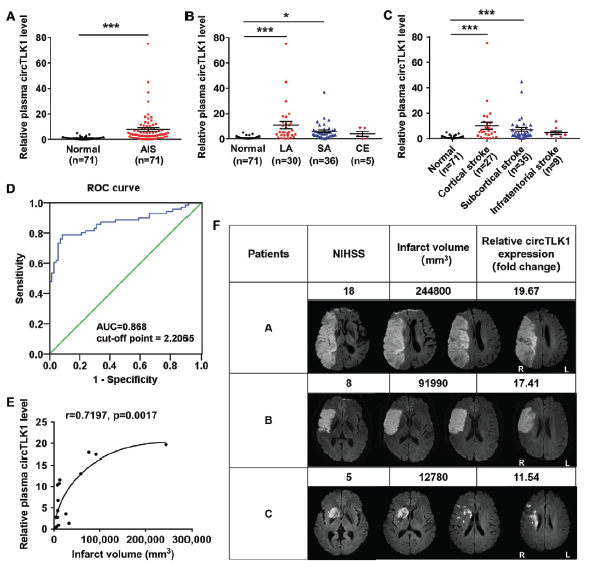
CircTLK1的临床意义是什么?
相比于健康人群,患有急性缺血性中风AIS的病人血浆中circTLK1表达水平出现明显上调。AIS疾病分为大动脉粥样硬化LA, 小动脉阻塞SA, 和心源性栓塞CE三种亚型,而只有LA和SA亚型患者血浆中circTLK1表达水平出现明显上调。通过对比发生中风的不同部位,发现只有患有皮质和皮质下梗死的患者血浆中circTLK1表达水平出现明显上调。ROC曲线分析显示circTLK1可能作为临床诊断AIS和提示AIS严重程度的重要标志物,而且AIS患者发生梗死面积越大,其circTLK1表达水平越高。
总结:作者通过对比正常脑组织,从tMCAO小鼠脑组织circRNA表达谱中筛选到表达上调程度相对高的circTLK1,首先从宏观表型分析,敲低circTLK1减少脑梗死面积,改善神经系统功能缺陷和减轻神经元损伤;接着微观机制研究,从tMCAO小鼠脑组织中筛选到已有研究报道过的TIPARP基因,再经生信分析预测并验证TIPARP和circTLK1两者之间的介导者—miR-335-3p。然后通过体外OGD/R证实circTLK1/miR-335-3p/TIPARP轴的相互调控对于保护神经元、改善神经系统功能缺陷的重要意义。最后回归临床,数据统计分析circTLK1有可能作为提示AIS严重程度的重要指标。总的来说,靶向敲低circTLK1和TIPARP表达、过表达miR-335-3p有助于改善AIS引起的神经系统缺陷症状和保护神经元不受损伤。这是少有的circRNA在神经系统疾病方面的研究,如果课题研究有关神经系统疾病方面,可借鉴本文的研究方法。
参考文献
- Wu F , Han B , Wu S, et al. Circular RNA TLK1 aggravates neuronal injury and neurological deficits after ischemic stroke via miR-335-3p/TIPARP. J Neurosci. 2019 Jul 16. pii: 0299-19. doi: 10.1523/JNEUROSCI.0299-19.2019.(解读用图均来自此文献)
.png)
