2020年5月22日,东南大学医学院的姚红红教授和中科院昆明动物研究所的王建红教授为共同通讯作者在Circulation(IF=23.054)杂志上发表了一篇题为“Extracellular Vesicle-Mediated Delivery of CircSCMH1 Promotes Functional Recovery in Rodent and Nonhuman Primate Ischemic Stroke Models”的文章,阐述了一种新的药物递送技术,即
胞外囊泡运送circSCMH1,可用于啮齿动物和非人灵长类动物缺血性中风的功能恢复([1])。

缺血性中风是一种常见的神经系统疾病,也是导致永久性残疾的重要原因。到目前为止,关于中风恢复和治疗的药物很少被报道,中风药物的研发仍然是一个迫切的研究领域,可以使大量患者受益。本文作者提出了一种潜在的核苷酸药物传递技术,即胞外囊泡运送circSCMH1。circSCMH1可与转录因子MeCP2结合,降低它对靶基因转录的抑制,从而促进啮齿动物和非人灵长类动物缺血性中风模型的功能恢复。
急性缺血性中风(AIS)患者和中风小鼠模型中circSCMH1表达降低
使用circRNA芯片技术检测AIS患者血浆中circRNA的表达差异,鉴定出20个差异表达的circRNA,它们在人和鼠中具有高度同源性,并且差异倍数>2。在AIS患者血浆中使用qPCR对结果进行验证,发现仅仅有12个circRNA被检测到。其中,circSCMH1下调的水平与芯片结果相似,选择它做进一步研究。在光诱导血栓(PT)中风后的第6-7天,检测到缺血引起小鼠梗死周围皮层和血浆中circSCMH1水平显着降低。
ROC分析circSCMH1对AIS的诊断作用,circSCMH1的AUC值可达0.7896,有91.72%的敏感性和64.83%的特异性。作者进一步发现circSCMH1水平与不同血管危险因素相关,例如吸烟史、既往短暂性脑缺血发作(TIA)、中风和心肌梗死(MI)。此外,根据急性中风治疗试验(TOAST)标准,检测到在小血管疾病、大血管疾病和心脏栓塞患者中,circSCMH1的表达水平均降低。
下一步检测circSCMH1是否与中风的预后相关。Mann-Whitney U检验显示,circSCMH1水平在预后较好的患者中更高。使用ROC检测circSCMH1对AIS的预后作用,AUC是0.6864,有68.85%的敏感度和70.24%的特异度。并且在排除年龄、高血压和既往TIA、中风和MI等血管危险因素后,circSCMH1仍然可以作为预后指标。除此之外,发现AIS患者入院治疗7天后,circSCMH1水平显著升高。以上结果表明中风导致circSCMH1水平下降,并且它具有作为AIS的诊断分子和预后分子的潜力。
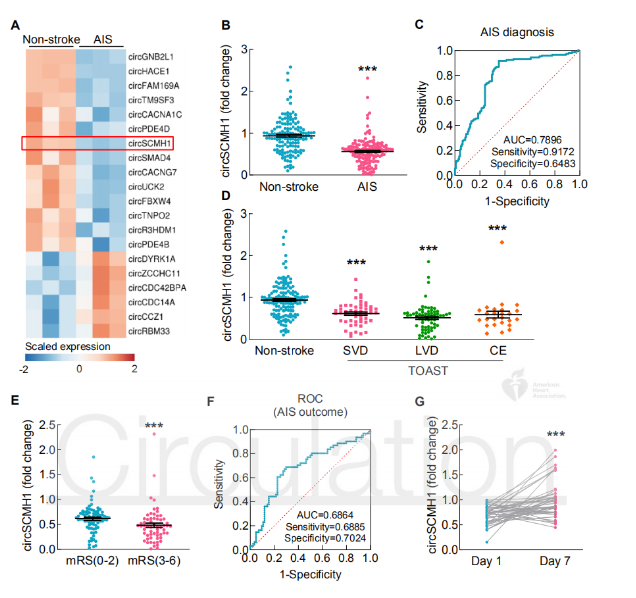
图1 circSCMH1在AIS患者中下调
构建RVG-EV靶向大脑损伤区域
细胞外囊泡(EV)是由细胞释放的直径为30到150 nm的脂膜囊泡,可以穿过血脑屏障(BBB),能够运输蛋白质、脂质和核苷酸。一项突破性的研究表明,狂犬病毒糖蛋白(RVG)可以通过融合蛋白溶酶体相关膜糖蛋白2b(Lamp2b)-RVG,定位于EV的表面,实现脑特异性靶向的潜力。作者利用同样的设计,制备靶向大脑的RVG-circSCMH1-EV,探讨circSCMH1在中风病理过程中的作用。用编码GNSTM-RVG-Lamp2b-HA和circSCMH1的质粒共转染HEK293T细胞,然后进行EV纯化。梯度离心法从培养细胞的上清液中分离出EV,使用纳米颗粒分析、电镜、qPRC和Western blot等方法对分离的EV进行了验证,结果表明RVG-circSCMH1-EV构建成功。
检测注射EV是否可以将circSCMH1运送至大脑,用DiI标记未修饰的EV(circSCMH1-EV)和修饰的EV(RVG-Vector-EV和RVG-circSCMH1-EV)。将EV悬浮于PBS中,通过尾静脉注射到小鼠体内,在转染6小时后收集脑、肺、心、脾、肾和肝组织。qPCR显示,与未修饰的circSCMH1-EV相比,RVG-circSCMH1-EV组大脑中circSCMH1的表达更高,表明RVG-EV成功地靶向了脑组织。在大脑中,红色的DiI颗粒大部分位于小簇中,可见于神经元的细胞质内或附着在神经元的细胞膜上,在星形胶质细胞和小胶质细胞中也检测到标记的EV。
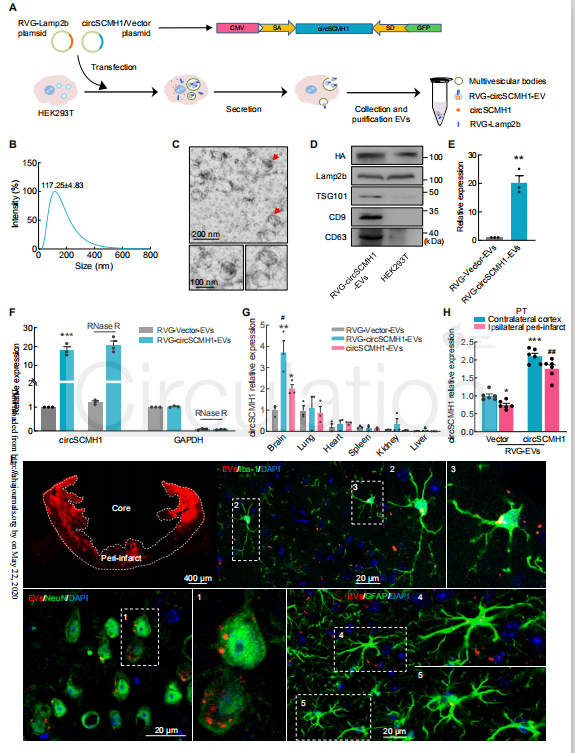
图2 构建RVG-EV来靶向大脑损伤区域
RVG-EV递送circSCHM1促进PT小鼠的功能恢复
接下来,作者检测RVG-circSCMH1-EV对PT小鼠功能恢复的影响。使用PT诱导雄性小鼠中风,24小时后静脉注射RVG-circSCMH1-EV。在PT中风后的第2天进行Nissl染色,在第4-28天进行行为测试。在网格行走测试中,与对照组相比,RVG-circSCMH1-EV组的动物在PT处理后第4、7、14、21和28天表现更好并减少了脚部缺陷。黏附物能力测试和潜伏期移动试验得到了相同的治疗结果。得出结论,RVG-circSCMH1-EVS可以促进中风后的运动恢复,起到治疗中风的作用。然而,Nissl染色表明RVG-circSCMH1-EV组和对照组的梗死面积并没有显著差异。此外,RVG-circSCMH1-EV对另一种中风模型-大脑中动脉远端闭塞(DMCAO)模型也具有同样的运动恢复作用。最后,作者排除了circSCMH1给药引起全身毒性和免疫反应的可能性,表示RVG-circSCMH1-EV具有临床应用的潜力。
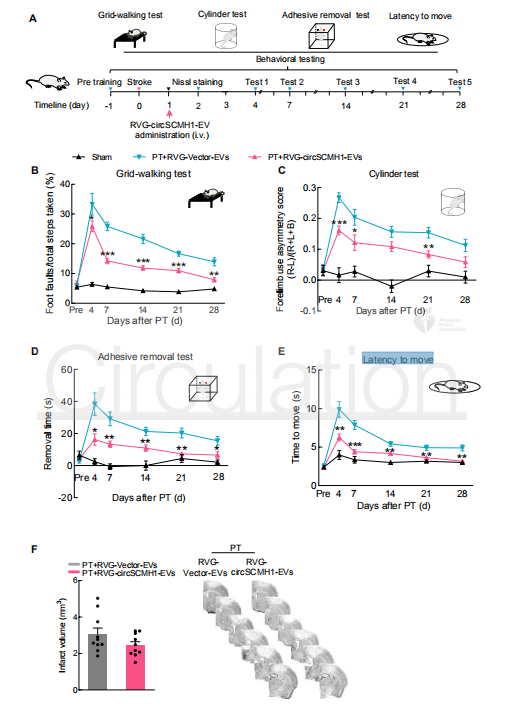
图3 RVG-EV递送circSCHM1促进PT小鼠的功能恢复
体内和体外过表达circSCMH1均可恢复脑神经元的可塑性
接下来,作者研究circSCMH1促进中风后功能恢复的细胞机制。用流式细胞仪对未中风组小鼠和PT组小鼠的神经元、星形胶质细胞、小胶质细胞和内皮细胞进行分类。原位杂交显示,circSCMH1集中在神经元、星形胶质细胞和小胶质细胞中。PT处理后显著减少了小鼠梗死周围皮质的棘突数目、轴突分支和树突长度,以及神经元交叉点的数目,并且这些表型都被RVG-circSCMH1-EV处理所改善。此外,RVG-circSCMH1-EV处理显著改善了PT小鼠突触相关蛋白PSD95和突触素水平的降低。
与体内的研究结果相似,氧糖剥夺(OGO)导致皮层神经元树突棘密度显著降低,这种减少可以通过转导circSCMH1慢病毒得到改善。在OGD处理的神经元中观察到MAP2免疫反应性的显著丧失和神经元突起长度的缩短,这些效应可以通过circSCMH1慢病毒的转导而得到改善。
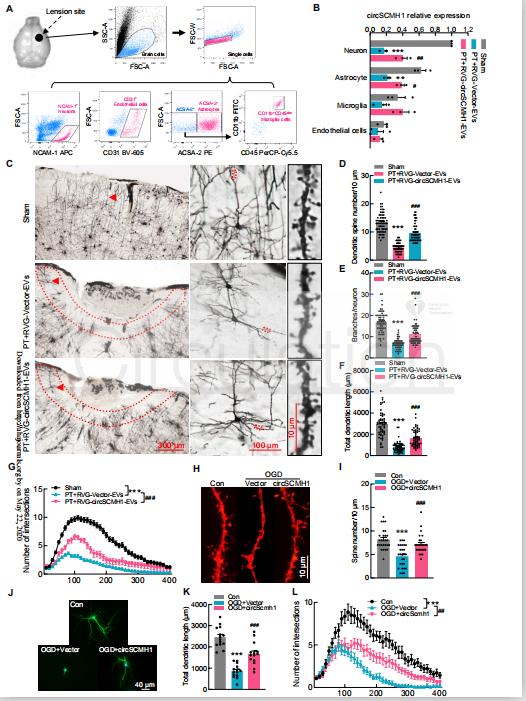
图4 circSCMH1过表达会恢复在体内和体外脑神经元的可塑性
circSCMH1降低胶质细胞活化和外周免疫细胞浸润
下一步,作者试图检测circSCMH1是否改变了梗死周围皮层的局部胶质细胞活化和炎性激活。与对照组相比,RVG-circSCMH1-EV处理显著降低了PT小鼠梗死前区域的TNF-α、MCP-1、IL-1β和IL-6水平。它还显著降低了PT小鼠梗死周围皮层的星形胶质细胞和小胶质细胞的反应性。在体外,用circSCMH1慢病毒转导细胞可显着降低OGD诱导的星形胶质细胞和小胶质细胞的活化,而敲低circSCMH1会增加星形胶质细胞和小胶质细胞的激活。
由于星形胶质细胞和小胶质细胞的不同表型与细胞毒性或神经保护相关,接下来探索circSCMH1对星形胶质细胞和小胶质细胞阶段特异性转换的作用。RVG-circSCMH1-EV处理导致PT小鼠梗死灶中A1星形胶质细胞特异性转录物(Ligp1、Gbp2、Psmb8和Srgn)显着下调,A2星形胶质细胞特异性转录物(Tgm1,Ptx3和Tm4sf1)显着上调。此外,RVG-circSCMH1-EV处理会使细胞偏向M2a和M2c表型,M1型细胞比例减少。
作者还检测了RVG-circSCMH1-EV是否改变外周细胞浸润,由于CD45+群体包含浸润的免疫细胞,作者从梗死周围皮层收集了这些细胞,并使用流式细胞术根据CD45信号进行门控。进行下一步的分析,以量化淋巴样(CD4 +和CD8 +)T细胞、B细胞和骨髓细胞群体。RVG-circSCMH1-EV处理显著降低了淋巴样T细胞、B220B+细胞和Ly6G-Ly6C1o巨噬细胞/单核细胞的频率,而Ly6G-Ly6Chi巨噬细胞/单核细胞和Ly6G+中性粒细胞并没有改变。总之,这些发现表明,RVG-circSCMH1-EV抑制了中风后免疫细胞向同侧大脑半球的浸润。
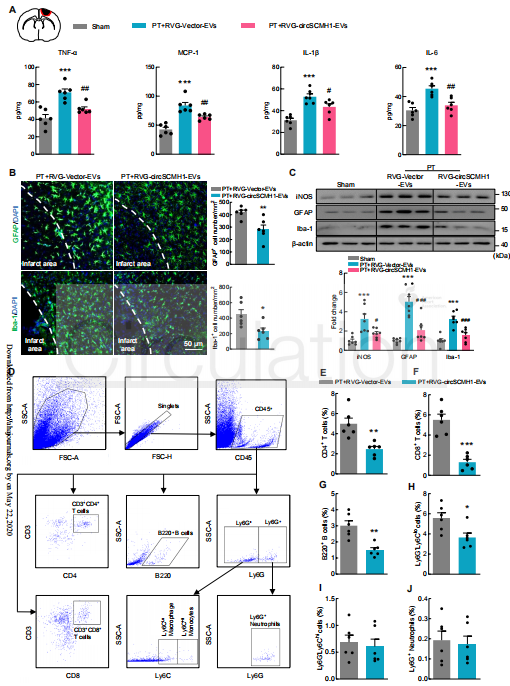
图5 circSCMH1减少胶质细胞活化和外周免疫细胞浸润
circSCMH1结合MeCP2
为了确定参与神经元可塑性的分子机制,对circSCMH1过表达的原代皮层神经元进行了转录组分析和蛋白质组筛选。作者在RNA-seq中发现了4010个差异表达的基因。串联质谱显示,circSCMH1在胞浆中的异位表达导致73种蛋白质在细胞核中表达上调,123种蛋白质在细胞核中表达下调。在这些蛋白质中,使用TRRUST数据库进行分析,鉴定了两个上调的蛋白(PHF2和SIN3A)和三个下调的蛋白(MeCP2、TRP53BP1和MAZ),它们可以调节15个差异表达(DE)的基因,其中9个已被鉴定为MeCP2的靶基因。
接下来,通过qPCR验证了15个DE基因的表达差异,并通过实验证实了9个MeCP2靶基因中的4个(mobP、igFBP3、Fxyd1和Prodh)确实是在circSCMH1过表达的神经元中存在差异表达。此外,TRP53BP1靶基因brcal、SIN3A靶基因Rest和PHF2靶基因Sox9在circSCMH1过表达神经元中也显著降低,但MAZ靶基因Htr1a未见明显降低。然后,采用RNA结合蛋白免疫沉淀(RIP)方法鉴定circSCMH1结合蛋白。在这5种蛋白中,circSCMH1与MeCP2有丰富的结合。这种结合力和已知的大量靶基因为进一步研究circSCMH1和MeCP2之间的功能关系奠定了基础。
接下来,作者使用catRAPID算法分析circSCMH1与MeCP2的相互作用,预测到MeCP2的三个区域与circSCMH1具有高相互作用能力:MeCP2的残基26-76、236-287和403-453。通过RIP分析确定circSCMH1和MeCP2的结合需要残基26-76区域。此外,构建circSCMH1突变质粒证实了circSCMH1 426-485序列对于互作是重要的。为了确定circSCMH1和MeCP2的相互作用是否影响MeCP2的分布,进行了免疫荧光染色和western blot,发现细胞质中circSCMH1的异位表达增加了原代皮层神经元胞质中MeCP2的水平,并降低其在细胞核的水平。
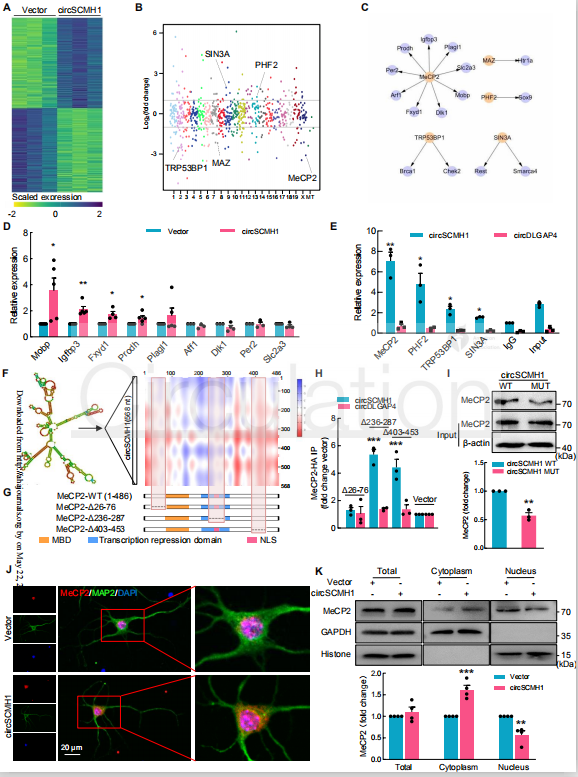
图6 circSCMH1结合MeCP2
circSCMH1促进非人灵长类动物中风后的运动功能恢复
为了进一步探索circSCMH1的功效,作者在非人灵长类动物中建立了PT中风模型,在PT后的第24到48小时注射RVG-circSCMH1-EV,来测试circSCMH1促进运动恢复的作用,恒河猴接受垂直插槽测试、Klüver棋盘测试和旋转Brinkman棋盘测试,来评估PT后第4、7、14、21和28天的手指灵活性,尤其是手指的抓握能力。在PT处理之前,所有猴子都能够平稳地完成上述三个任务。在垂直槽测试中,RVG-circSCMH1-EV实验组和RVG-Vector-EV对照组的猴子在完成时间和成功率上没有显着差异。在Klüver棋盘测试中,RVG-circSCMH1-EV组大大缩短了完成时间,但是,接受这种治疗的猴子仅在PT后第7天和第28天才显示出成功率的明显升高。旋转Brinkman棋盘测试是三项中最难的实验,与对照相比,RVG-circSCMH1-EV组显着改善了猴子的表现,缩短了完成的时间,并且在逆时针和顺时针方向上以12秒/轮的旋转速度增加了成功率。以上实验表明circSCMH1会提高猴子的抓力和手指灵活性。此外,与对照组相比,在PT后第21和28天,RVG-circSCMH1-EV组的神经功能损伤评分(NDS)明显降低。
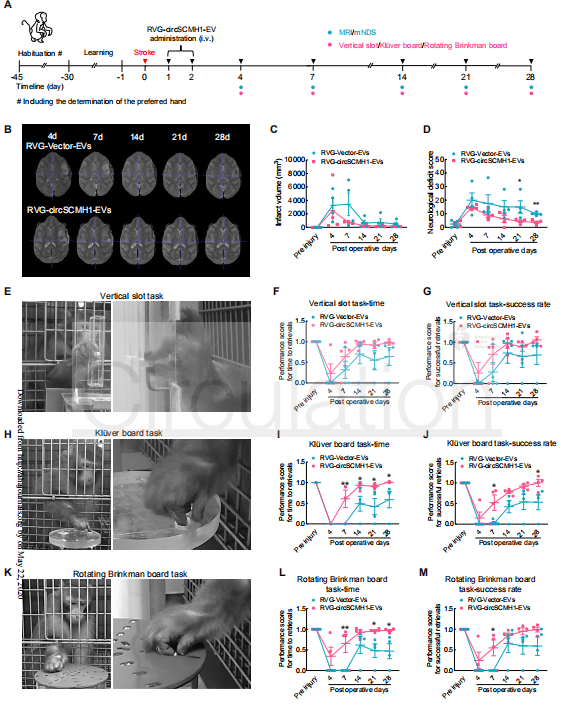
图7 circSCMH1促进非人类灵长类动物中风后的运动功能恢复
参考文献
[1] Yang L, Han B, Zhang Z, et al. Extracellular Vesicle-Mediated Delivery of CircSCMH1 Promotes Functional Recovery in Rodent and Nonhuman Primate Ischemic Stroke Models. Circulation. 2020; doi:10.1161/CIRCULATIONAHA.120.045765
.png)
