
上海第二军医大学长海医院消化内科孔祥毓博士和李兆申教授在Gut(IF=16.658)上发表了一篇letter,其研究发现VDR信号活化通过抑制CAFs释放外泌体miR-10a-5p限制胰腺癌细胞生长。全文虽然只有一个Figure,但是思路很清晰,条理也很清楚。 2014年Sherman MH 等人就发现维他命D受体(VDR)可以介导基质重编程抑制胰腺癌发展,有助于胰腺癌的治疗。随后Ferrer-Mayorga等人则进一步发现,肿瘤基质中成纤维细胞VDR和相关基因表达与大肠癌的临床预后好成正相关。作者结合前两者的研究,解释了肿瘤相关的成纤维细胞VDR信号通路活化抑制癌症的潜在机制。
Dil标记的三种CAFs分泌的外泌体都可以被胰腺癌细胞系(PC cell line)PANC-1和SW1990摄取。RNA-seq(又是RNA组学测序分析,说明测序对于挖掘外泌体新miRNA或者circRNA等ncRNA很重要)分析三种CAFs来源的外泌体的miRNA表达谱具有相似性,其中20种miRNAs(4%)表达上调程度较高,再从其中挑选出5个含量最丰富的miRNAs(miR-10a-5p, 92a-3p, 181a-5p, 191–5p, 92b-3p)。给予1, 25(OH)2D3处理后,CAFs分泌的外泌体中miR-10a-5p下调最明显。作者猜想有可能是1, 25(OH)2D3处理活化VDR信号后,抑制CAFs通过外泌体分泌miR-10a-5p传递到胰腺癌细胞(PC)。给予经1, 25(OH)2D3处理的CAFs来源的外泌体刺激PC细胞,PC细胞中的miR-10a-5p没有得到明显上调。miR-10a-5p-/- 肿瘤相关成纤维细胞(HPSC)来源的外泌体减弱了PC的侵袭和迁移能力,但是当在PC细胞中过表达miR-10a-5p后,这种侵袭和迁移能力可以被rescue。所以作者认为,VDR信号通路活化抑制外泌体分泌miR-10a-5p,至少是影响肿瘤和基质之间crosstalk的部分原因,而这个发现可作为前期Ferrer-Mayorga等人研究工作的重要补充。
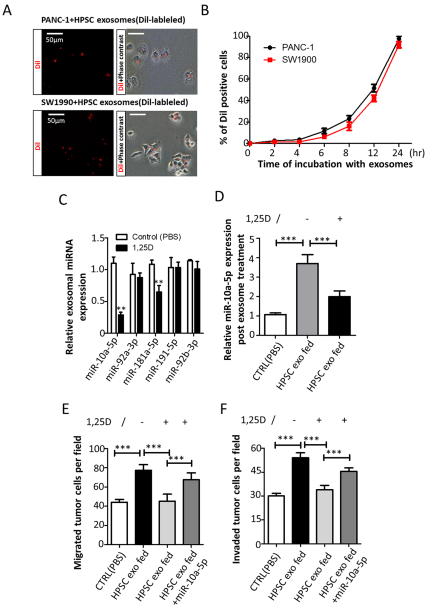
(A)HPSC来源外泌体经Dil标记后和PANC和SW1990细胞的荧光共定位结果;(B)HPSC来源外泌体经Dil标记后被PANC和SW1990摄取后,流式检测结果;(C)1, 25(OH)2D3刺激HPSCs细胞后,qRT-PCR检测其分泌外泌体中的miRNA表达情况;(D)1, 25(OH)2D3刺激或者不刺激HPSCs后,其分泌的外泌体与PANC-1共孵育后,qRT-PCR检测PANC-1细胞中miR-10a-5p的表达水平;1, 25(OH)2D3刺激或者不刺激HPSCs后,Transwell实验检测其分泌的外泌体与PANC-1共孵育后,PANC-1的迁移能力(E)和侵袭能力(F),以及在PC细胞中过表达miR-10a-5p后的rescue效应。
PS:本文之所以能发在Gut上,一来主要是作者的研究工作为前人的研究机制上作了重要的补充和完善;二来是作者发现的机制将外泌体、miRNA等热点主题与VDR信号抑制肿瘤的现象联系起来。
参考文献:
Kong F, et al. VDR signaling inhibits cancer-associated-fibroblasts’ release of exosomal miR-10a-5p and limits their supportive effects on pancreatic cancer cells[J]. Gut, 2018. DOI: 10.1136/gutjnl-2018-316627. PMID: 29695492
.png)
