4月3日,知名免疫学杂志Immunity在线发表了中科院生物物理所范祖森教授与王硕研究员为共同通讯作者的文章,介绍发现环形RNA Cia-cGAS(作者自己命名)定位于细胞核中,可结合DNA敏感的cGAMP合酶cGAS并抑制其活性,调控长效造血干细胞(LT-HSC)静息状态[1]。

介绍本文的内容之前需要补充几个背景知识点:
长效造血干细胞(Long-term Hematopoietic stem cells,LT-HSC):一种能持续自我更新和分化为下游造血细胞的干细胞,处于造血系统分化谱系(Lineage)的上游。
短效造血干细胞(short-term Hematopoietic stem cells,ST-HSC):在造血分化谱系中位于LT-HSC下游,自我更新能力弱于LT-HSC。
多潜能干细胞(multipotent progenitors,MPP):在造血分化谱系中位于LT-HSC下游,具有继续分化为淋巴系和髓系前体细胞的潜能,但失去自我更新能力。
cGAMP合酶(Cyclic GMP-AMP (cGAMP) synthasce,cGAS):通常位于胞质中,当结合DNA后催化生成cGAMP,后者与干扰素刺激因子(Stimulator of Interferon Genes,STING)结合,促进I型干扰素(IFN)的表达。
本文作者首先基于高通量测序比较了小鼠中LT-HSC,ST-HSC和MPPs中全转录组变化情况,这其中共发现了156种存在明显表达差异的circRNA分子,其中49种在LT-HSC中表现为上调。进一步的表达验证中发现有9种circRNA分子在LT-HSC中存在明显的上调。然后通过shRNA实验分析功能,发现其中只有来自D430042O09Rik的circRNA Cia-cGAS干扰后明显改变造血干细胞的亚群分布,因此锁定研究目标为Cia-cGAS分子。作者进一步验证了只有干扰Cia-cGAS才能有明显的效应,而单独干扰D430042O09Rik并无明显表型。然后基于迷你基因载验证,证明Cia-cGAS序列下游的反向互补序列是促进其生成的关键,于是作者通过Cas-9基因敲除策略成功构建了Cia-cGAS基因敲除小鼠。在Cia-cGAS基因敲除小鼠中作者发现LT-HSC明显减少,I型干扰素表达升高。通过RNA Pull-down实验,作者鉴定到Cia-cGAS可以与cGAS结合,又通过RIP,RNA Pull-down,FISH共定位以及EMSA等实验验证了这一相互作用,进一步,作者还通过预测分析结合突变实验分析了Cia-cGAS与cGAS相互作用的位点信息。酶学功能研究证明,Cia-cGAS与cGAS相互作用能够抑制cGAS的活性。
本文的故事非常严谨,逻辑清晰,为circRNA的功能研究提供了非常好的参考范本。下面就让我们一起学习一下作者如何一步步探究Cia-cGAS的功能和机制的:
作者如何找到Cia-cGAS的,为什么要研究其在造血干细胞中的功能?
为探索造血干细胞功能相关的circRNA分子,作者比较了小鼠的各种造血干细胞中全转录组的变化情况,找出了156种存在明显表达差异的circRNA分子,其中49种在LT-HSC中表现为上调。RNase R消化后QPCR分析其中有9种验证为明确在LT-HSC中表达上调的circRNA。
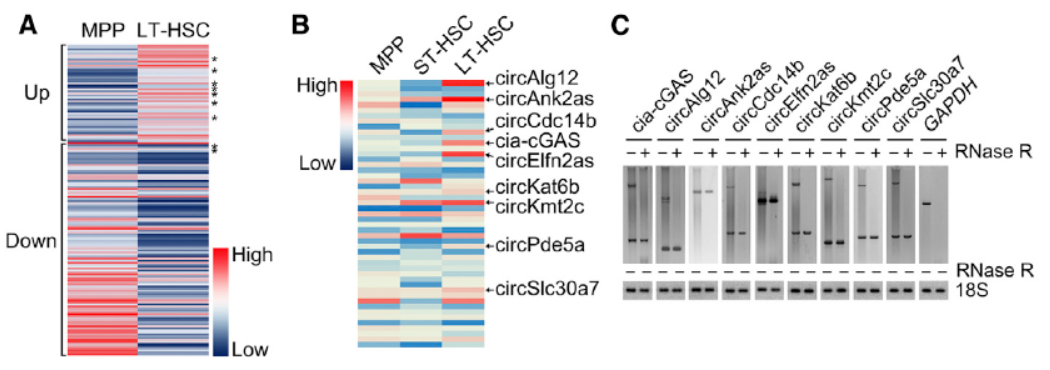
图1 测序筛选HSC相关circRNA分子 (来自[1])
为有效筛选到与造血干细胞功能有关的circRNA分子,作者体外感染对应circRNA的shRNA病毒,然后移植回小鼠体内(提前用射线照射杀死内源细胞),如果所对应的circRNA会明显影响造血干细胞的功能,在造血干细胞的亚群分布中便能得到体现,结果表明只有干扰Cia-cGAS后才能明显影响造血干细胞的亚群分布,表现为LSK祖细胞的明显增高,与此同时LT-HSC明显减少。因此,作者将研究对象锁定在Cia-cGAS分子。
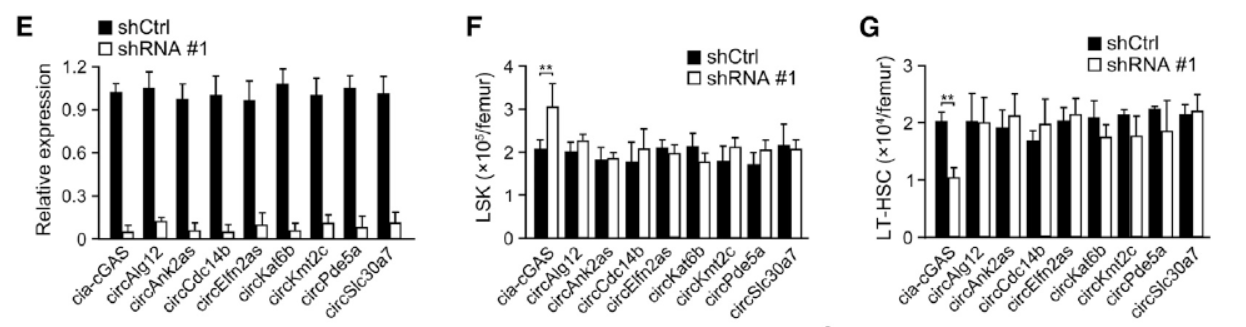
图2 干扰circRNA后对HSC亚群的影响分析 (来自[1])
与此同时,作者也进一步分析了Cia-cGAS的组织表达,进化保守性,亚细胞定位等基本信息。
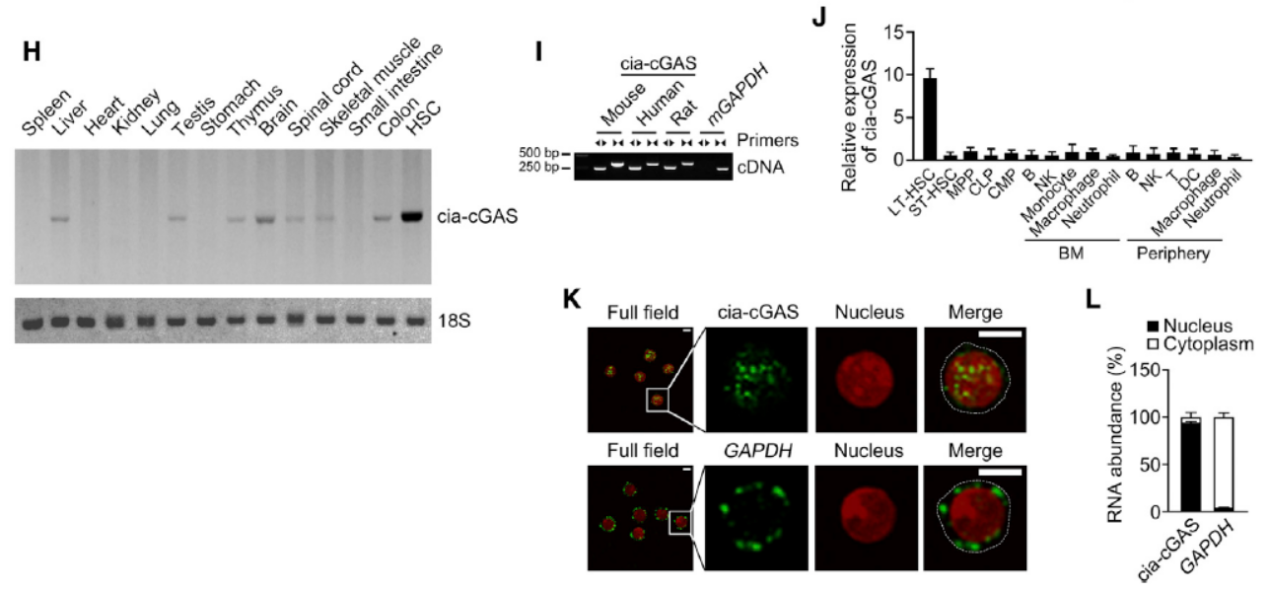
图3 Cia-cGAS的组织表达和进化保守性分析 (来自 [1])
Cia-cGAS来源于D430042O09Rik基因,那么上述的表型会不会是线性RNA的作用呢?作者分析后表明所使用的shRNA并不对线性RNA起作用,有趣的是线性的D430042O09Rik 产物RNA位于胞质中而Cia-cGAS主要位于细胞核内。进一步,专门针对线性D430042O09Rik的干扰RNA并不影响造血系统的亚群分布,但同时针对线性和环形RNA的干扰RNA则能明显影响造血干细胞亚群分布。
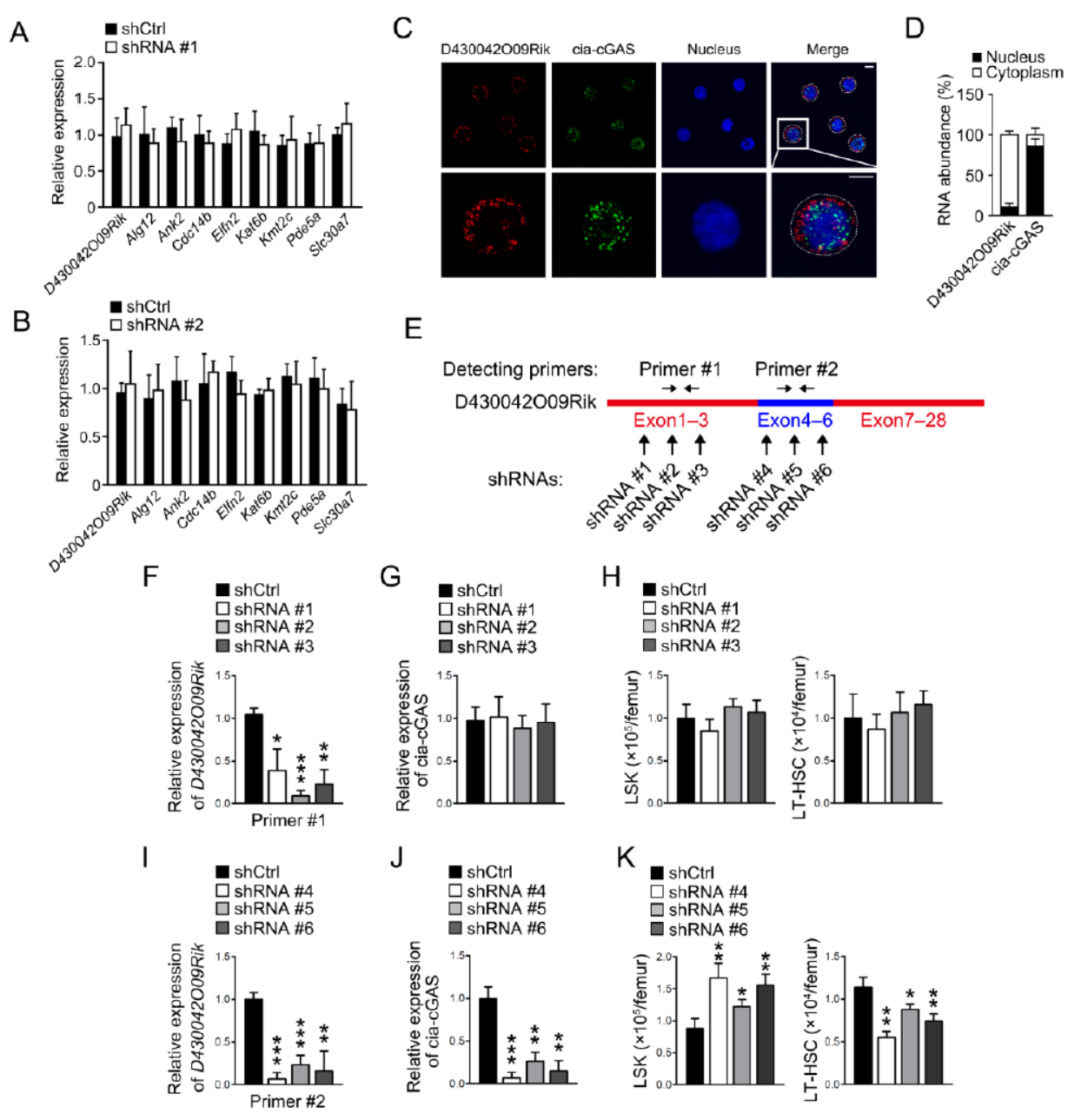
图4 仅有Cia-cGAS干扰后才影响HSC亚群分布 (来自[1])
Cia-cGAS敲除小鼠怎样构建的?敲除模型中的表型如何?
通过上述的实验,环形RNA Cia-cGAS是影响造血干细胞功能的关键,线性的D430042O09Rik基因RNA没有这一功能,因此如何构建特异性敲除Cia-cGAS是进一步探索其功能的关键。首先我们来认识一下Cia-cGAS和对应的母基因D430042O09Rik的关系,以及作者构建敲除Cia-cGAS的设计思路:
Cia-cGAS是由其母基因D430042O09Rik的4~6号外显子环化形成的,作者的敲除策略是删除下游内含子中反向互补序列相关的片段。
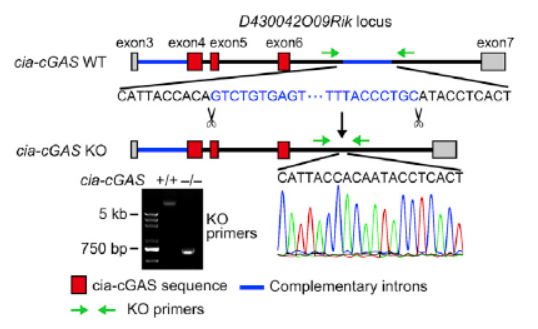
图5 Cia-cGAS敲除方案设计 (来自[1])
在构建基因敲除的小鼠之前,作者首先针对D430042O09Rik基因对应的内含子序列设计了迷你基因系统,分析与Cia-cGAS生成相关的内含子序列片段,结果证明在外显子4上游和外显子6下游的内含子中存在的反向互补序列是形成Cia-cGAS的关键,删除下游的反向互补序列能够实现特异性敲除Cia-cGAS。
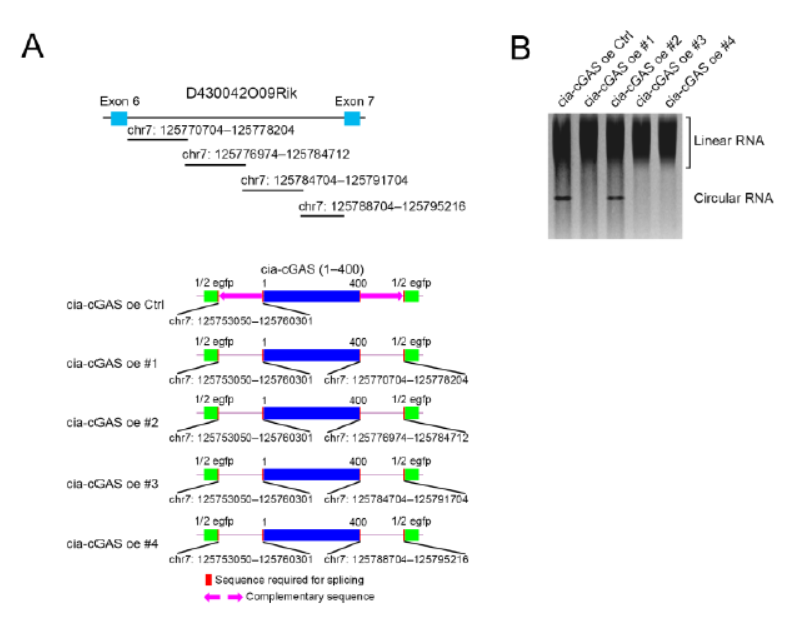
图6 迷你基因验证与Cia-cGAS生成有关的反向互补序列 (来自[1])
获得敲除Cia-cGAS的小鼠模型后,作者分析了造血干细胞的亚群分布等基本特征,结果表明敲除小鼠中LSK细胞明显增多,LT-HSC明显减少,这些小鼠出生6个月左右便死于贫血。Cia-cGAS敲除小鼠的LT-HSC的BrdU染色阳性率明显高于对照组,说明敲除小鼠中LT-HSC细胞处于活跃的增殖分裂活动。作者还通过脉冲标记H2B-GFP的小鼠模型分析了敲除小鼠中LT-HSC处于静息或活化状态的比例,结果也显示Cia-cGAS敲除后LT-HSC细胞处于明显的活跃状态,静息状态的比例显著降低。
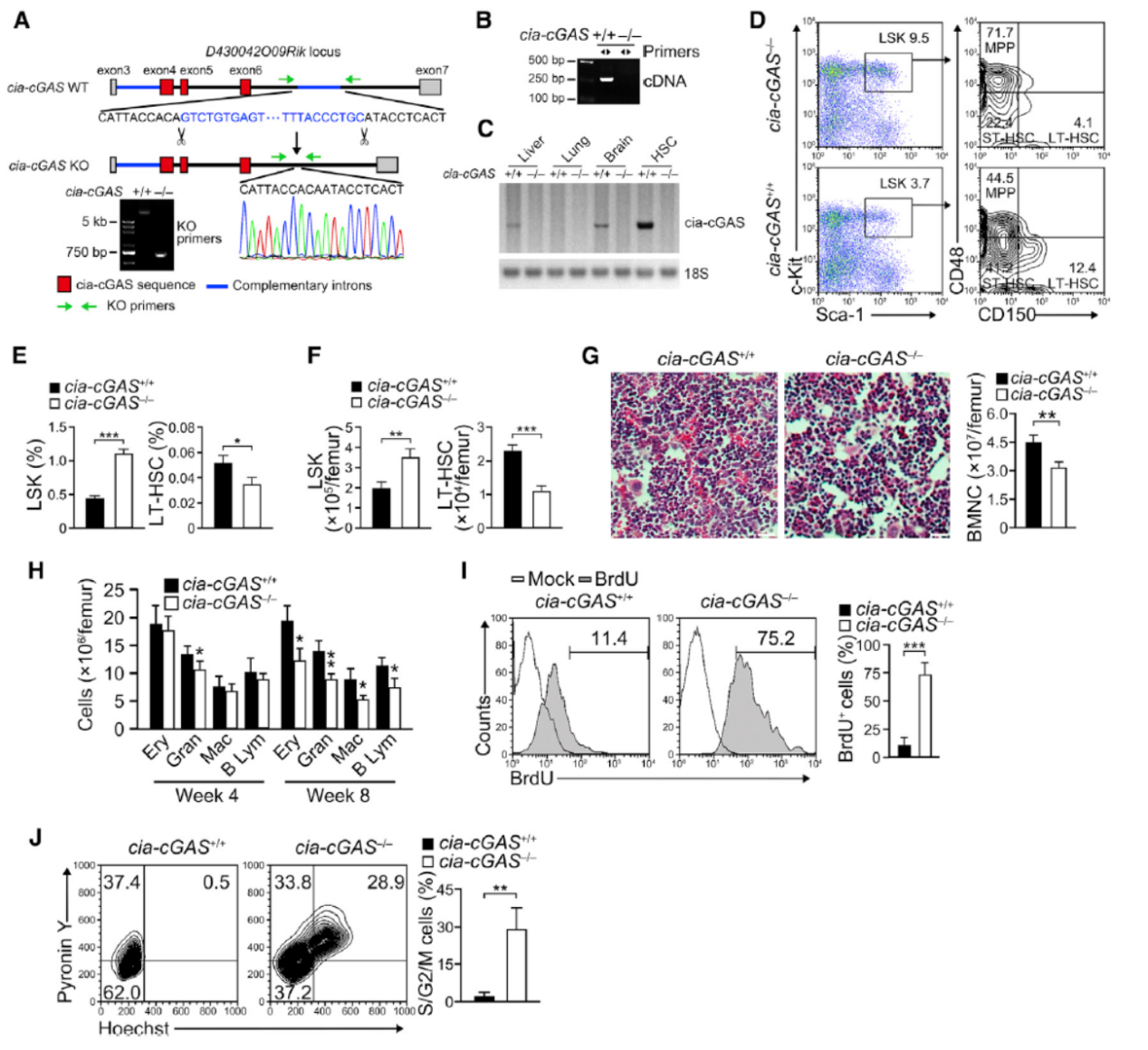
图7 Cia-cGAS敲除后LT-HSC细胞静息状态减少 (来自[1])
作者还发现敲除Cia-cGAS后I型干扰素的分泌增高。
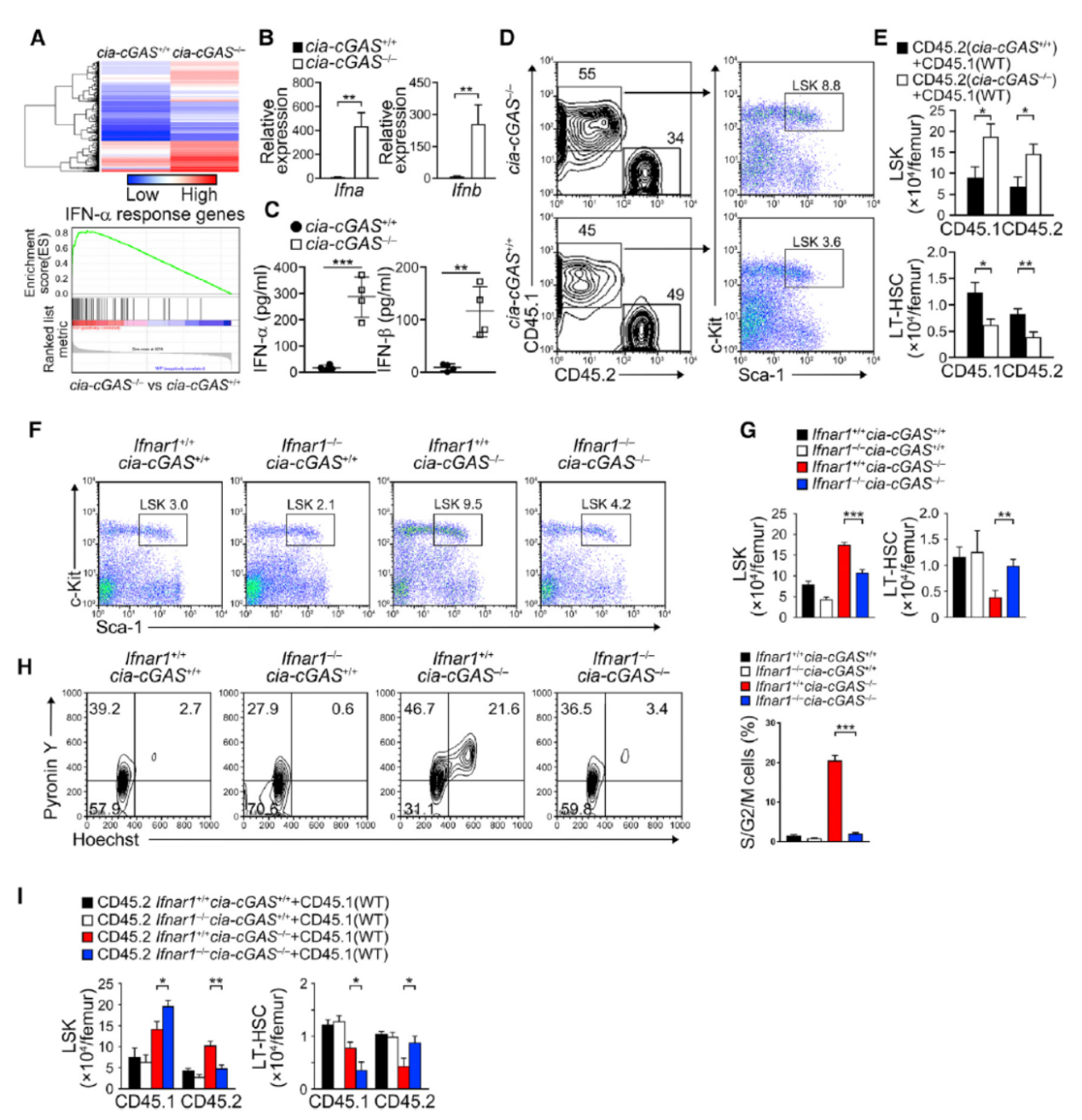
图8 敲除Cia-cGAS后I型干扰素的分泌增高 (来自[1])
如何筛选和鉴定Cia-cGAS的相互作用分子?
敲除Cia-cGAS模型的表型非常明显,那么Cia-cGAS是如何发挥功能的呢?与Cia-cGAS相互作用的分子筛选和鉴定是研究其功能的关键。作者的策略是首先通过RNA Pull-down初步筛选出互作分子,然后进一步验证。
circRNA的RNA Pull-down是非常有挑战性的实验,目前报道的数量还不多。作者的做法是先通过表达线性的Cia-cGAS进行初筛,然后进一步基于RIP和环形RNA的 RNA Pull-down验证,进一步通过突变分析相互作用的相关序列信息。
将circRNA的序列线性化表达,反义链作为对照,钓取的蛋白跑胶后银染,然后找出变化明显的条带质谱鉴定。通过这种方法,作者找到了cGAS蛋白。进一步通过抗cGAS抗体的RIP实验证明了cGAS与Cia-cGAS的确有相互作用。免疫荧光+FISH实验,进一步验证了这一相互作用。基于电泳迁移率改变实验(EMSA),作者通过构建Cia-cGAS的突变体,分析了相互作用的位点和片段信息。
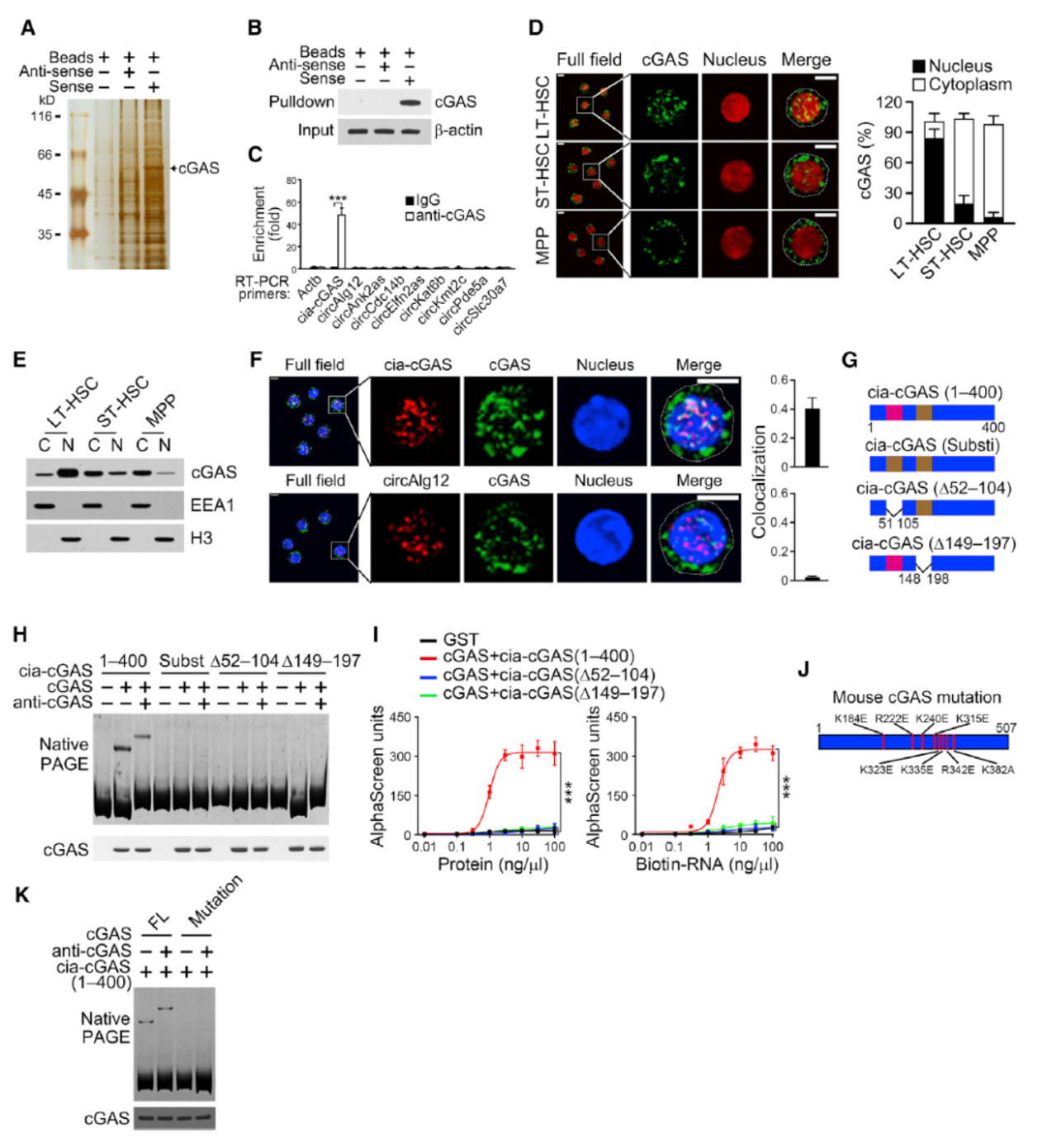
图9 筛选和鉴定Cia-cGAS的相互作用分子 (来自[1])
酶学实验证明Cia-cGAS结合cGAS能抑制cGAS的功能。
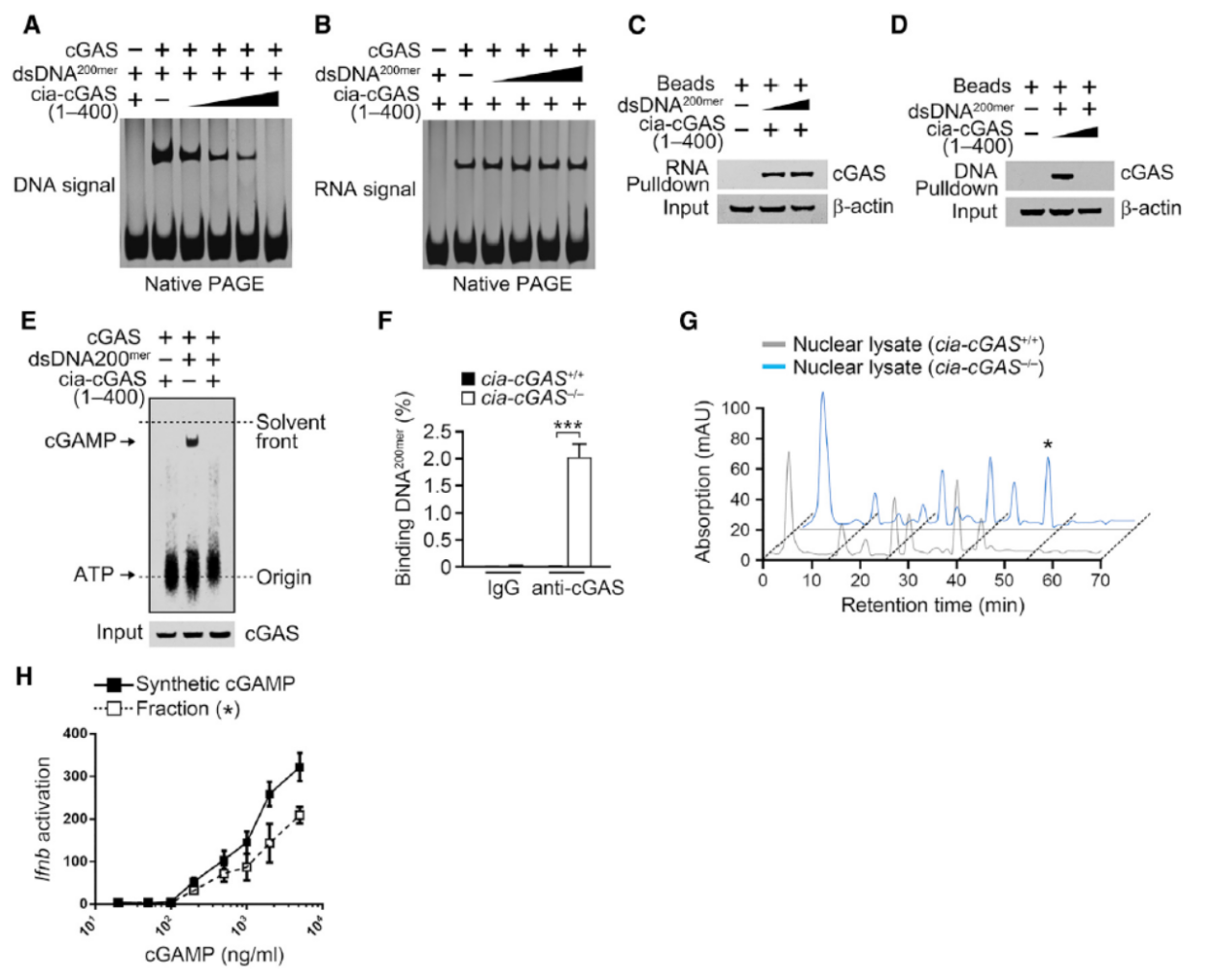
图10 Cia-cGAS结合cGAS抑制cGAS的功能 (来自[1])
此外,作者还进一步分析了Cia-cGAS结合并抑制cGAS的功能在小鼠HSC细胞干性维持,LT-HSC静息状态调控以及相关免疫机能调控中的作用,因为这方面的内容对circRNA功能研究的参考意义有限,感兴趣的读者可进一步查看原文,在此从略。
本文的主要结论
至此,本文得出了如下结论:LT-HSC中Cia-cGAS结合并抑制cGAS的活性,Cia-cGAS敲除可导致LT-HSC中I型IFN升高。 Cia-cGAS可以保护静息状态的LT-HSC免受因cGAS持续活化而导致的细胞资源耗竭。Cia-cGAS是cGAS介导的识别和自身免疫应答的有效抑制剂。
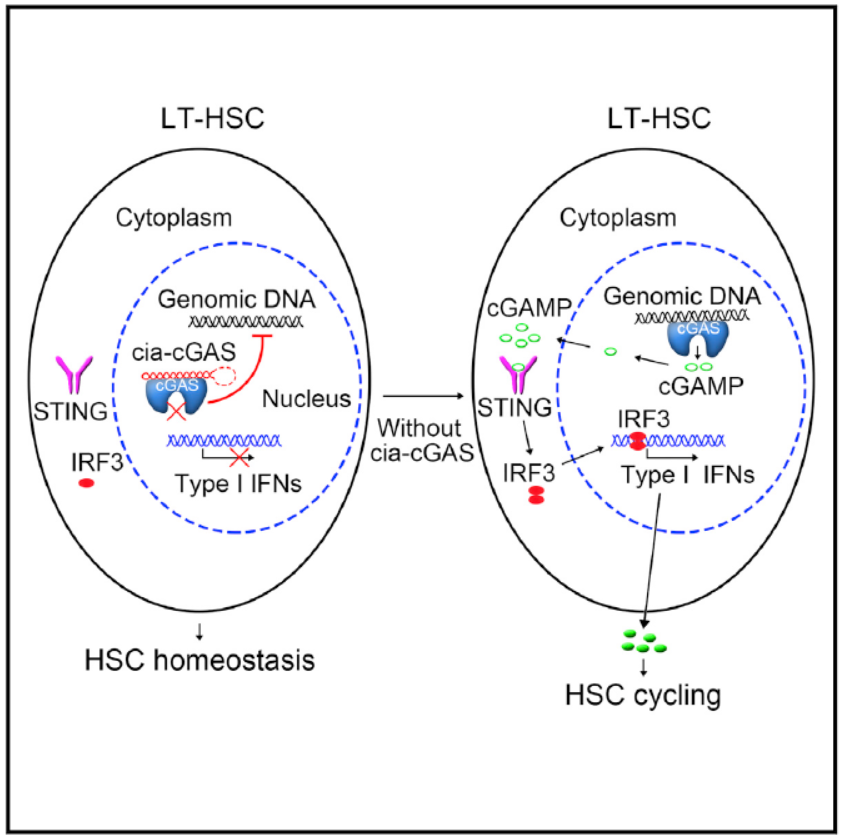
图11 Cia-cGAS主要功能模式图 (来自[1])
本文通过高通量测序筛选与造血干细胞干性维持相关的关键circRNA分子,进一步经过RNA干扰验证了相关功能并锁定待研究的目标分子,通过敲除内含子反向互补序列的策略构建了circRNA的敲除小鼠模型,验证了Cia-cGAS在造血干细胞中的功能。基于RNA Pull-down筛选可能与Cia-cGAS相互作用的蛋白并进一步通过RIP,RNA Pull-down,FISH共定位及EMSA实验验证了相互作用并分析了相互作用相关的具体信息。思路清晰,逻辑严谨。为circRNA的功能研究提供了非常有价值的范本,值得各位同行好好学习。
参考文献:
1. Pengyan Xia, S.W., Buqing Ye, Ying Du, Chong Li, Zhen Xiong, Yuan Qu and Zusen Fan, A Circular RNA Protects Dormant Hematopoietic Stem Cells from DNA Sensor cGAS-Mediated Exhaustion. Immunity, 2018.
.png)