1月15日,Nature Immunology在线发表了中科院生物物理所田勇教授和范祖森教授为共同通讯作者的文章,介绍发现来自Pan3基因的环状RNA circPan3在IL-13调控的肠道干细胞自我更新过程中发挥重要调控作用[1]。

文章基于高通量测序在Lgr5+的肠道干细胞(Intestinal stem cells,ISCs))中分析干细胞特有的circRNA分子,共找到10个circRNA,然后基于shRNA分别干扰后看对ISCs 的类器官形成能力(Organoid formation)影响情况,发现来自Pan3基因第2-5外显子的circRNA (circPan3)能够显著影响CD45+细胞共培养条件下的类器官形成,因此本文将研究分子锁定在circPan3。作者进一步基于circPan3基因敲除小鼠,确认了体内circPan3参与了免疫细胞介导的ISCs自我更新。机制方面,circPan3结合IL-13Rα1的mRNA并促进其稳定,IL13结合并激活下游通路,激活Foxp1的表达,再通过促进β-Catenin入核,参与Lgr5+ISCs的自我更新[1]。本文通过基因敲除模型严谨的证明了circPan3在ISCs自我更新过程中的作用,丰富了对免疫细胞介导的ISCs自我更新作用的认识,对于circRNA的功能研究和ISCs干性机制都具有重要意义[1]。下面让我们首先学习一下作者如何构建circPan3的基因敲除小鼠的,然后再详细了解一下他们如何筛选到这个分子,然后验证其体内功能,如何开展机制研究的:
circPan3敲除模型如何构建的?
小鼠中不存在Alu序列,促进circRNA形成的往往是一些SINE元件,因此作者需要首先确认需要打靶的circRNA是由什么序列介导形成circRNA的。作者的策略是在小鼠的Lgr5+ISCs细胞中通过慢病毒载体构建mini-gene,模拟体内成环的过程。基于这一技术路线,可以通过构建删除特定内含子片段分析介导所感兴趣的circRNA由哪些序列元件介导的。作者就是通过这种技术路线找出了介导circPan3生成的内含子序列,如下图中a所示的#1和#2位置,Northern杂交也证明了删除#2的mini-gene不再表达circPan3。有了这个基础才能设计出专门针对circPan3的敲除方案,作者设计了靶向#2位置的打靶体系,最终获得了准确删除该位点的小鼠,经过鉴定,该小鼠中circPan3被准确敲除,与此同时,Pan3基因的其他转录产物(下图f中靠上侧的一坨)没有受到明显的影响,Pan3蛋白也没有明显的变化。本文的这个circRNA敲除模型非常有意义,为广大同仁设计circRNA的敲除模型提供了难得的参考依据,非常值得学习。
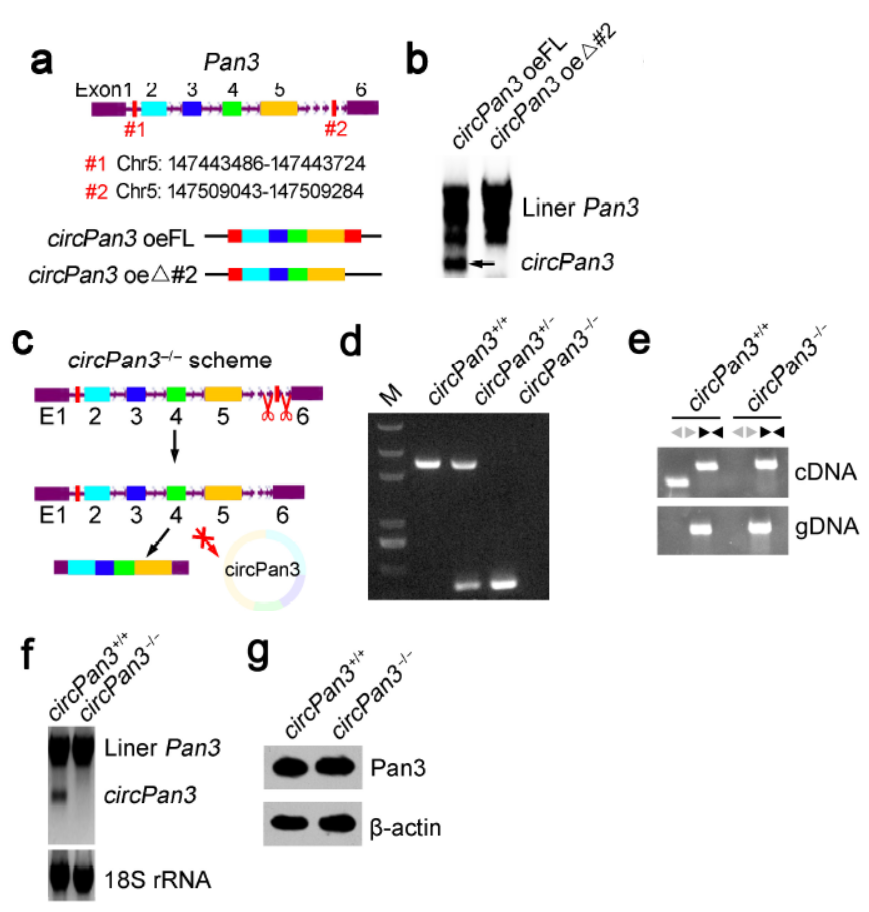
图1 circPan3敲除模型构建策略 (来自[1],排列有改动)
如何发现circPan3的?
接下来,让我们回到一开始,了解一下作者是如何找到这个circRNA分子以及如何一步步验证其功能和机制的。
肠道是体内细胞更新速度较快的组织之一,小鼠中平均5天可更新一遍。肠道干细胞(ISCs)是这些细胞更新的主要来源。之前的研究表明ISCs可以在免疫细胞刺激的条件下激活自我更新,但相关机制不甚明了。作者通过Lgr5-GFP的小鼠分离肠道干细胞,该模型能够特异性的仅在ISCs中表达GFP,通过流式分选可以获得高纯度的肠道干细胞。高通量测序后发现有10种ISCs显著高表达的circRNA分子。
接下来,作者针对10个circRNA分子分别构建了shRNA载体,分析与ISCs自我更新有关的circRNA分子,一开始在普通的条件下没有一个circRNA分子有显著的表型,然而,在有CD45+细胞共培养的条件下,发现circPan3敲降后显著影响了ISCs形成类器官的效率,其他的circRNA分子均不明显。因此基于这个体外实验,一方面找到了感兴趣的circRNA分子,还同时发现了这个分子发挥功能的条件。
紧接着,作者还验证了circPan3编码潜能,并构建了从circPan3潜在的起始密码子位置插入的RFP荧光蛋白,Western实验证明了所插入的RFP确实可以被翻译。基于这一结果,作者构建了circPan3-RFP的小鼠模型,只有准确成环的circPan3才能发红光,因此成为体内模型中跟踪circPan3表达的有效工具。组织切片和肠道干细胞培养实验表明circPan3主要在肠道干细胞中表达。
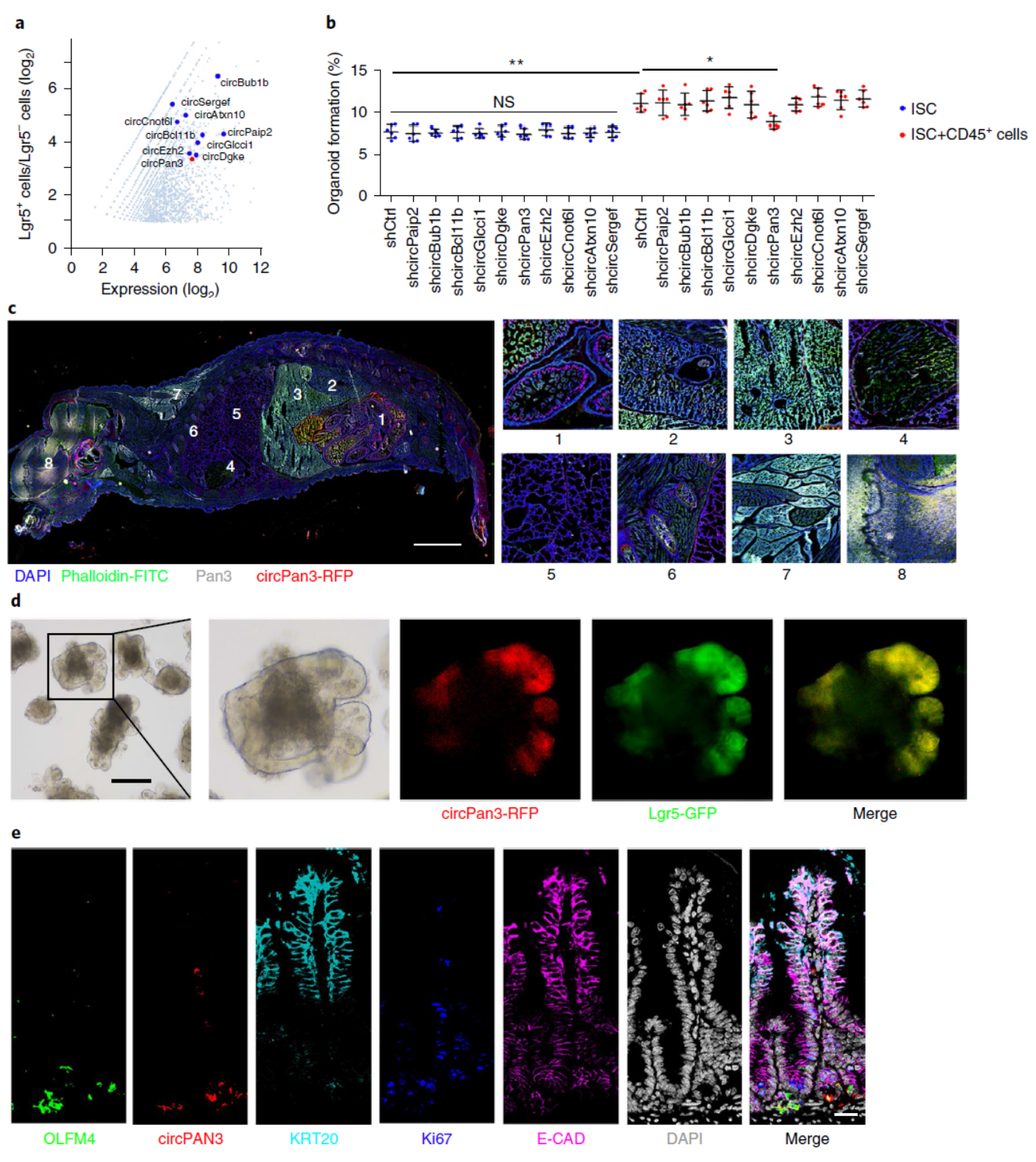
图2 circPan3鉴定与体内表达分析 (来自[1])
如何证明circPan3在体内参与ISCs的自我更新的?
前期的实验表明只有在CD45+细胞共培养的体系中circPan3才参与ISCs的自我更新,那么这个过程该如何在老鼠模型中验证呢?作者首先分析了circPan3敲除老鼠的肠道组织发生什么变化,组织切片表明circPan3敲除后肠绒毛明显变短,肠隐窝数量明显减少,ISCs细胞数目也明显减少,说明circPan3的确与肠道发育有关系。此外,作者还通过小鼠杂交,获得了Lgr5-GFP,Rosa26-lsl−lacZ,circPan3−/− 的小鼠模型,该小鼠中仅在Lgr5+的ISCs中可通过他莫昔芬诱导(TAM)表达Cre酶,Cre酶诱导LacZ表达,可以通过半乳糖苷酶染色准确示踪肠道干细胞的位置。结果表明circPan3敲除的小鼠肠道中ISCs显著减少。射线诱导肠上皮损伤后circPan3敲除的小鼠肠道无法正常修复。Rag1基因敲除的小鼠缺失B细胞和T细胞,硫酸葡聚糖钠盐(DSS)能诱导急性结肠炎。在Rag1基因敲除的小鼠中利用DSS诱导肠炎,然后移植体外培养的Lgr5+的ISCs类器官可以缓解该症状,但circPan3敲除小鼠来源的ISCs相对于circPan3正常细胞和PBS对照组,体重恢复明显降低。这说明免疫系统异常的小鼠中circPan3也不能有效发挥作用。
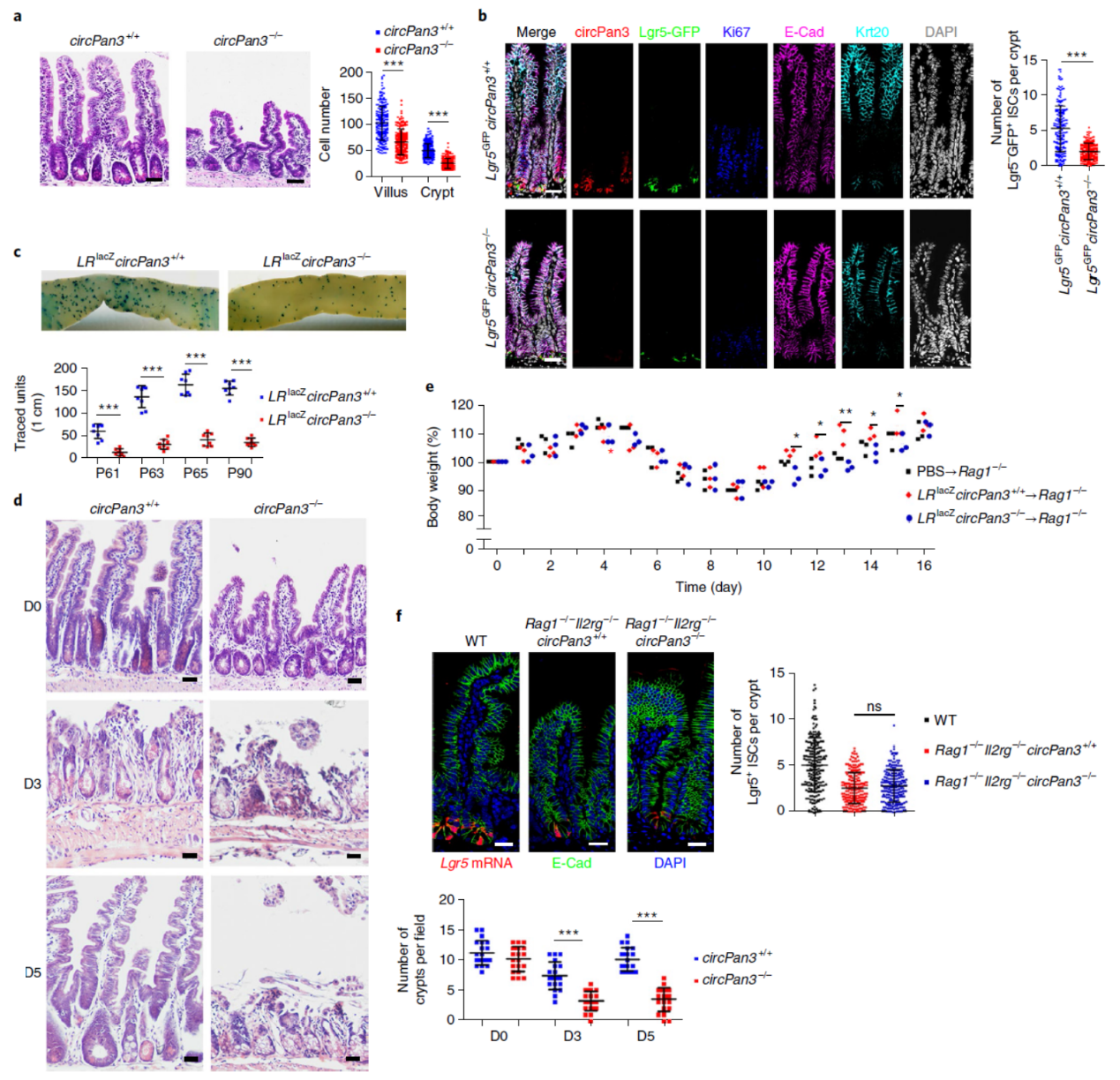
图3 circPan3敲除小鼠中ISCs减少 (来自[1])
circRNA发挥功能主要的机制包括竞争性结合miRNA,结合蛋白复合物及直接翻译多肽等,作者构建了将预测的ORF起始密码子突变为CTG的小鼠模型,发现没有明显的肠道干细胞异常表型。又通过与Rag1−/−,Il2rg−/−双敲除小鼠杂交(该小鼠B细胞,T细胞,NK细胞和先天性淋巴细胞(ILCs细胞)均不能正常发育)。组织切片分析表明杂交后的小鼠circPan3野生型和敲除小鼠的ISCs均显著减少,说明circPan3参与ISCs的自我更新依赖于CD45+的免疫细胞。
circPan3发挥功能的机制是什么?
为分析circPan3调控ISCs自我更新的机制,作者首先通过RNA-seq分析了circPan3敲除与否的ISCs中基因表达状况,分析表明circPan3敲除后有741种基因显著下调,870种基因显著上调(变化大于2倍)。作者挑选了敲除后下调最显著的10个基因,构建shRNA载体,在野生型ISCs中分析与自我更新有关的基因,最后发现了IL-13Rα1在干扰敲降后能明显抑制ISCs的类器官形成速率。组织切片中染色分析表明IL-13Rα1往往在Lgr5阳性的细胞中表达。荧光素酶报告基因实验排除了IL-13Rα1的mRNA在circPan3敲除后表达下调的可能性。RNA Pull-down实验证明circPan3能够结合L-13Rα1的mRNA,EMSA实验进一步证实了这个现象。放线菌素D处理后分析RNA降解实验表明circPan3能够促进L-13Rα1的mRNA稳定性。作者同时还做了突变分析,表明突变后circPan3不再具有结合L-13Rα1的mRNA的能力。
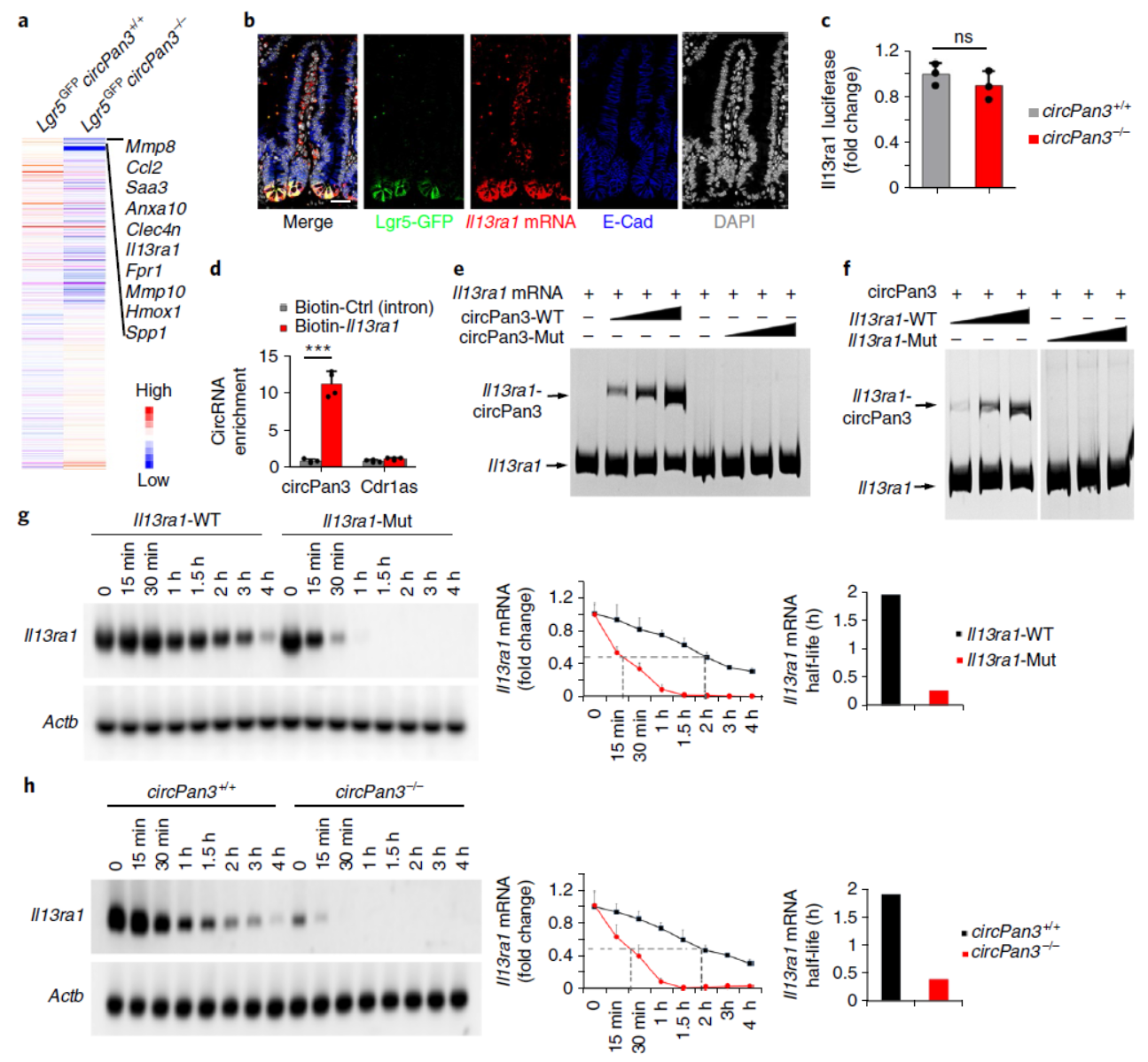
图4 circPan3结合IL-13Rα1的mRNA促进其稳定性 (来自[1])
利用捕获IL-13Rα1的mRNA的探针进行RNA Pull-down实验,表明在circPan3敲除的ISCs中富集了一种蛋白,Ksrp。Western和突变实验验证了Ksrp与circPan3及IL-13Rα1的mRNA的相互作用。
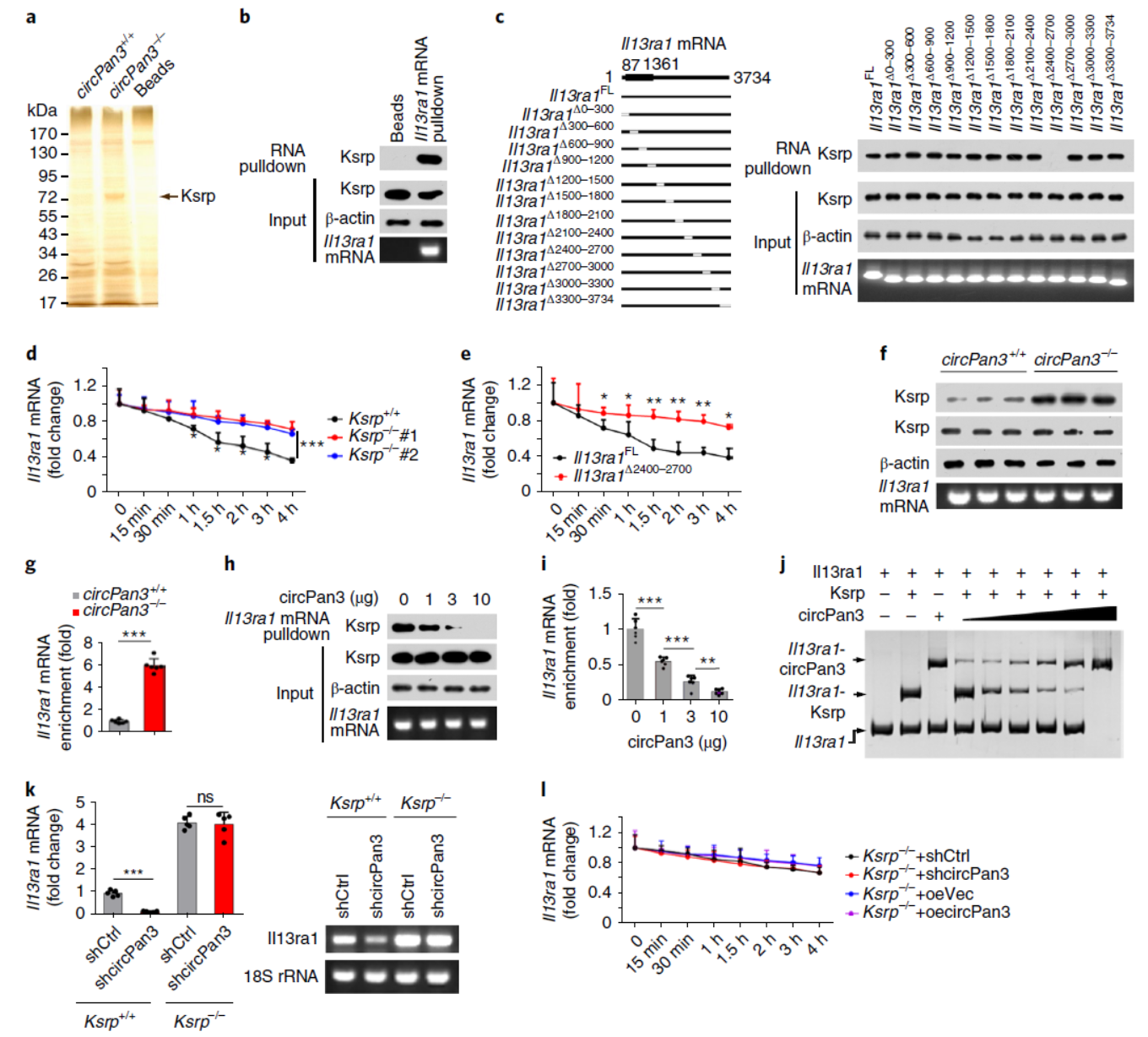
图5 circPan3结合Ksrp,促进IL-13Rα1的mRNA其稳定性 (来自[1])
IL-13Rα1是否在ISCs自我更新中起重要作用呢?作者构建了IL-13Rα1的敲除小鼠模型,结果表明IL-13Rα1敲除后ISCs数量显著减少。
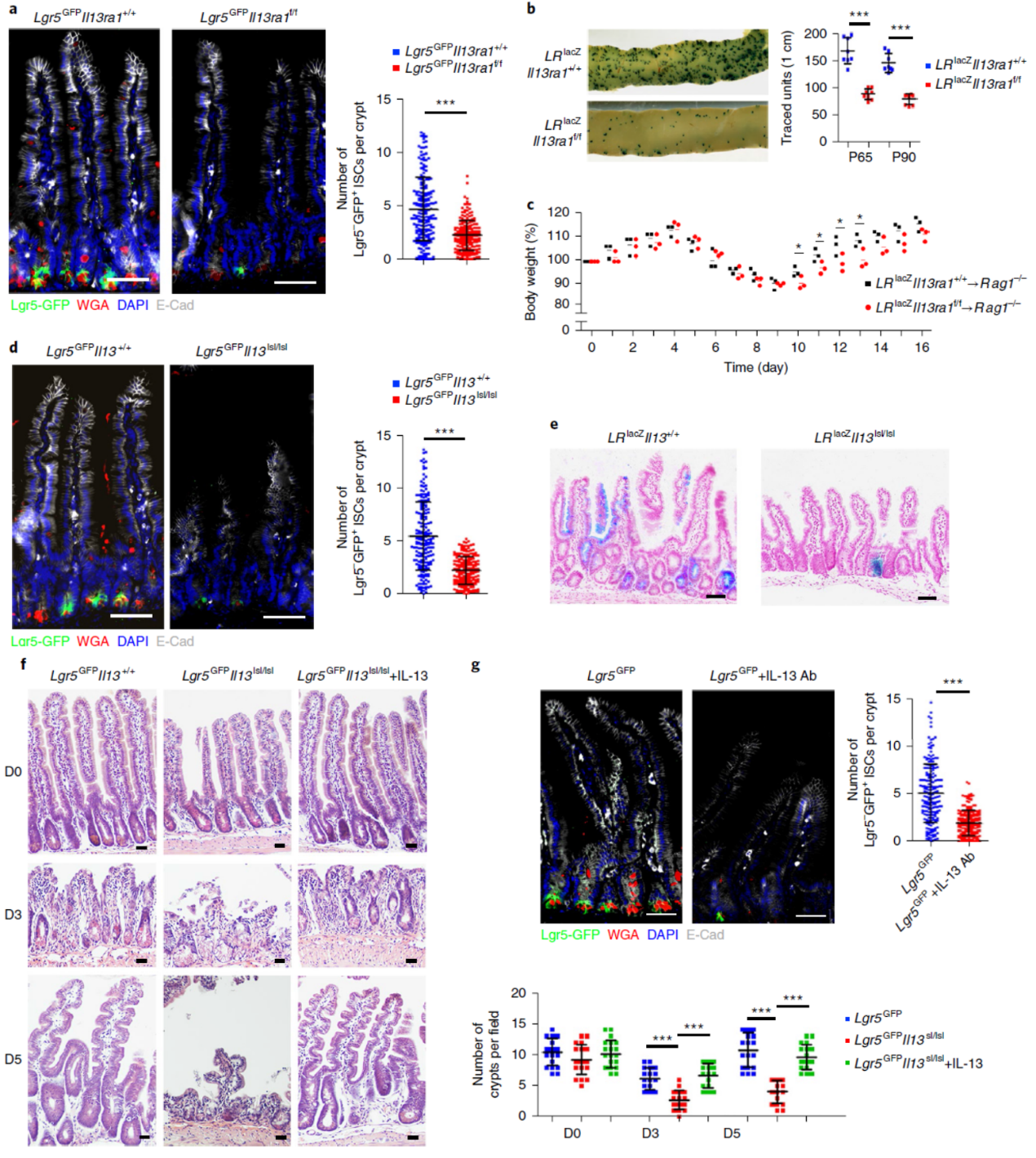 图6 IL-13Rα1在ISCs自我更新中起重要作用 (来自[1])
图6 IL-13Rα1在ISCs自我更新中起重要作用 (来自[1])
进一步,作者分析了体内IL13的来源,通过分析不同亚群的细胞,表明2型先天性淋巴细胞(ILC2)是调控肠道干细胞中IL-13Rα1的IL13的主要来源。
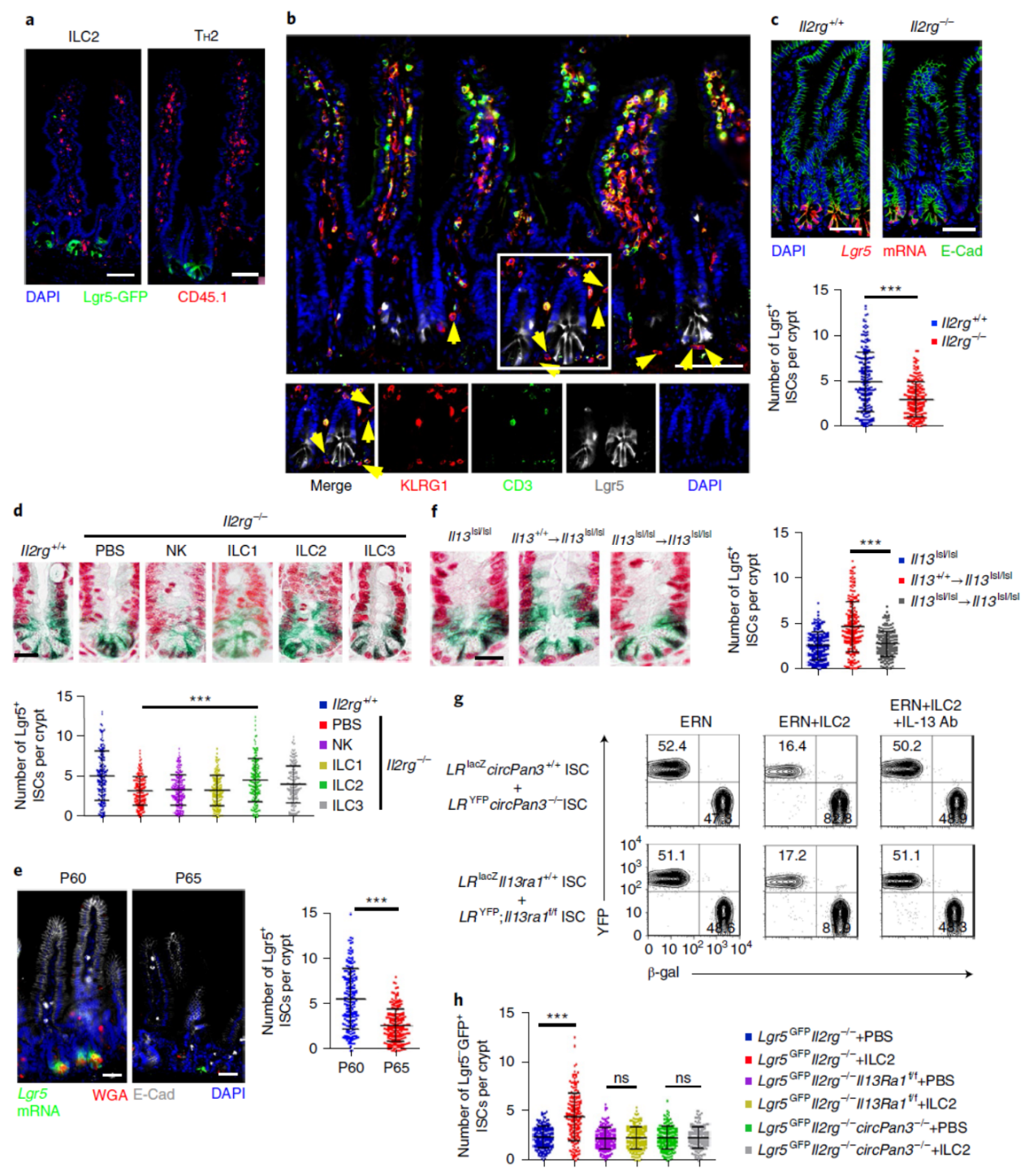
图7 ILC2来源的IL-13调控肠道干细胞干性 (来自[1])
最后作者探究了IL-13调控肠道干细胞干性维持的分子机制,结果表明FoxP1介导了β-Catenin的入核是IL-13介导的circPan3参与的肠道干细胞干性维持机制。
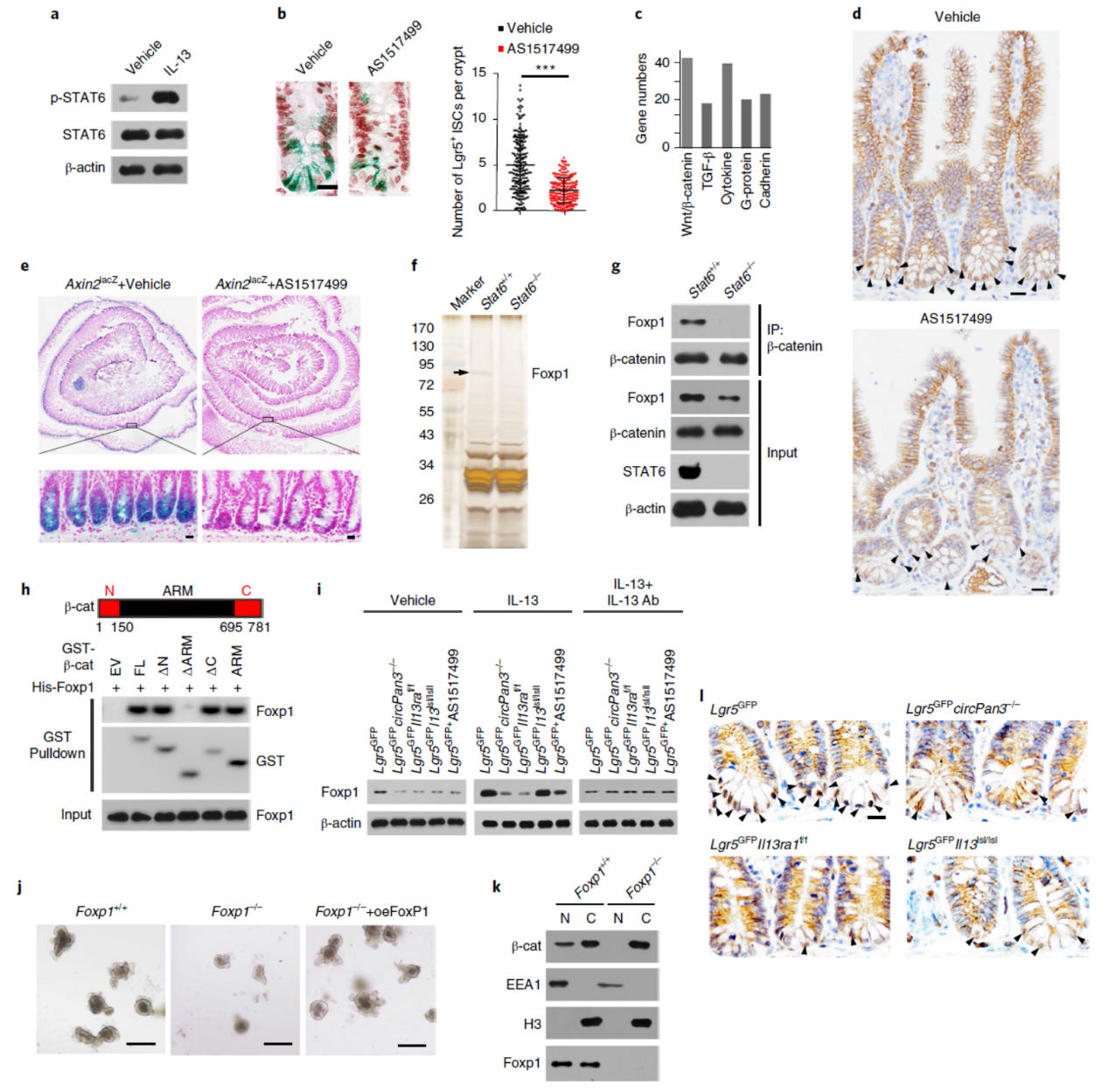
图8 FoxP1介导circPan3介导的肠道干细胞干性维持机制 (来自[1])
本文通过构建多种基因改造小鼠模型,从参与调控肠道干细胞干性的circRNA分子入手,找到了体内调控ISCs干性的重要分子机制通路,对于circRNA功能研究和肠道干细胞干性维持的基本机制都有重要借鉴意义。
本文的构建circRNA敲除小鼠的技术策略非常值得学习,目前限制circRNA研究的一个重要瓶颈便是无法有效获得特异性敲除circRNA的模型,本文的做法提供了非常好的借鉴。此外,本文的基于circRNA表达RFP的技术也有助于实现原位示踪circRNA的作用,也值得学习。
总之,本文是circRNA功能研究的重要标杆性成果,2019年circRNA研究实现了开门红。
参考文献
1. Pingping Zhu, X.Z., Jiayi Wu, Luyun He, Tiankun Lu, Yanying Wang, Benyu Liu, Buqing Ye, Lei Sun, Dongdong Fan, Jing Wang, Liuliu Yang, Xiwen Qin, Ying Du, Chong Li, Lei He, Weizheng Ren, Xin Wu, Yong Tian and Zusen Fan, IL-13 secreted by ILC2s promotes the self-renewal of intestinal stem cells through circular RNA circPan3. Nature Immunology, 2019.
.png)
