以m6A为代表的RNA的转录后修饰是近期研究的热点方向之一。2月11日,内华达大学里诺医学院Wei Yan和Chong Tang为共同通讯作者,在Cell Research杂志在线发表了一项circRNA m6A修饰的重要文章,报道发现小鼠雄性生殖细胞发育过程中m6A修饰可促进携带ORF的circRNA的生成([1])。

线性RNA的m6A修饰研究比较系统全面,已知在mRNA中,m6A修饰可以调控RNA的转录和可变剪切,高级结构,出核,稳定性和翻译,存在组织和疾病特异性的修饰状态变化。这些现象大部分在circRNA中有类似的发现,但关于m6A与circRNA的生成和高级结构的关系此前一直没有相关的报道。本文的报道表明m6A修饰也可以调控circRNA的生成,增加了对m6A修饰在circRNA中功能的认识。
此前,已发表的circRNA的m6A修饰的功能主要包括:
m6A可以启动circRNA的翻译(推荐阅读:重磅!m6A修饰促进环状RNA翻译)
circRNA的m6A修饰存在细胞和疾病特异性(推荐阅读:重大发现:circRNA存在细胞特异性的m6A修饰;BioRxiv:HPH模型中circRNA的m6A修饰)
m6A介导circRNA的降解(推荐阅读:m6A介导mRNA和circRNA的降解)
m6A介导circRNA出核(推荐阅读:circRNA的m6A修饰再发一篇Nature Communications文章)
本文报道发现在精子发生过程中减数分裂后的粗线期到圆形细胞的时期会生成大量circRNA,其中一些circRNA的反向拼接位点(junction point)两侧往往携带高水平的m6A修饰,而m6A经常会富集在mRNA的ORF起始密码子和终止密码子周围。有趣的是,作者发现,近半数的这类circRNA携带较长的ORF,这些ORF的起始密码子被m6A修饰,可结合核糖体。作者利用液质联用证明了上百种这类circRNA跨接口ORF的翻译产物。这一发现不仅证明了m6A可以介导circRNA的生成,还发现了一种全新的依赖circRNA实现线性RNA丢失后蛋白产物的稳定表达机制。
精子发生过程circRNA表达情况
早期研究发现,精子发生过程中,粗线期以后会出现RNA产物变短和包装进入RNP颗粒的现象,RNA产物变短可能与可变剪切的增加或一些RNA降解机制有关,而RNP颗粒则可以保护一些特殊的mRNA避免被降解,以维持一些重要蛋白的表达。为系统研究精子发生过程中全转录组的变化情况,作者选择粗线期,圆形细胞期和精子延长后的RNA进行全转录组分析和RNase R处理后的circRNA测序分析,结果表明随着精子发生过程的进展,circRNA的丰度呈现增高趋势,而这些circRNA所对应的线性mRNA却是下降的。
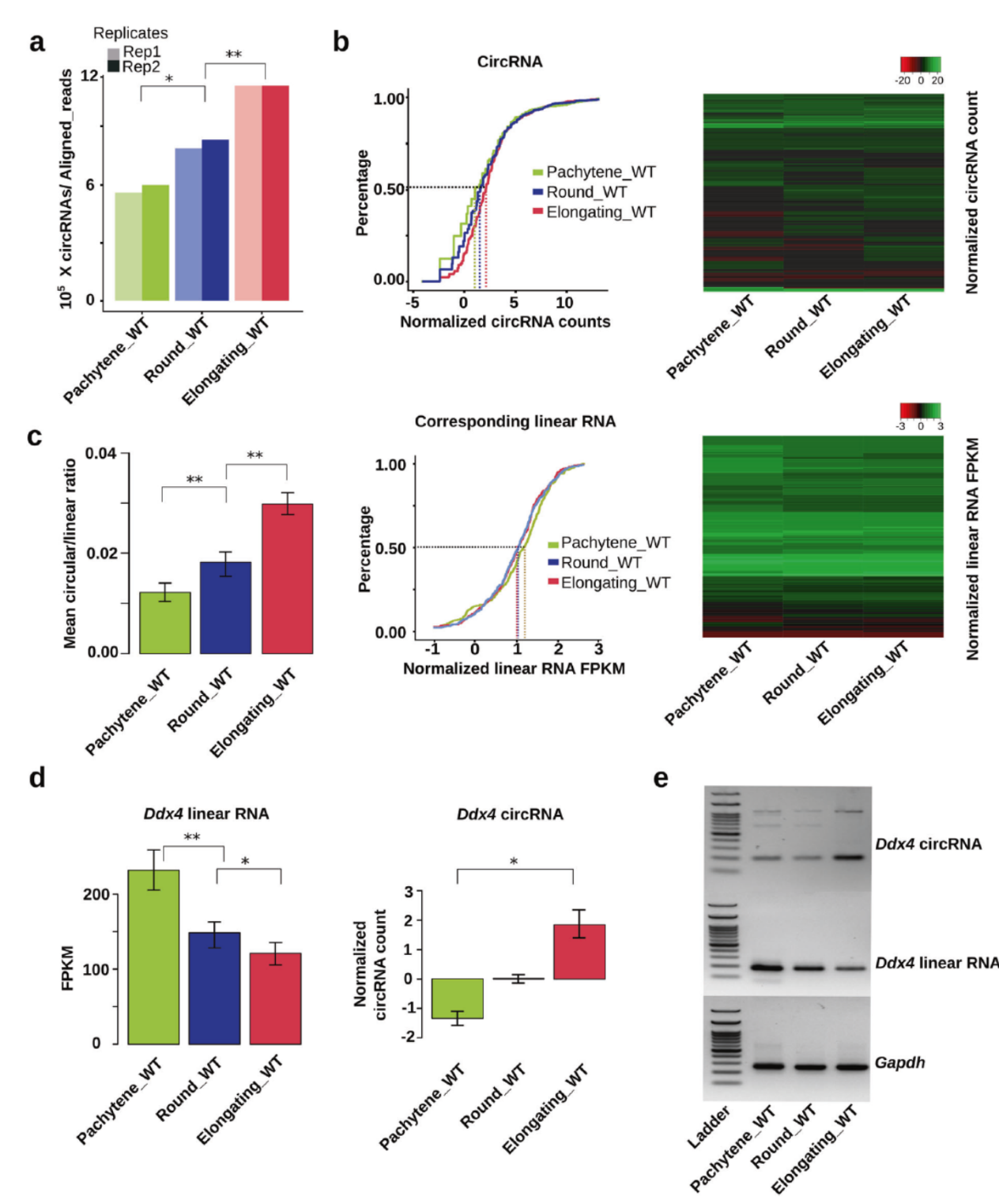
图1 精子发生过程中circRNA表达增高 ([1])
精子发生过程中circRNA生成与m6A修饰有关
作者发现随着精子发生过程进展,Alkbh5基因表达下调,Alkbh5基因敲除小鼠中精子发生过程从粗线期,圆形细胞期到精子延长阶段的circRNA表达会大幅增高。Anti-m6A RIP-seq测序分析表明,随着精子发生的进展,circRNA拼接位点处的m6A修饰呈现增加趋势。
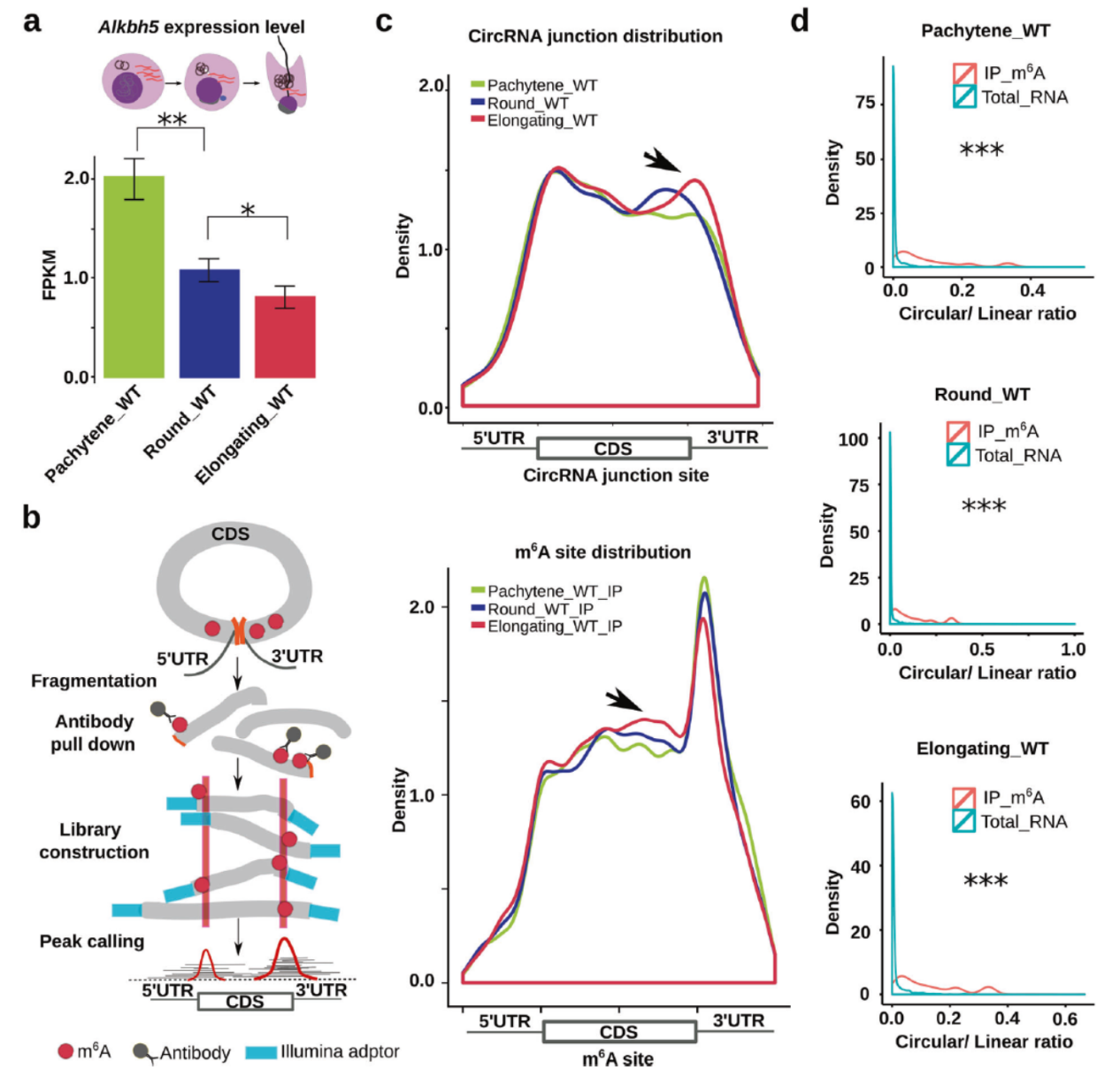
图2 精子发生过程circRNA的增加与m6A状态有关 ([1])
精子发生过程中一部分外显子circRNA带有m6A起始密码子的跨接口ORF
进一步分析这些circRNA分子,作者发现它们很多都是从mRNA的CDS区起始密码子和终止密码子周围形成的,这些circRNA的拼接位点更多的倾向于恰好分布在CDS的其实和终止密码子附近,并且这种携带了起始或终止密码子的circRNA随着精子发生的过程而呈现增加的趋势。如果这些circRNA恰好包含了全长的CDS,就有可能存在这样的机制:在精子发生的后期,细胞通过将RNA产物转变成circRNA来弥补由于mRNA大量降解导致的蛋白翻译模板不足,也就意味着在精子发生的后期,一些重要的蛋白是通过形成circRNA来维持其表达状态的。Anti-m6A RIP-seq数据表明随着精子发生过程进展,携带m6A的circRNA数目增加,并且这些circRNA更倾向于携带来源基因的起始或终止密码子。核糖体测序和分离RNP后测序结果表明 ,随着精子发生进展,Polysome结合的circRNA数目有所增加,结合着RNP颗粒中的circRNA也显著增多。这是否预示着,circRNA也可以存在通过RNP结合并逐步释放进行蛋白的表达?
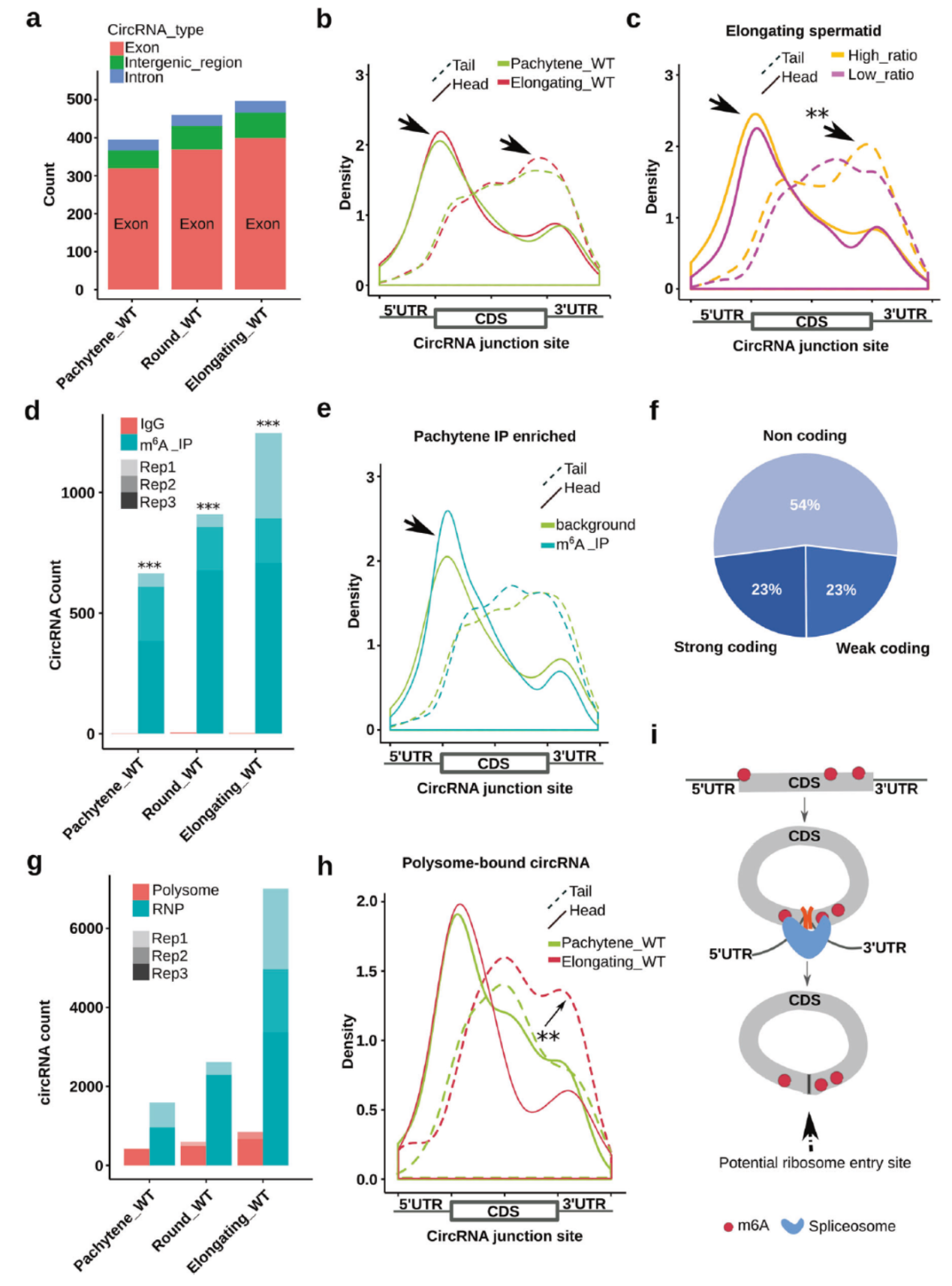
图3 一部分circRNA携带m6A修饰的跨接口ORF ([1])
精子发生过程中circRNA可包装进入RNP并可释放后结合核糖体
基于上述的发现,作者分析了精子发生的不同阶段circRNA结合在RNP中和结合核糖体的情况,结果显示随着精子发生的进展,更多的circRNA会从RNP颗粒中释放出来,结合核糖体,而它们所对应的线性RNA则逐渐被降解。ATAC-seq分析表明和粗线期相比,圆形细胞期的染色质松散性更低。
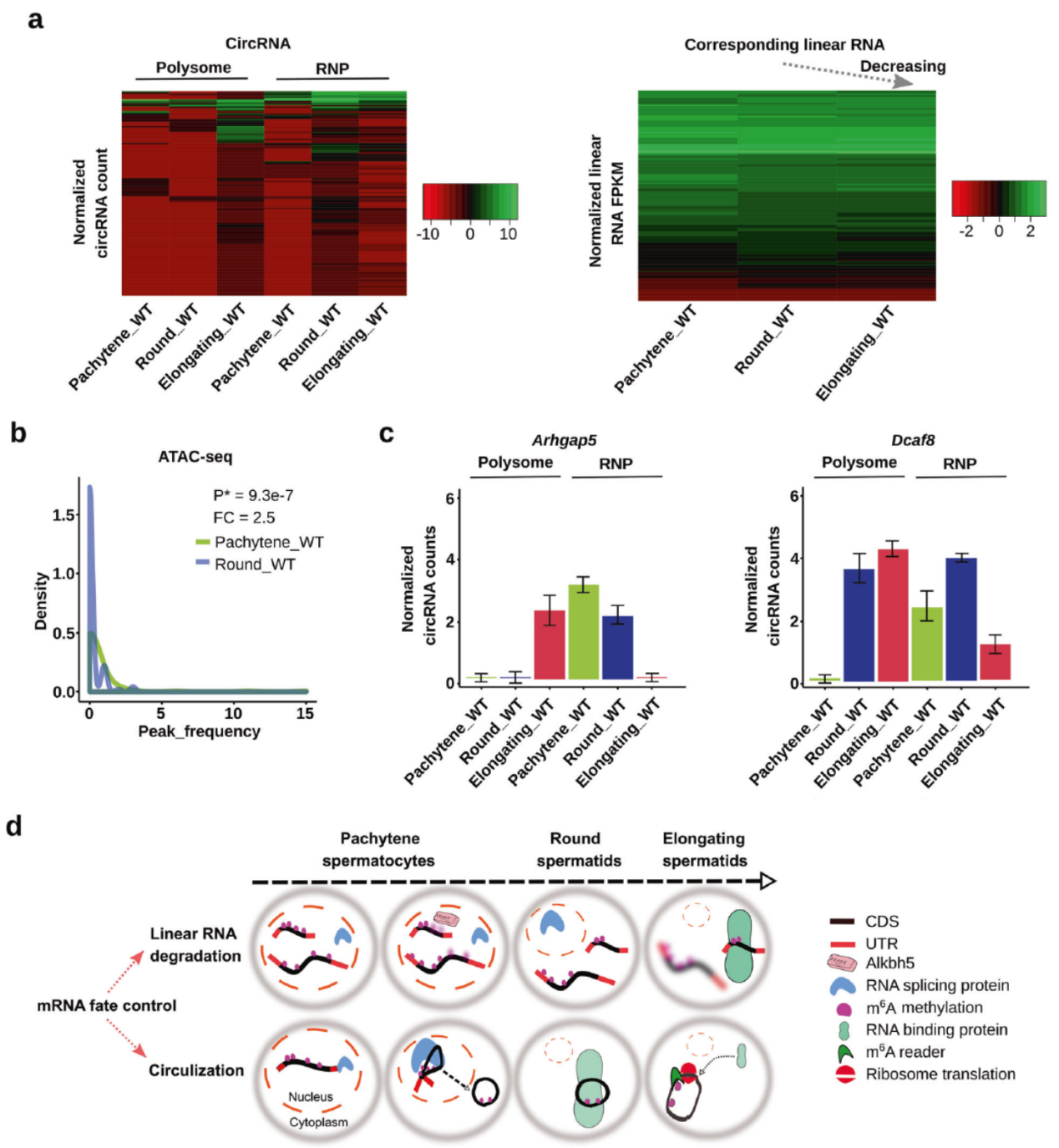
图4 精子发生过程中circRNA可包装进入RNP并可释放后结合核糖体([1])
ALKBH5 和METTL3调控精子发生过程RNA m6A修饰
Alkbh5敲除小鼠中,粗线期,圆形细胞期和精子延伸期的细胞中circRNA的丰度一直很高,但野生型小鼠中circRNA的丰度是伴随着精子发生过程逐步增高的。Alkbh5敲除小鼠中,相关circRNA的m6A水平显著高于野生型。而Mettl3敲除的小鼠中则呈现相反的趋势。
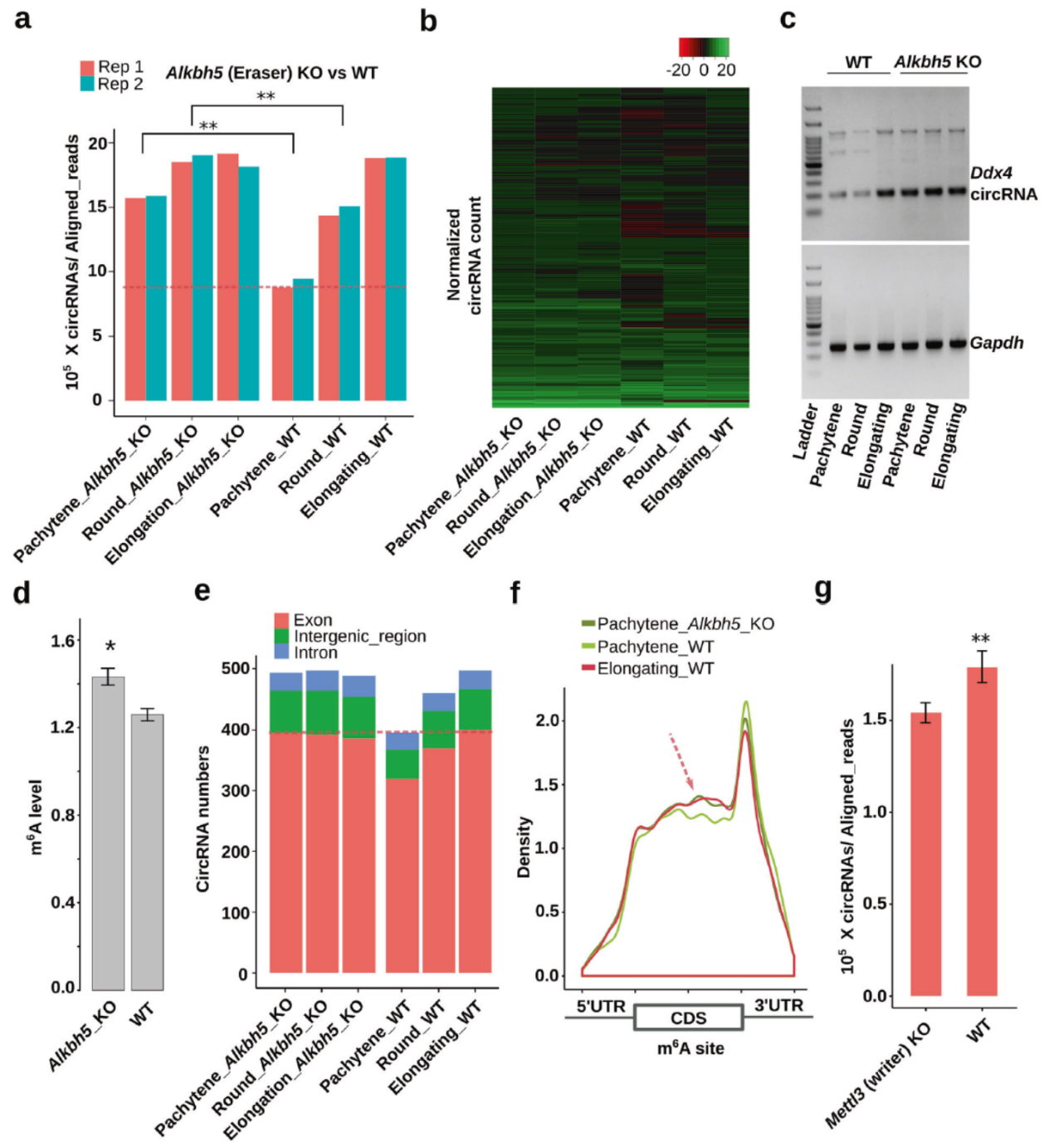
图5 ALKBH5 和METTL3调控精子发生过程RNA m6A修饰([1])
精子携带大量保守性较高的circRNA
作者发现精原细胞中circRNA的丰度甚至高于精母细胞和精子细胞。精原细胞中胞浆小滴(cytoplasmic droplets)也发现含有大量的circRNA分子。通路富集分析表明,胞浆小滴中携带的circRNA来源基因主要精子运动,精子能量代谢等,而在成熟精子中所携带的circRNA来源基因主要是组蛋白和DNA修饰相关的基因。有趣的是,作者还分析了精子头部和整体精子中circRNA丰度的差异,结果表明精子的头部仅携带了不到三分之一的总circRNA。作者还发现相对于年老的小鼠精子,年轻小鼠的精子中携带更多的circRNA。精子携带的circRNA中有30-50%在多种物种中高度保守。在人的精子标本中,高受孕率的精子携带更多的circRNA,也有相对于mRNA更高的丰度。
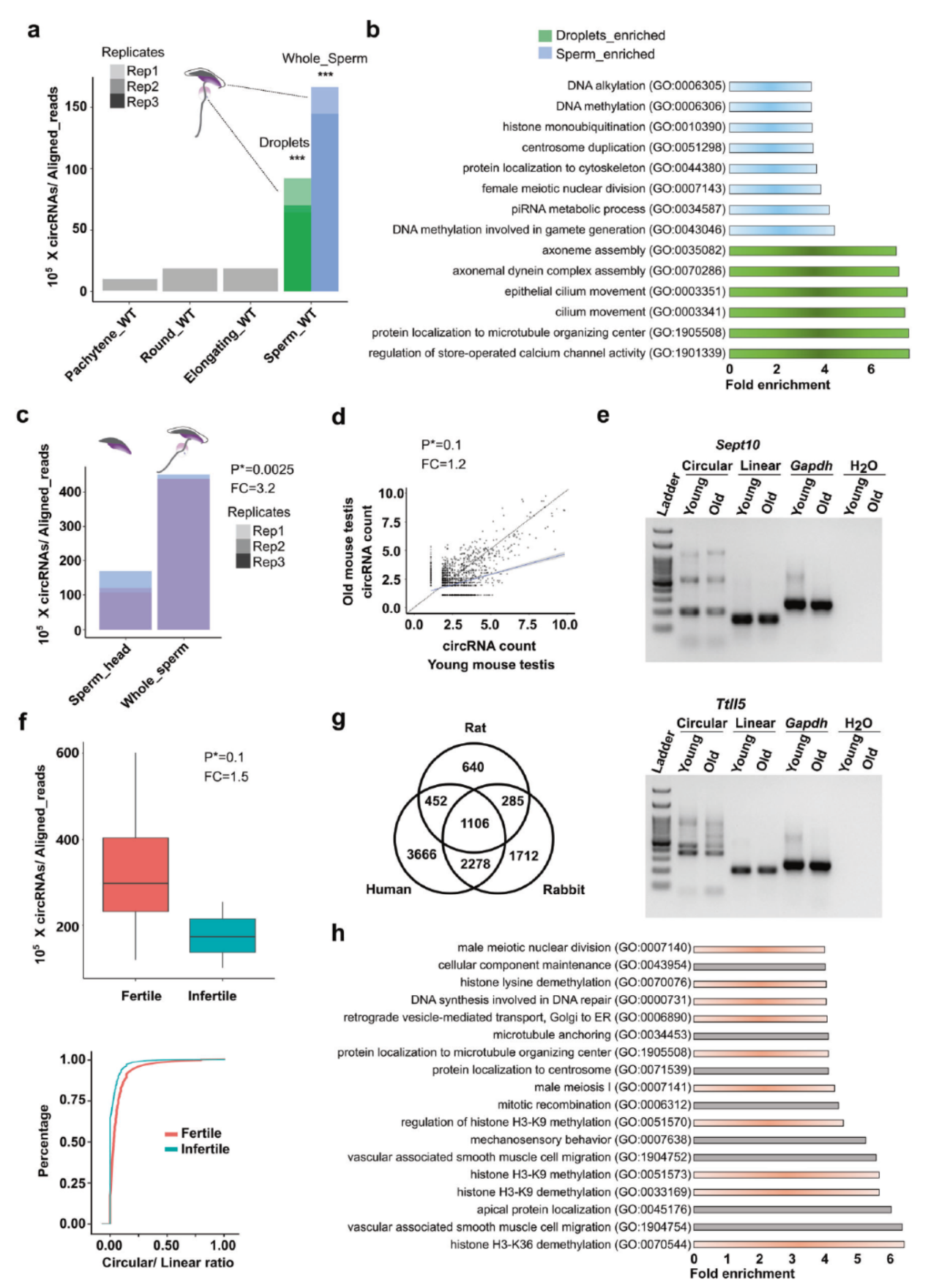
图6 精子携带高保守性的circRNA ([1])
精原细胞中一些circRNA可被翻译
上述的circRNA分子一方面携带了m6A修饰,另一方面也有证据可以结合核糖体,因此有理由推测这些circRNA分子可被翻译,为进一步证明这一问题,作者通过circRNA的接口位点序列生成了虚拟肽段序列库,并分析了蛋白质谱图,找出了一些有质谱证据支持的跨接口翻译产物。这种跨接口翻译产物伴随着精子成熟过程而升高,进一步说明精子成熟过程,circRNA的翻译可能起到重要的作用。
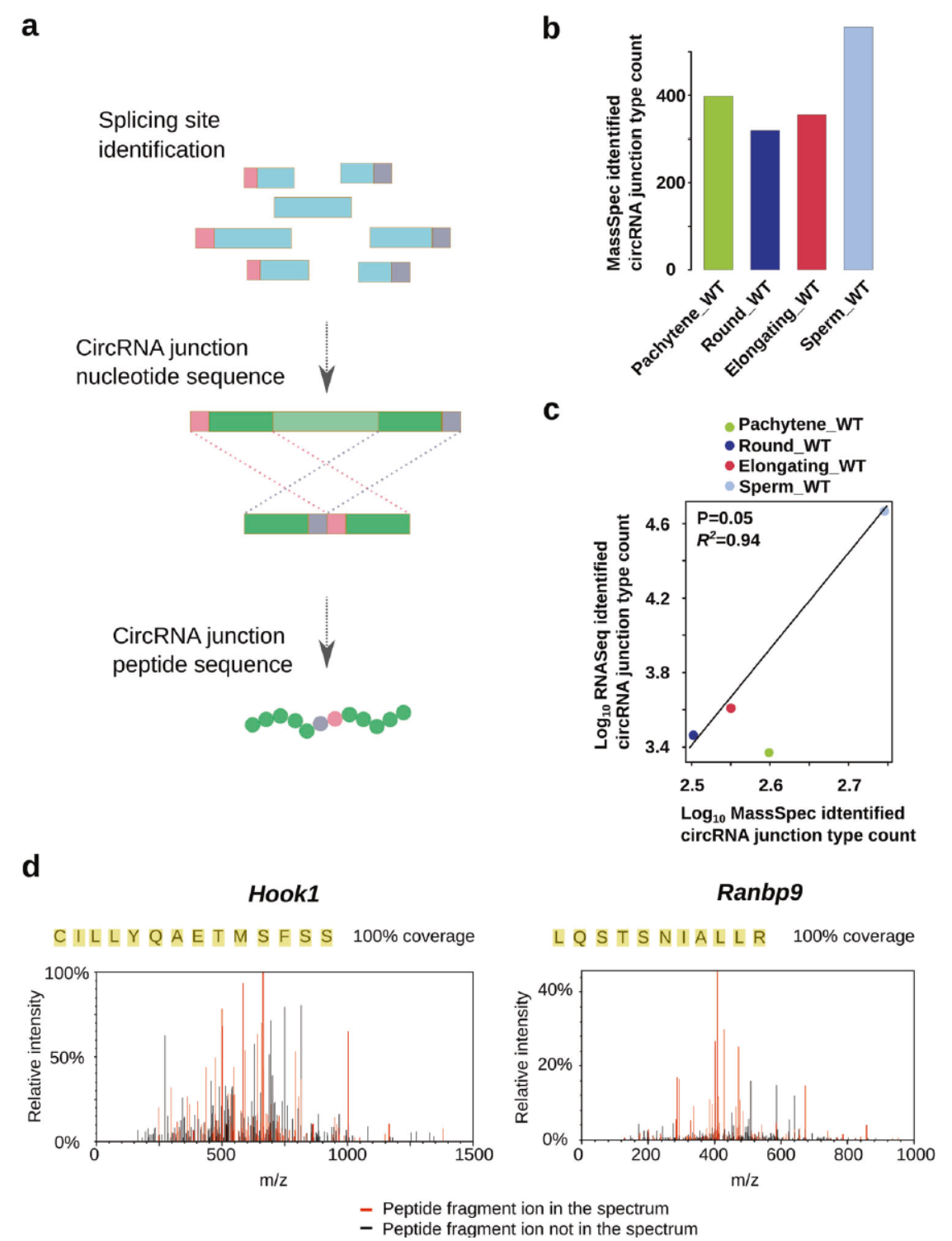
图7 精子成熟过程可翻译circRNA的鉴定 ([1])
本文的报道填补了m6A修饰与circRNA生成相关性研究的空缺,推动了circRNA研究的进展。本文所描述的机制还可能对精子发生过程中基因表达的机制提供新的思路和认识,也暗示circRNA作为一种功能性的分子,在生命活动过程乃至一些病理发生发展过程中的重要意义。
参考文献
1. Chong Tang, Y.X., Tian Yu, Na Liu, Zhuqing Wang , Rebekah J. Woolsey, Yunge Tang, Xinzong Zhang, Weibing Qin, Ying Zhang, Ge Song, Weiwei Zheng, Juan Wang, Weitian Chen, Xiongyi Wei, Zhe Xie, Rachel Klukovich, Huili Zheng, David R. Quilici and Wei Yan, m6A-dependent biogenesis of circular RNAs in male germ cells. Cell Research, 2020.
.png)
