外泌体的miRNA或蛋白质等遗传分子与肝脏病理息息相关,在肝脏疾病诊断中可作为潜在的治疗靶点或分子标志物。对外泌体的研究,将有利于阐述肝脏及其疾病的发生发展机制,为寻求临床可用的biomarkers和开发新的治疗方法提供支持。
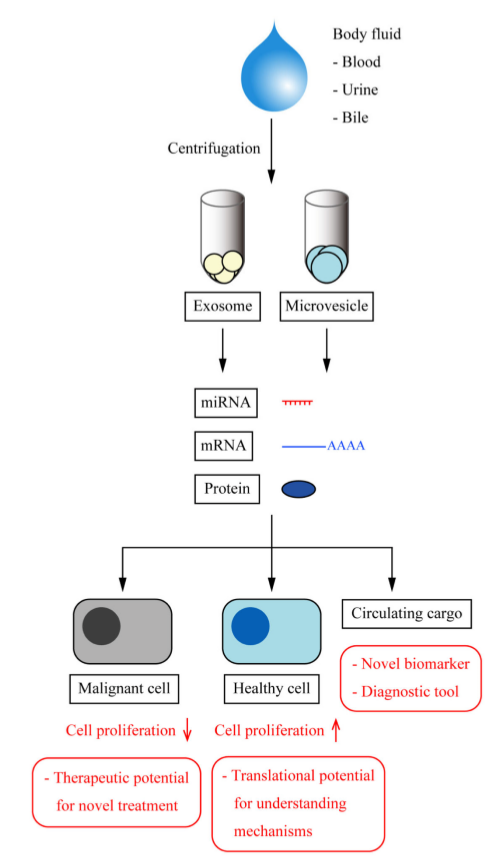
外泌体及其组成
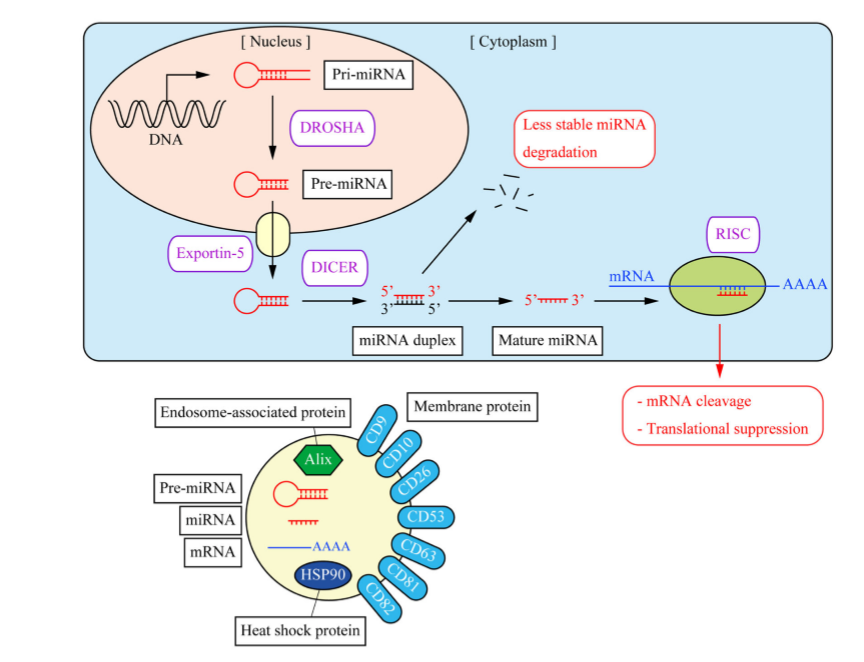
上:miRNA的形成机制:细胞核中,DNA转录形成初始转录本pri-miRNA,经RNaseIII酶DROSHA剪切生成前体pre-miRNA,在核转运蛋白Exportin-5作用下转运至细胞质中。细胞质中,pre-miRNAs被DICER剪接形成miRNA双链。其中一条链用于形成成熟的miRNA,另一条因稳定性差而被降解。成熟的miRNA与靶标mRNA的3’UTR结合形成RISC复合体,抑制mRNA的翻译或促进它的降解。(下)外泌体的内容物:典型的外泌体包含各种不同的组分,包括pre-miRNAs、miRNAs、mRNA和膜标志蛋白、MVB来源的蛋白和热休克蛋白(分子伴侣)。
外泌体富含各种脂质、蛋白质、RNAs和DNAs。

外泌体介导的细胞间交流 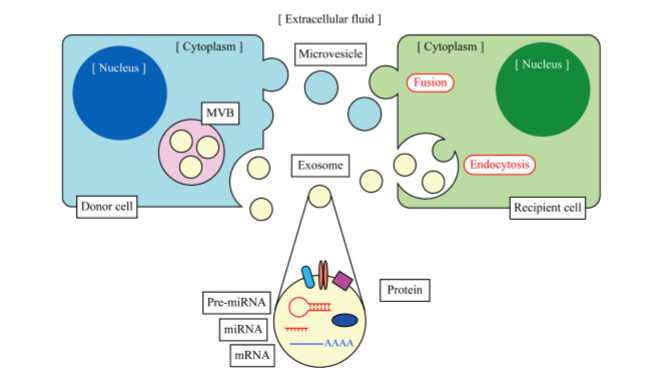
外泌体可以通过转运蛋白和miRNAs进行细胞间交流,从而作用于周围的细胞并改变肝脏的微环境。细胞内多泡体(MVBs)与细胞膜融合,释放内部的外泌体到细胞外,被其他细胞摄取,通过细胞膜融合或内吞作用释放携带的内含物,在受体细胞中调控生理活动。外泌体介导的细胞间交流可以改变肿瘤生长、细胞迁移、抗病毒感染和细胞再生等生理过程。
体外实验证实,小鼠和人源的肥大细胞释放的外泌体可以被其他肥大细胞摄取,外泌体携带的mRNA和miRNA在受体细胞中仍能发挥功能,也就是说被转运的外泌体mRNAs可以在受体细胞中翻译成新的蛋白,参与生理调控过程。
外泌体作为肝脏疾病的分子标志物
寻找肝脏疾病的新型分子标志物一直是研究热点,也是难点。不同肝脏疾病中,细胞分泌的外泌体所携带的核酸和蛋白组分之间存在差异。这些不同生理状态下外泌体所携带的特异性蛋白分子、miRNA等,是潜在的分子诊断和预后标志物。
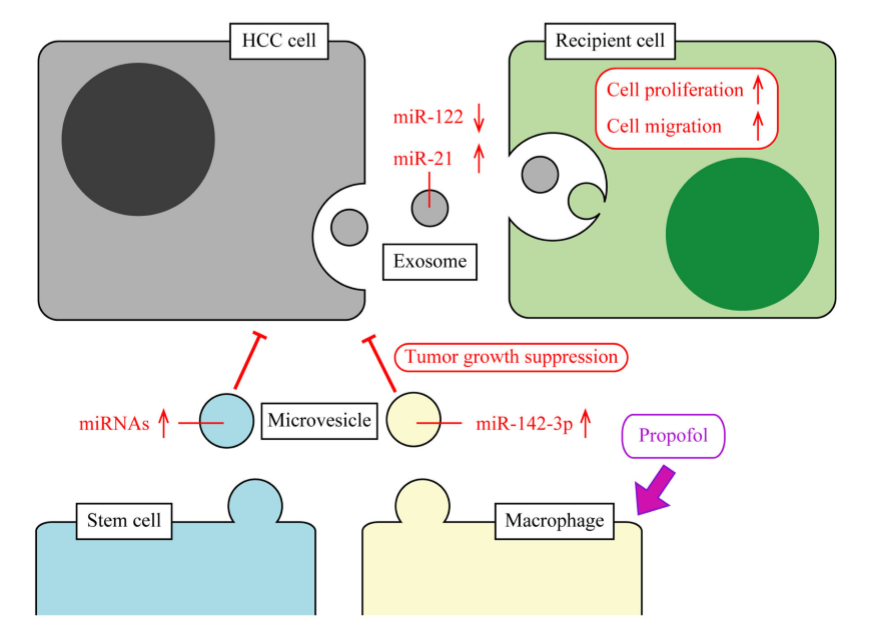
肝细胞癌(HCC)患者中,血清外泌体miR-21、-18a、-221、-222和miR-224显著上升,miR-101、-106b、-122和miR-195显著下降。而HCC患者肝移植复发后,血清外泌体miR-718水平显著下降。除外泌体外,微泡也有可能作为新型标志物,研究发现HCV感染者中CD4+和CD8+T细胞来源的微泡含量上升;而肝脏干细胞分泌的微泡中多种miRNAs上调。
肝脏疾病中潜在的外泌体分子标志物miRNA

miR-122
miR-122是肝病中研究最多的miRNA分子。miR-122可以抑制HCC细胞生长,敲除后细胞活性上调,被认为是肿瘤增殖和迁移的促进因子。HCC来源的外泌体中miR-122表达下调,可能通过细胞间的外泌体交流调控细胞增殖和迁移,是HCC诊治中一个不错的靶标。然而,miR-122在酒精性肝病中上调。酒精暴露后的肝细胞分泌的外泌体中miR-122水平上升,可以被巨噬细胞摄取,促进细胞因子的分泌。
这表明,miRNA在肝病发展中起着重要作用,但即使是同一个miRNA,根据肝脏疾病的不同,其表达也存在差异。
miR-21
miR-21可能具有跟miR-122相反的功能。miR-21在HCC患者中高表达,敲除后会促进细胞凋亡,降低细胞活性。miR-21过表达可以促进CAA细胞增殖,通过靶向前列腺素转化的关键酶15-PGDH。
miR-192
miR-192研究较少,可通过靶向原癌基因SLC39A6抑制HCC细胞转移。
miR-155
miR-155与炎症调节有关,慢性HCV感染患者的血清和外周血单核细胞中表达水平升高。miR-155敲除小鼠中,含有miR-155模拟物的外泌体可以被小鼠肝细胞摄取,诱导肝细胞中的miR-155表达。miR-155缺失可以缓和蛋氨酸胆碱缺乏饮食导致的肝脂肪变性和纤维化。
外泌体作为肝脏疾病的新型治疗策略
外泌体及其携带的组分参与肝脏细胞的增殖、再生和迁移等生理过程,在肝脏疾病和肝损伤中起着重要作用,如HCV感染、肝癌、肝硬化、肝纤维化、酒精性脂肪肝等。抑制或阻止外泌体的分泌,或许是治疗肝脏疾病的一种新型策略。此外,外泌体具有稳定性和生物安全性,也可以用作载体携带改造的基因或药物,或用作疫苗诱导免疫反应杀死肿瘤细胞。
外泌体与HCV、HBV感染
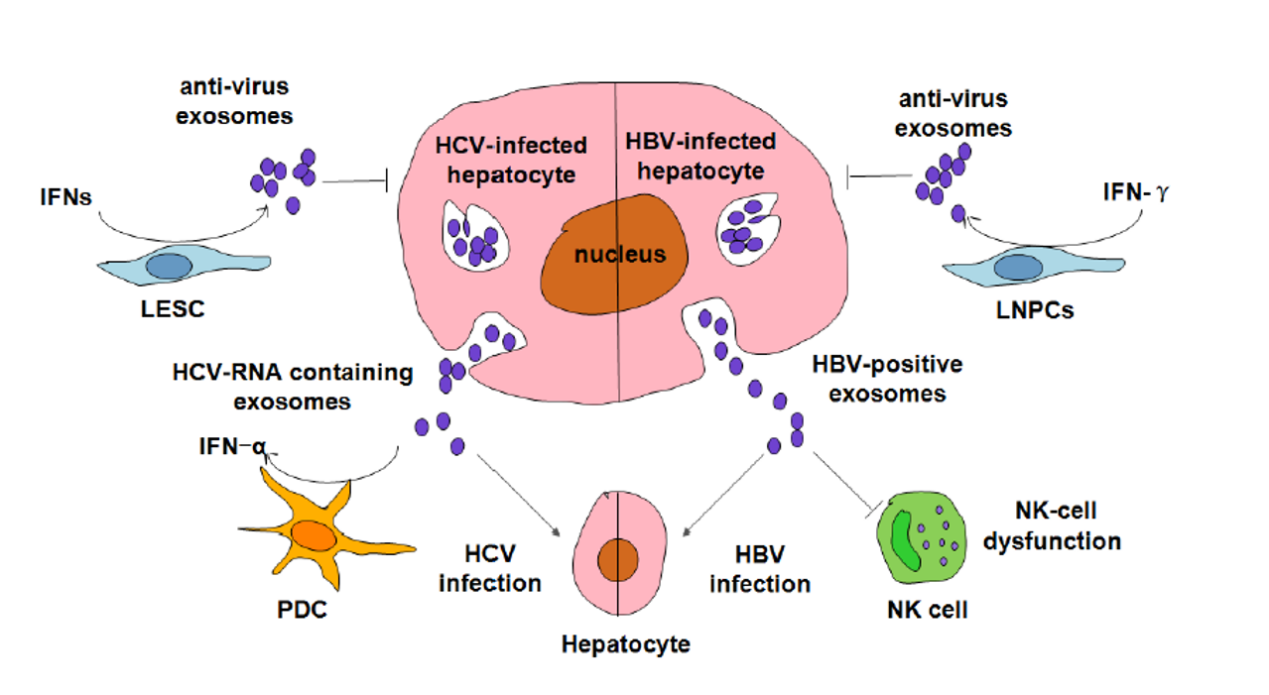
外泌体通过转运病毒相关分子促进细胞间的病毒感染,也可以参与病毒感染后的免疫调控和抗病毒响应过程。HCV感染的肝细胞分泌的外泌体中含有HCV相关的分子如包膜蛋白E1-E2糖蛋白、HCV-DNA等。这些HCV相关分子被外泌体转运到其他肝细胞中造成病毒感染,且外泌体会起到一定的保护作用,抵抗抗病毒作用。
与HCV类似,HBV感染患者的血清中分离到的外泌体同样携带HBV核酸分子和蛋白质。HBV阳性的外泌体会主动转移HBV到肝细胞中。外泌体中HBV核酸分子还会抑制RIG-1和下游信号通路,导致NK细胞功能紊乱。
外泌体与HCC
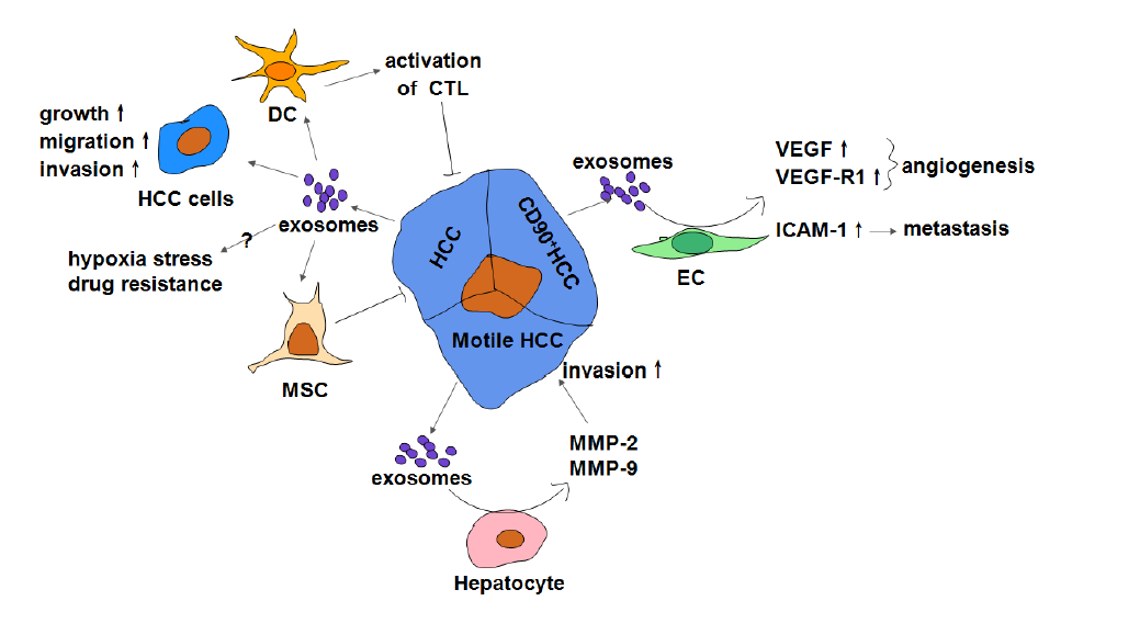
一方面,外泌体可以通过调控细胞的恶性转化如细胞增殖、迁移和侵袭,促进HCC的发生发展。另一方面,恶性肿瘤细胞分泌的外泌体可以协同其他肿瘤细胞一起,调控肿瘤微环境,以利于HCC发展。人HCC细胞外泌体中含有的一系列miRNAs,会减弱其他HCC细胞中TGF-β通路上的蛋白表达,促进HCC细胞的生长。HCC细胞外泌体还会诱导非致瘤性肝细胞发生细胞迁移和侵袭,具有运动能力的HCC通过释放外泌体诱导肝细胞分泌MMP-2和MMP-9,增强HCC细胞的侵袭能力。经HCC中分离到的CD90+外泌体处理的内皮细胞会表达更多的VEGF和VEGFR1,促进血管生成;同时诱导ICAM-1表达促进细胞转移。还有研究表明外泌体参与HCC缺氧胁迫和药物耐受的调控。
外泌体与肝纤维化
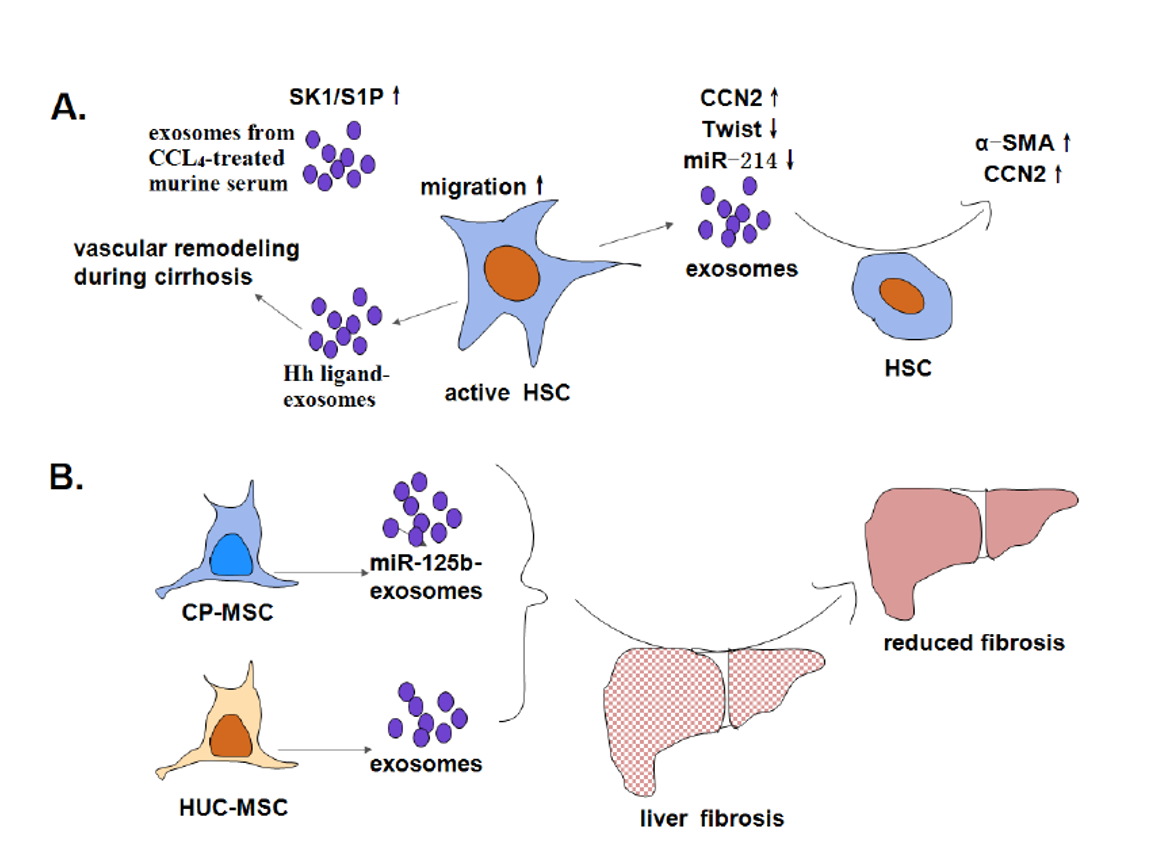
外泌体可以调控星状细胞(HSC)活化,并参与HSC细胞迁移的进程。活化的HSC来源的外泌体中,CCN2表达升高,Twist1和miR-214表达被抑制,这些外泌体还能诱导静止的HSC细胞表达CCN2。此外,Twist1可以诱导miR-214表达从而抑制CCN2的表达。CCL4处理的外泌体和外泌体SK1/S1P会诱导HSC迁移。
MSC分泌的外泌体可以有效减缓肝纤维化过程,这可能成为肝纤维化治疗的靶点。研究显示,CP-MSC来源的外泌体miR-125b可以抑制Hedgehog信号通路的活化,抑制纤维化;而HUC-MSC分泌的外泌体可以逆转细胞形态和TGF-β1诱导的EMT进程,减弱肝纤维化。
外泌体研究也可以指导诊治肝损伤、酒精或非酒精性脂肪肝等其他肝脏疾病。药物诱导肝损伤(DILI)大鼠模型中,尿外泌体中的蛋白含量减少,包括CD26、CD81和其他潜在的标志物蛋白。而另一项研究则发现DILI大鼠血清中分离到的外泌体含有更高水平的蛋白,如HSP70、HSP90等。MSCs来源的外泌体可以诱导肝细胞增殖相关基因表达,减弱CCL4诱导的肝损伤。而酒精刺激会促进外泌体的分泌,miRNAs水平也会升高,并促进细胞因子的分泌,激活单核细胞的分化。尽管已取得上述成果,我们对外泌体的研究尚不够深入,外泌体在肝脏生理和病理中的重要作用及其临床应用仍有待继续探索。
参考文献:
- Cai S, Cheng X, Pan X, et al. Emerging role of exosomes in liver physiology and pathology[J]. Hepatology Research, 2017, 47(2): 194-203.
- Sato K, Meng F, Glaser S, et al. Exosomes in liver pathology[J]. Journal of hepatology, 2016, 65(1): 213-221.
- Masyuk A I, Masyuk T V, LaRusso N F. Exosomes in the pathogenesis, diagnostics and therapeutics of liver diseases[J]. Journal of hepatology, 2013, 59(3): 621-625.
.png)
