外泌体是近几年炙手可热的热点研究方向之一,2月7日的Science在线发表了一篇外泌体研究的综述文章,系统回顾了外泌体的功能和生物医学应用([1])。已有一些文献报道表明circRNA也可进入外泌体,外泌体相关的circRNA研究也成为近几年circRNA研究的一个重要方向。本文的很多信息对于circRNA相关的外泌体研究具有重要参考意义。

细胞外囊泡(extracellular vesicles,EVs)是广泛存在的细胞外膜泡结构,从原核生物到真核生物都有,细胞外囊泡可分为Ectosomes和 Exosomes。Ectosomes主要从细胞外膜通过“出芽”等方式形成,直径从50nm~1μm,按大小可分为microvesicles,microparticles,large vesicles。Exosomes即外泌体,直径在40~160nm,平均100nm,主要来源于细胞的内涵体(Endosome)。外泌体由细胞内的内涵体通过胞吐作用释放到胞外形成的,而Ectosomes则直接由细胞外膜通过“出芽”方式形成,因此两者是完全不同的细胞外囊泡成分,但两者的直径有重叠的区间,目前的分离和研究手段还不能非常有效的区分二者。
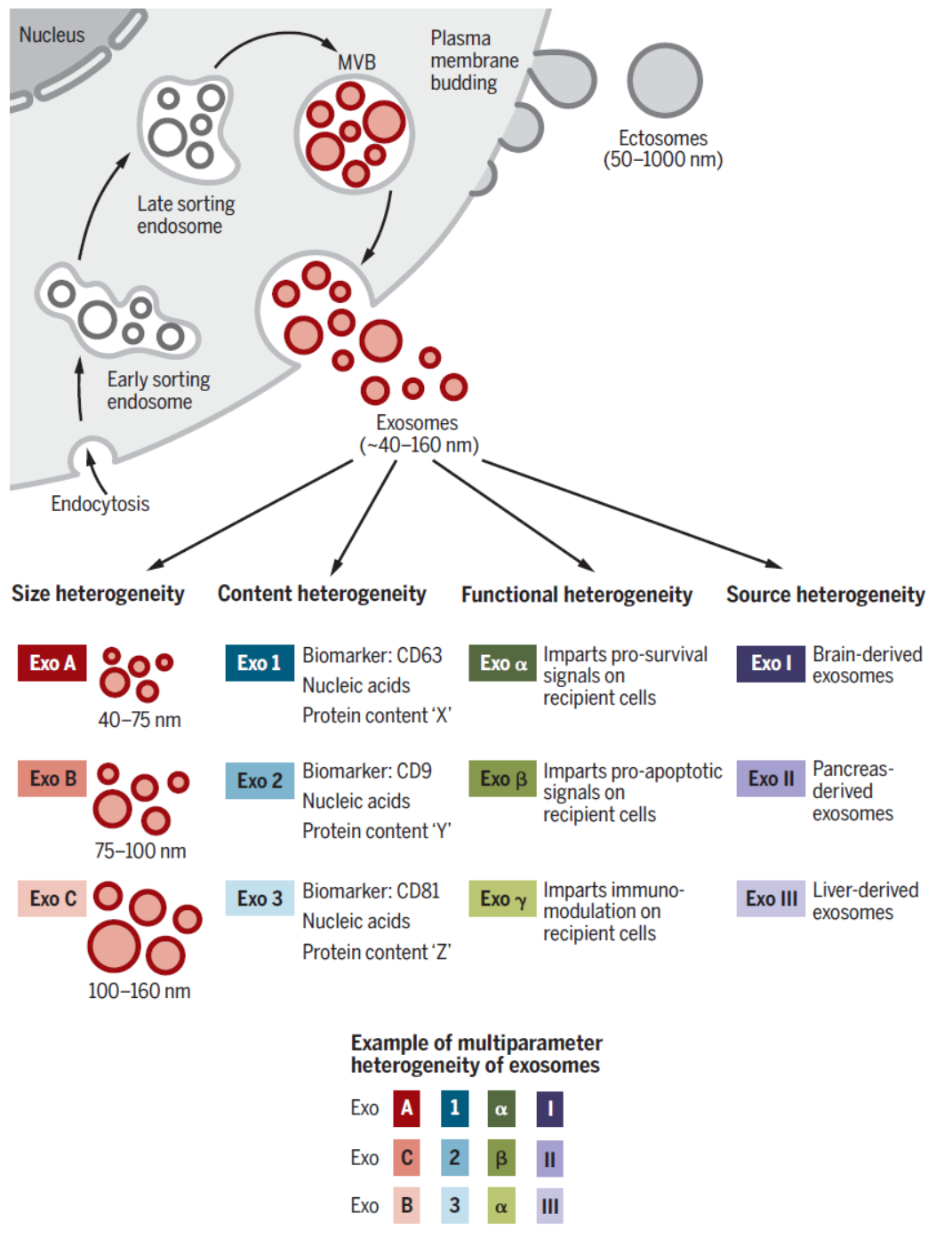
图1 细胞外囊泡与外泌体 ([1])
外泌体的组分和功能可能是受到特定的调控机制调控,因此备受关注。本文主要针对外泌体(Exosomes)的研究进展进行汇总。
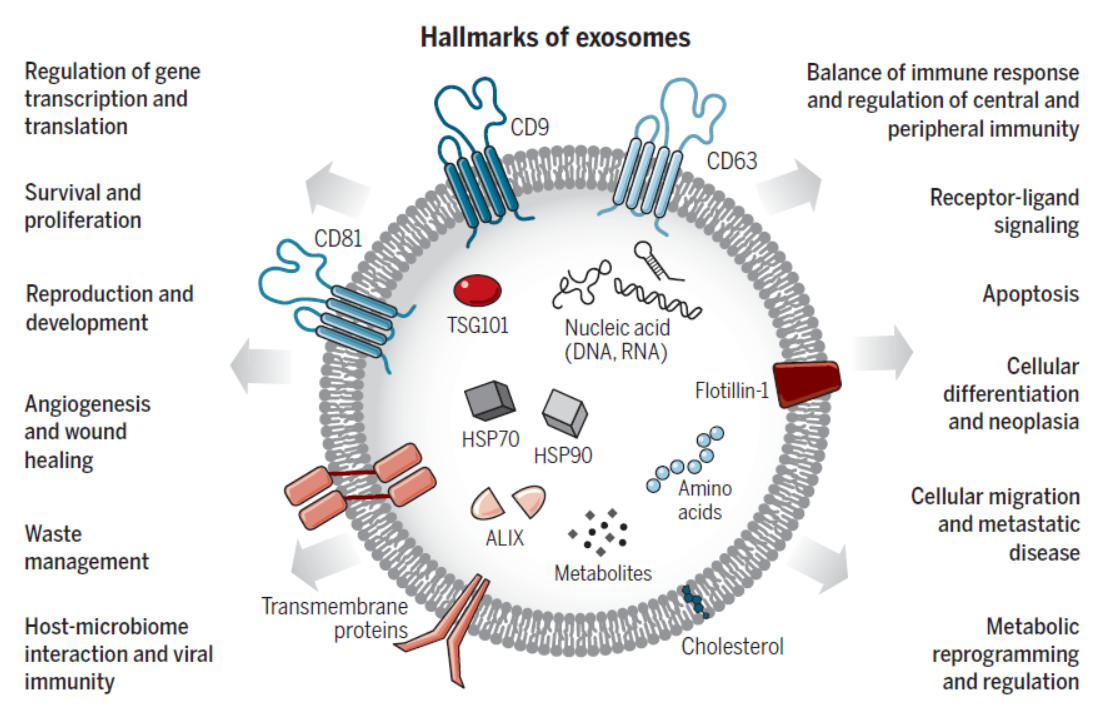
图2 外泌体的主要特征 ([1])
外泌体的形成
已知的外泌体形成过程可概括如下:细胞质膜内陷,将一些细胞外成分和细胞膜蛋白包裹在一起,形成早期内涵体(early-sorting endosome,ESEs),这些ESEs可以与其他细胞器发生物质交换,或者不同ESEs之间融合形成晚期内涵体(late-sorting endosomes,LSEs),进一步形成细胞内多膜体(intracellular multivesicular bodies,MVBs),其中会包含许多腔内囊泡(intraluminal vesicles,ILVs),这些ILVs将来就可能会被释放成为外泌体。细胞形成MVBs后可能会通过与自噬体或溶酶体融合而被降解,也可能通过与质膜融合,释放其中的物质,包括ILVs,这些ILVs就是最终形成的外泌体。已知的参与外泌体形成的蛋白包括:Rab,Sytenin-1,TSG101,ALIX,syndecan-1,ESCRT,鞘磷脂酶, SNARE家族蛋白等等。不同细胞生成外泌体的速率有所差别,外泌体的大小和组分存在高度的异质性,但其中组分与来源细胞有密切关系。目前对外泌体形成的动力学,外泌体组分调控机制,外泌体标志物等方面的认识还比较局限,相关研究还有待继续深入开展。
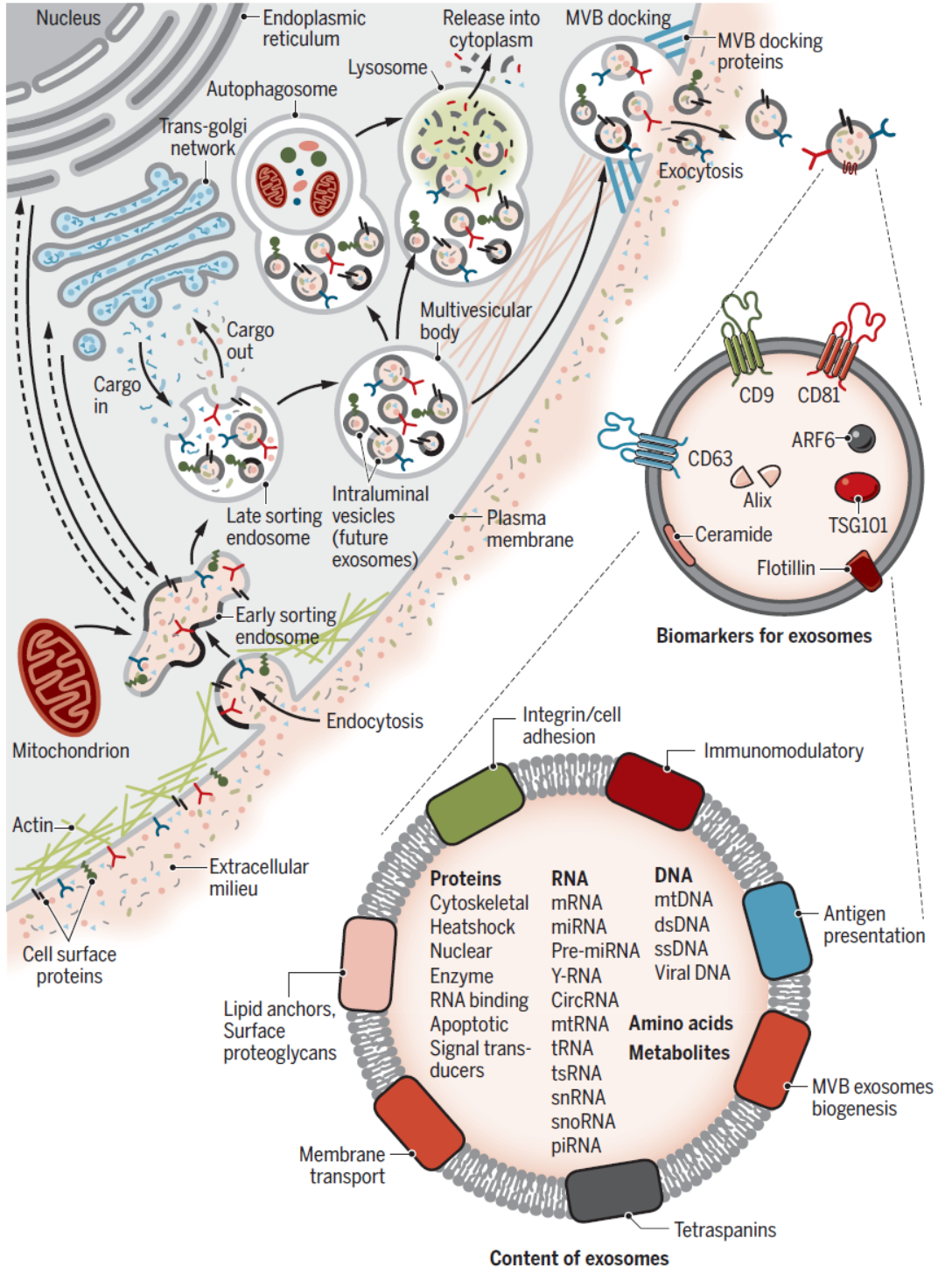
图3 外泌体形成过程与主要组分 ([1])
外泌体功能概述
外泌体可能作为细胞之间物质和信号通讯的途径,不同的细胞通过分泌携带不同组分的外泌体实现细胞间通讯,这些外泌体被受体细胞吸收,通过物质交换或释放内含物实现物质和信号的交流。这方面比较典型的发现是KRas突变的胰腺癌细胞可促进大胞饮作用促进外泌体的吸收。黑色素瘤细胞通过促进细胞质膜与外泌体的融合实现对外泌体组分的吸收。而神经分泌的PC12细胞在主要通过网格蛋白有被小泡吸收适当大小的外泌体。小鼠体内研究表明一些外泌体还可以直接输送mRNA给受体细胞,尤其是急性或慢性感染刺激下。外泌体的蛋白组分与来源细胞密切相关。例如EGFR-vIII突变的胶质母细胞瘤细胞来源的外泌体往往携带更多的浸润分子。炎性因子刺激的神经干细胞释放携带IFNγ及其受体的外泌体,在受体细胞中特异性激活STAT1通路。
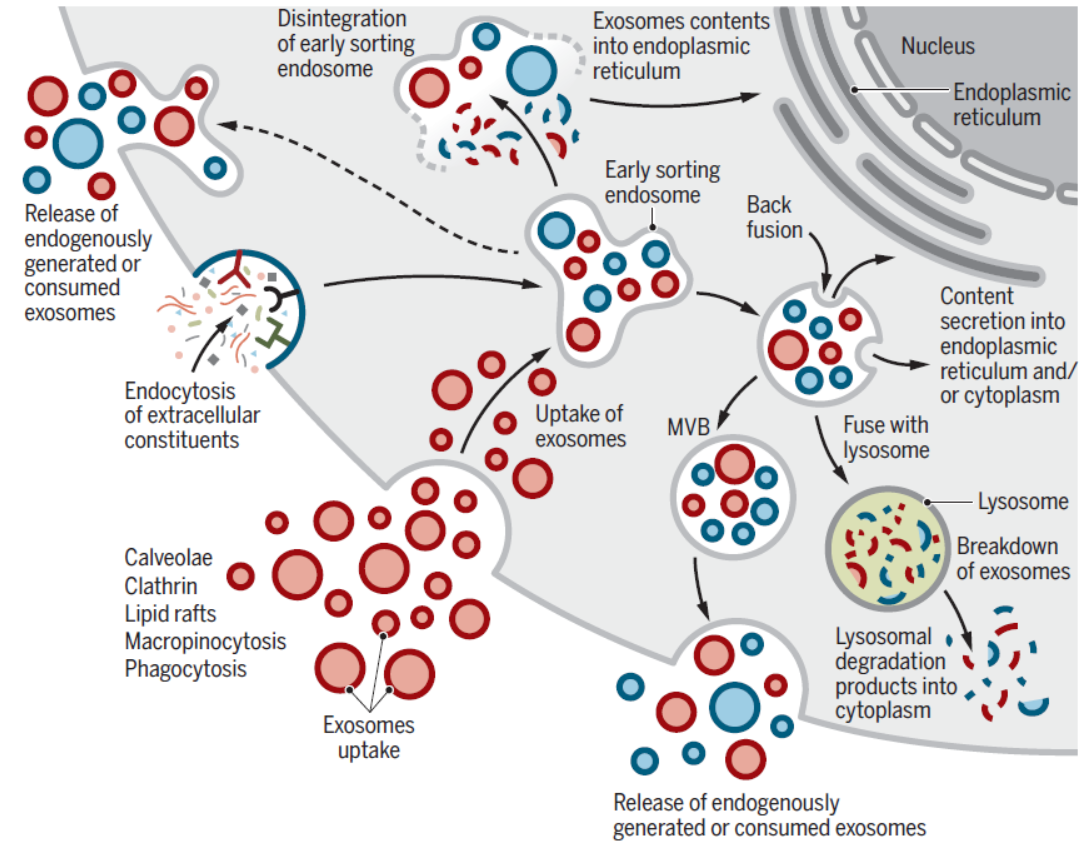
图4 外泌体是细胞间物质与信号交流的途径 ([1])
外泌体与生殖发育
哺乳动物生殖妊娠和胚胎发育的过程需要一些精确的细胞间通讯机制,外泌体在其中起到了重要作用。人类的精液,羊水,血液和母乳均包含外泌体。多例人类精浆中分离的外泌体检测到包含let-7a,let-7b,miR-148a,miR-375和miR-99a,这些miRNAs调控了一些白介素的表达水平,与生殖器驻留免疫有关。精浆来源的外泌体还有助于阻断HIV的感染。胎盘滋养细胞来源的外泌体可将一类miRNA输送至非胎盘细胞,促进自噬和病毒防御机能。有趣的是,妊娠晚期小鼠的血浆外泌体可以诱导近产期的孕鼠早产,但对妊娠早期的小鼠没有影响。母乳中的外泌体也对婴儿的免疫系统有帮助。
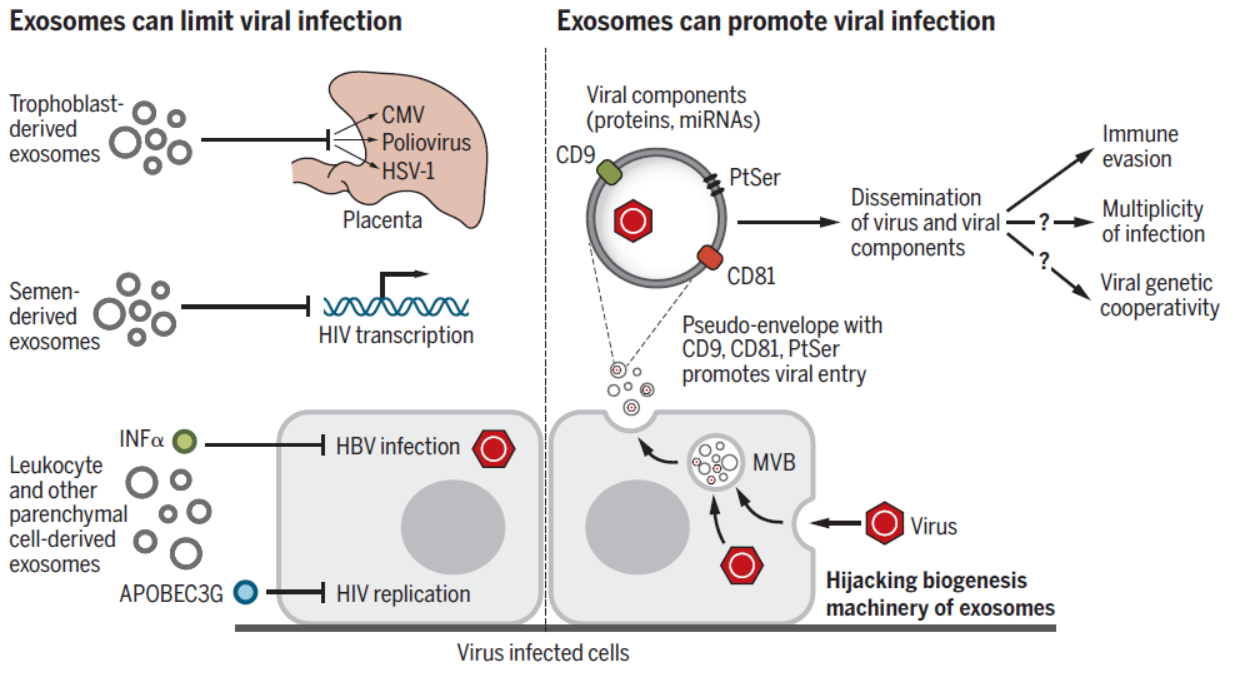
图5 外泌体与病毒防御机制 ([1])
外泌体与免疫系统
低剂量注射外泌体似乎并不引起明显的免疫排斥反应,但这依然需要更多的研究论证。外泌体调控免疫效应似乎主要通过两种方式:携带MHC-peptide的外泌体可直接通过抗原递呈作用激活免疫系统;外泌体携带的DNA分子通过cGAS-STING通路激活免疫效应通路。
由抗原递呈细胞来源的外泌体可以直接通过携带的结合了抗原肽的MHC-II激活T细胞,但外泌体单独对T细胞的激活作用比较有效。有趣的是,携带了结合肿瘤特异性抗原的MHC-II的外泌体在小鼠体内可显著抑制肿瘤生长。这些外泌体可能通过激活抗原提呈细胞间接激活naïve T细胞和B细胞,也可能促进CD4+T细胞的扩增。巨噬细胞来源的外泌体还可能促进了抗细菌免疫效应的激活过程。外泌体携带的核酸分子也参与了先天性和适应性免疫活动。此外,来自间充质干细胞,甚至癌细胞的外泌体也在免疫活动过程中发挥了特殊的作用。
外泌体与肿瘤免疫耐受及病毒传播过程均有关系。黑色素瘤细胞来源的外泌体携带PD-L1,可直接抑制CD8+T细胞的活性,抑制树突状细胞的成熟,并诱导列淋巴结中T细胞耗竭,与肿瘤免疫耐受密切相关。黑色素瘤和前列腺癌来源外泌体还可携带FasL,可诱导T细胞的凋亡。肿瘤来源的CD39+ 或CD73+的外泌体也可以介导免疫效应沉默作用。除了肿瘤,一些病毒感染和扩散的过程也与外泌体有关。一些病毒进化出利用外泌体成熟的过程实现病毒的传播,如HAV,HEV等等。
总之,外泌体与免疫系统存在错综复杂的关系,不同细胞来源的外泌体在一些生理和病理相关的免疫活动中均有重要功能,是外泌体生物学功能研究的重要方向之一。
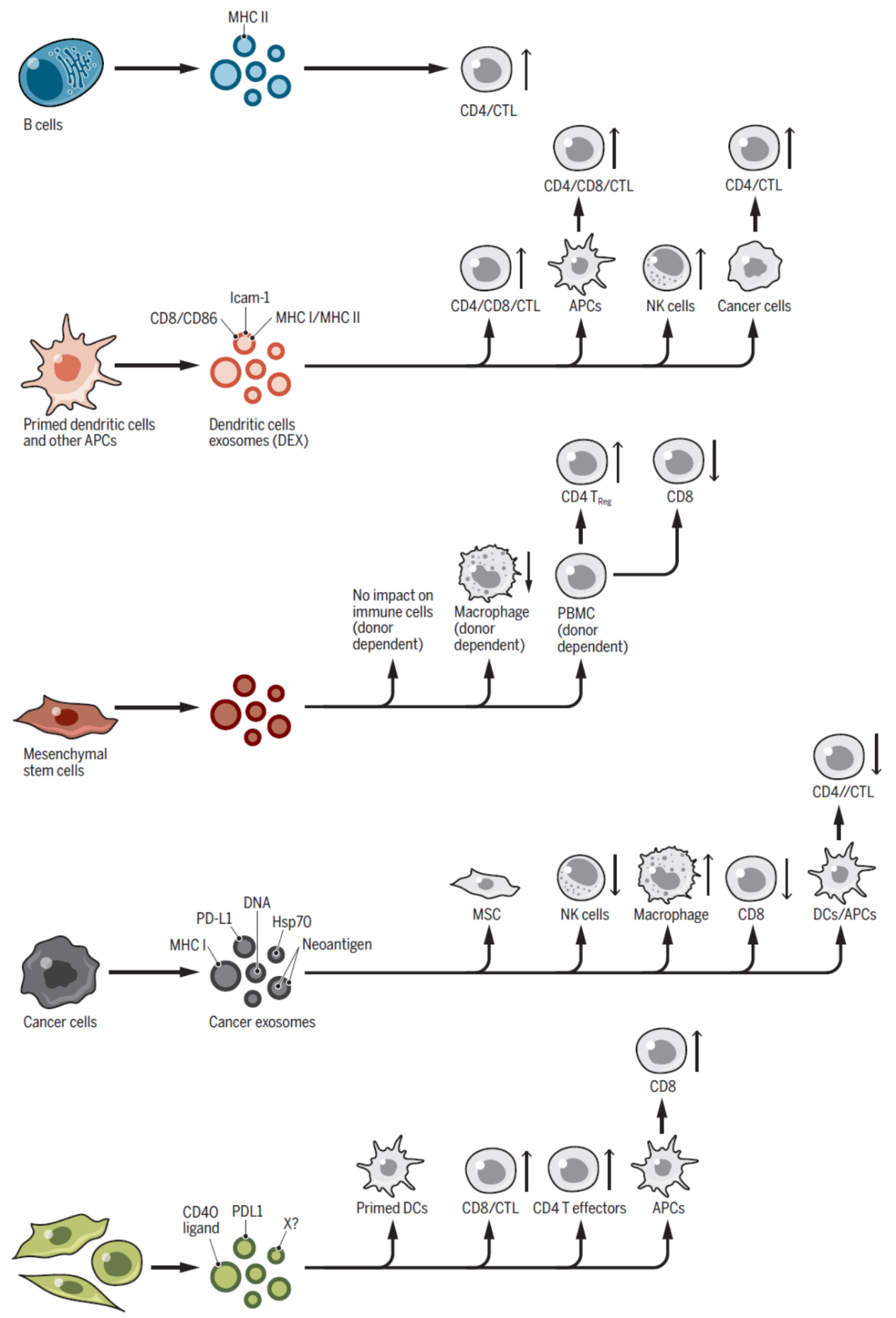
图6 外泌体与免疫 ([1])
外泌体与代谢性或心血管疾病
外泌体可以通过携带miRNA或代谢物分子在代谢性疾病和心血管疾病的发生发展过程中起作用。一些肿瘤来源的外泌体可能通过携带的物质改变非肿瘤细胞的代谢方式,如胰岛β细胞,脂肪细胞等等,帮助cachexia 和paraneoplastic病症发展。体外培养细胞动脉粥样硬化,糖尿病相关的心血管疾病(CVD)和与心力衰竭疾病模型的细胞收集的外泌体与疾病相关的代谢适应有关。体外培养的间充质干细胞和胚胎干细胞的外泌体具有保护心血管的作用。这些发现表明不同来源的外泌体可以通过传递miRNA,蛋白等物质改变受体细胞的代谢状态。
外泌体与神经退行性疾病
神经退行性疾病往往伴随致病性蛋白沉淀物的积累,外泌体可能是细胞清除这类致病性蛋白沉淀的重要方式。AD病人脑脊液外泌体中均可检测到Tau和Aβ蛋白。类似的现象也在PD和ALS疾病中发现。PD病人脑脊液外泌体可检测到α-synuclein,ALS病人外泌体中也可以检测到SOD1或TDP-43。
外泌体在生物医学中的应用潜能
外泌体在疾病诊断中的应用潜能
外泌体生成机制表明,通过分析外泌体的组分,可以帮助识别其来源的细胞类型。这一特性被用于开发心血管疾病,中枢神经系统疾病和肿瘤的分子诊断方法,也在肝,肾,肺相关疾病的诊断中得到重视。还有一些研究表明外泌体中携带的肿瘤来源DNA片段可有助于肿瘤相关DNA突变的检测。此外,外泌体相关的miRNA在肿瘤诊断中具有较高的价值,如miR-100,miR-21等等。除了miRNA,一些外泌体蛋白也可能用于分子诊断,例如GPC1,CD147等等。
外泌体在疾病治疗中的应用潜能
一些研究表明,小鼠体内外泌体的免疫清除率比脂质体低,因此可以作为潜在的给药工具。基于外泌体实现siRNA的定向给药已经取得了一些可喜的进展。还有一些研究利用外泌体实现对肿瘤免疫机制的干预。
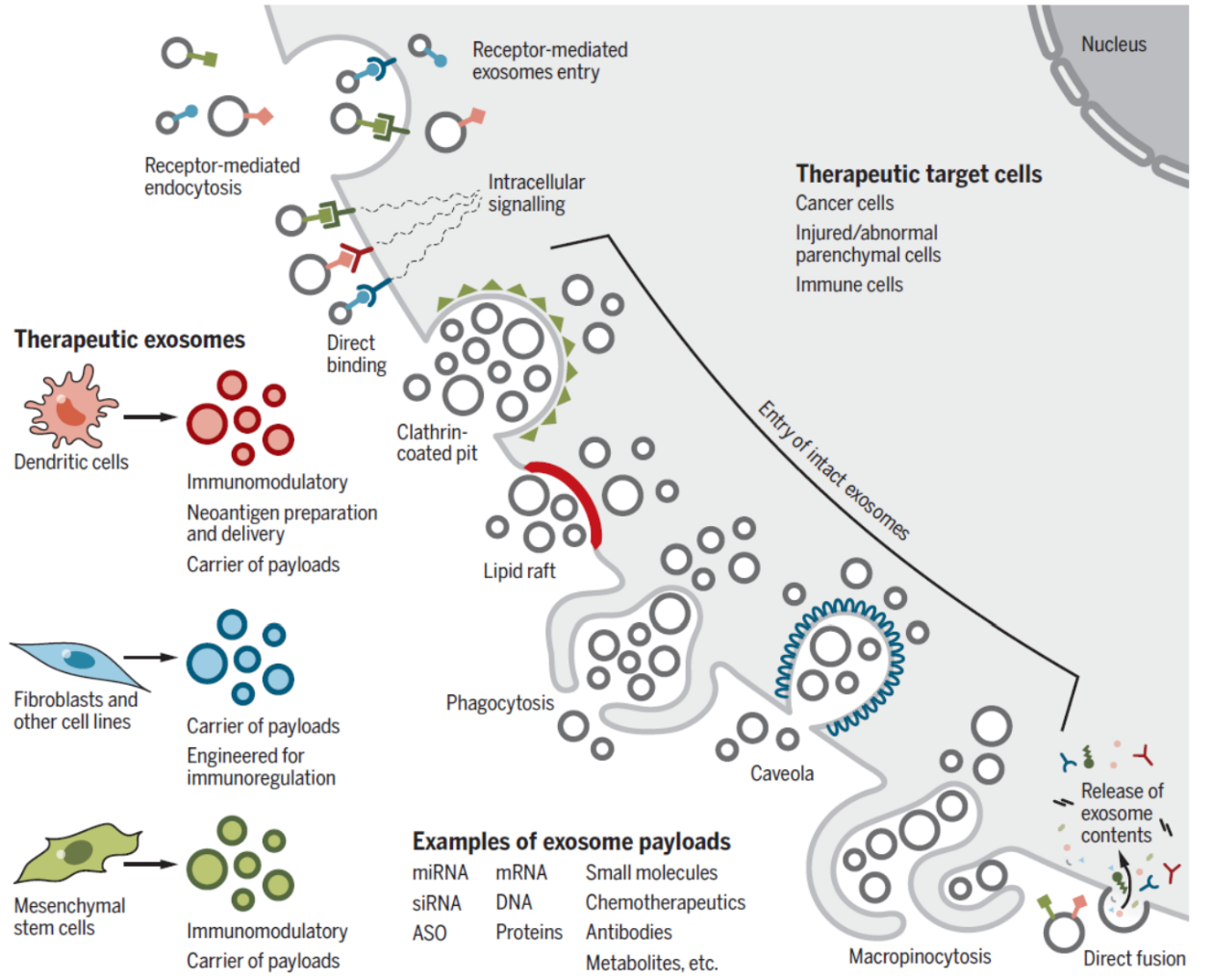
图7 外泌体作为疾病治疗工具 ([1])
外泌体特殊的生成途径,复杂的来源渠道决定了我们认识和利用外泌体的道路还很漫长。早期的外泌体研究聚焦于蛋白和miRNAs的居多,但很多文章已证明外泌体中的确存在circRNA分子,这些circRNA分子如何进入外泌体,有没有选择性富集的机制,通过外泌体进入受体细胞的功能。外泌体中circRNA可否作为有效的疾病诊断标志物都是非常值得深入探究的问题。期待广大同行的更多进展。
PS:由于篇幅有限,很多具体的例子没有在此介绍,感兴趣的同行可自行下载这篇综述深入研读。
参考文献:
1. LeBleu, R.K.a.V.S., The biology, function, and biomedical applications of exosomes. Science, 2020. 367(6478).
.png)