图片摘要:Nature Reviews Molecular Cell Biology最新综述全解读,circRNA功能和机制的最新进展
2020年5月4日,中科院上海生化细胞所的陈玲玲教授在Nature Reviews Molecular Cell Biology杂志(IF=43.351)上发表了一篇题为“The expanding regulatory mechanisms and cellular functions of circular RNAs”的综述,详细汇总介绍了环状RNA的生成机制、调控机制、功能机制和在细胞中发挥的作用([1])。

高等真核生物中的许多蛋白质编码基因都可以通过外显子的反向剪接产生环状RNA(circRNA)。circRNA的生成、结构和降解机制都不同于mRNA,因此circRNA具有独特的细胞功能。在这篇综述中,作者系统汇总了circRNA的生成、调控及其生物学功能的最新进展,包括在基因转录与剪接,作为大分子阻遏物或脚手架参与干扰microRNA及信号通路的活性,作为模板翻译蛋白等。此外,作者还进一步讨论了circRNA在调节免疫应答和细胞增殖中的新型作用机制,以及circRNA技术在生物医学中的潜在应用。
1 环状RNA的生成
1.1 反向剪接与转录过程相偶联
circRNA是由pre-mRNA的反向剪接产生的,内含子下游5’剪接位点是以相反的顺序与上游3’剪接位点连接,形成环状RNA,并在反向剪接的外显子之间形成3’,5′-磷酸二酯键。此外,在mRNA剪接过程中切除的内含子套索有时可以逃避降解,并在剪接供体和分支点之间形成具有2’,5′-磷酸二酯键的环状RNA,这些RNA环被称为环状内含子RNA。circRNA与成熟的mRNA均由同一个基因转录产生,circRNA可以视为一种特殊的RNA可变剪切产物,绝大部分的circRNA与mRNA使用相同的拼接位点和剪切机制。大多数人类的circRNA包含多个外显子,通常为两个或三个。在人类细胞中,单外显子形成的circRNA长度中位数在353nt,多外显子的circRNA每个外显子的长度中位数在112-130nt。circRNA剪切形成过程需要聚合酶II(Pol II)和常规的剪切体协同完成。
一项早期的研究表明,从果蝇头部分离的染色质RNA中存在大量的新生circRNA,这表明反向剪接和Pol II转录之间存在偶联。通过分析人类细胞中Pol II转录延伸速率(TER)发现,能形成circRNA的基因平均TER要高于不能生成circRNA的基因,改变TER可以显著影响circRNA的生成效率。一个可能的机理是TER高的基因允许更多含有内含子互补序列(ICS)的内含子转录,增加了跨外显子ICS配对的可能性,从而增加了反向剪接的可能性。还可能的原因是,与较高TER关联的线性剪接减少从而增加反向剪接。果蝇中表达慢速型Pol II也可以抑制circRNA的生成,并且可以在聚腺苷酸化和切割前伴随生成一些转录通读型的反向剪切产物。circRNA的反向剪接也可以发生在转录后。研究表明,数千个新生circRNA是在pre-mRNA转录完成后才能检测到。过表达报告载体实验表明,circRNA生成也与mRNA 的3’末端加工过程有关,抑制3’末端的加工可诱导Pol II的转录通读产物生成比例的增加,也可导致circRNA形成增加。
1.2 反向剪接与线性RNA的剪接过程相偶联
反向剪接通常发生在基因的中间外显子中,从理论上讲应该会影响线性RNA的剪接。在大多数内源性基因座中,反向剪接的效率远低于线性RNA的剪接的效率(不到1%)。有人提出使用5’和3’剪接位点进行的反向剪接可以与线性RNA的剪接竞争,从而增加了缺少环化外显子的线性RNA的比例。虽然不是所有的剪切过程中跳过的外显子都可以成环,但已经发现一些基因中,成环越多的外显子,最后进入mRNA的比例就越低,例如大鼠细胞色素P450 2C24基因。
目前有两个模型来解释在同一基因座上反向剪接和剪接是如何偶联的。在“直接反向剪接”模型中,首先在中间的外显子发生反向剪接来产生circRNA,下一步剪接产生不带有中间跳过的外显子的线性mRNA。在“套索过渡体”模型中,首先剪接跳过中间的外显子产生线性mRNA,这段剪切下来的片段再发生反向剪切,形成circRNA。虽然在某些基因中已经观察到了外显子跳跃和circRNA产生之间的相关性,但这些机制能否产生circRNA以及哪些特征决定了circRNA是如何产生的仍然是一个谜。不管确切的机制如何,由于下游5‘剪接位点与上游3’剪接位点在空间上不利连接,细胞中的反向剪接的效率一般都很低。
1.3 环状RNA的选择性剪接
一个基因座可以通过可变的反向剪接(改变剪接位点的选择)产生多个circRNA。理论上存在两个模式的可变剪接,每个都是使用不同的下游5‘剪接供体或上游3’剪接受体,从而使单个基因座产生不同的circRNA。在含多个外显子circRNA选择性剪切中,存在四种类型,分别是外显子保留、内含子保留、5‘选择性剪接和3’选择性剪接。在人类细胞的中,超过50%的表达位点可以通过选择性反向剪接产生多个circRNA。
与线性RNA剪接相比,circRNA的选择性剪接至少有三个独特的方面。首先,circRNA的产生可以通过某种方式绕过其同源mRNA产生过程中使用的剪接位点。例如,在CAMSAP1基因中可以产生包括或不包括内含子的两种circRNA异构体。其次,通过选择性反向剪接,circRNA中包含了数千个以前未注释的外显子,这些外显子在mRNA中往往是检测不到的。第三,circRNA特异性的外显子似乎是高度动态调节的。例如,人类胚胎干细胞向神经系分化的过程中,一些外显子在环状RNA(如XPO1基因产生的环状RNA)中的含量显著增加,但在线性RNA中并没有。circRNA的选择性反向剪接是如何实现的,以及选择性剪接的circRNA是否保留功能,仍需要进一步研究。
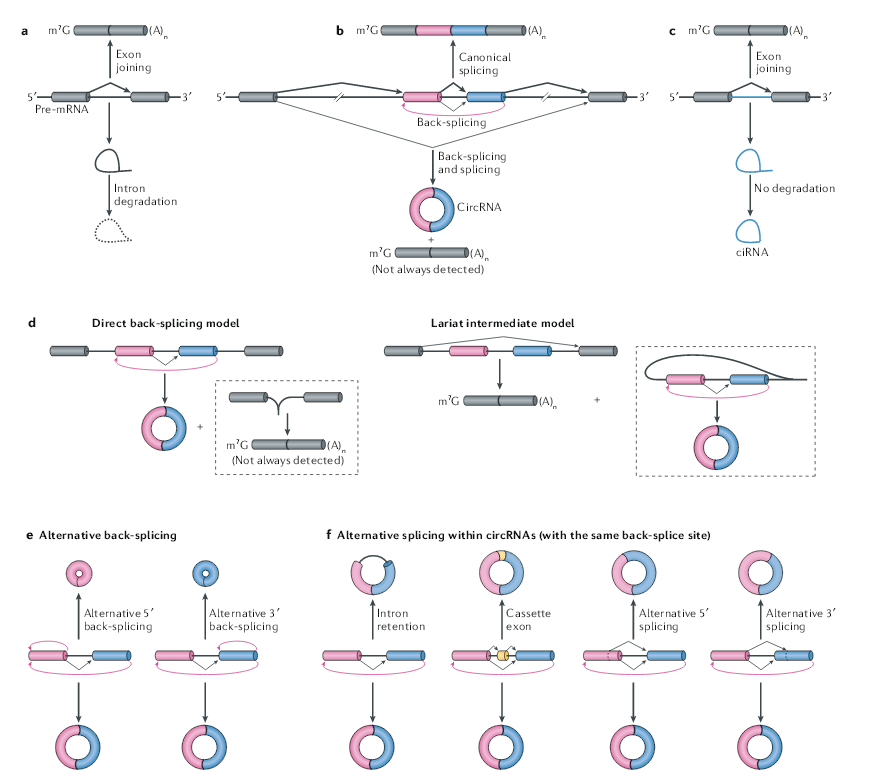
图1 反向剪接介导circRNA的产生
2 环状RNA丰度的调控
2.1 内含子互补元件促进反向剪接
虽然外显子的反向剪接发生在细胞核内,但绝大多数无内含子的circRNA定位于细胞质。因此,circRNA的稳态丰度是由circRNA生成、核输出和降解等因素共同决定的。
侧翼内含子互补序列(ICS)促进circRNA的生成。一项早期的研究发现,小鼠circSry(一种由Sry基因产生的circRNA)两侧有许多ICS,而将ICS插入到载体中就足以产生circSry。在人类细胞中,这种RNA互补通常由反向Alu元件介导,人们也发现RNA的配对能促进无脊椎动物(例如线虫和果蝇)中circRNA的形成。在血小板来源的circRNA的表达载体中,ICS的序列为30-40个核苷酸,甚至23个核苷酸都能诱导表达载体产生circRNA。不同内含子上ICS之间的配对被认为使远端剪接位点更接近,从而增强了反向剪接。表达载体的突变实验表明,消除RNA配对显著降低了circRNA的产量。通过CRISPR–Cas9介导的ICS基因移除,会导致人类细胞的circGCN1L1和鼠细胞的cia-cGAS完全缺失。
一般来说,ICS可以促进circRNA的形成,但它们的存在既不是充分的,也不是必要的。首先,同一内含子中RNA的配对与侧翼内含子之间RNA的配对竞争,从而使线性RNA的剪接变得容易,并减少circRNA的产量。其次,同一基因的不同内含子之间可能形成多个RNA配对,这种竞争可能导致选择性的反向剪接和不同的circRNA的形成。第三,重复元件在哺乳动物基因组中很丰富,但在其它生物中,ICS对circRNA的形成似乎不那么重要。
2.2 反式作用因子调控反向剪接
剪接和可变剪接都受剪接体功能相关的蛋白和与侧翼内含子顺式元件结合的RNA结合蛋白(RBP)的调控。除了ICS调节反向剪接的作用外,许多RBP还控制circRNA的产生。使用表达载体实验显示,剪切因子的缺失会导致剪接向反向剪接转变,如蛋白U1、剪接因子3B复合物和SLU7。用剪接抑制剂isoginkgetin处理大鼠神经元后,发现circRNA的水平也有类似的增加。因此有人提出,当剪接体核心因子减少时,跨内含子的外显子决定复合体(exon definition complexes)效率会降低,导致线性mRNA的产量减少,并促进跨单外显子的外显子决定复合体更有效的的组装。
除了核心剪接体因子外,RBP通常还具有两种模式调节反向剪接:一是通过衔接反向剪切位点促进成环;二是结合ICS位点调控反向剪接。第一种情况包括几种RBP调节的单个基因或多个基因的反向剪接。如在黑腹果蝇中,RBP Muscleblind (Mbl)通过与侧翼内含子中的Mbl结合位点结合,促进了circRNA circMbl的产生。与单个基因的观察不同,QKI与人类细胞上皮-间质转化过程中数百个circRNA的上调有关。QKI是通过与侧翼的内含子结合来增强circRNA的形成,QKI二聚体的形成可以使剪接位点更靠近,以利于反向剪接。异种核糖核蛋白L(HNRNPL)通过直接结合人前列腺癌细胞的侧翼内含子来增强数十种circRNA的形成。在小鼠ES细胞来源的运动神经元中,FUS与侧翼的内含子相互作用,并影响大量circRNA的表达,而对同源线性mRNA的影响不大。
第二种情况,RBP通常包含双链RNA(dsRNA)结合域(dsRBD),dsRBD与ICS结合并稳定侧翼内含子RNA配对。ILF3基因编码的蛋白核因子90(NF90)和NF110包含两个dsRBD,并通过直接结合内含子反向重复Alu元件来促进circRNA的形成。此外,NF90或NF110的缺失导致HeLa细胞中新生circRNA的水平全面降低,将野生型NF90重新引入到NF90缺失的细胞中,可以挽救circRNA表达。尽管NF90和NF110在促进反向剪接方面具有作用,但dsRNA结合蛋白还可以通过破坏RNA配对的稳定性来抑制circRNA的形成。DHX9结合内含子上反向重复Alu元件,并利用其RNA解旋酶活性解开侧翼内含子RNA配对,因此,DHX9的缺失增加了circRNA的水平。RNA 1的腺苷脱氨酶(ADAR1,也称为dsRNA特异性腺苷脱氨酶)通过对反向重复Alu元件的自动编辑来抑制反向剪接。由于这些RBP均与反向重复Alu元件结合,因此尚不清楚它们是否以及如何竞争或协同作用来平衡circRNA的产生。多个RBP很可能通过协同作用以调节反剪接。
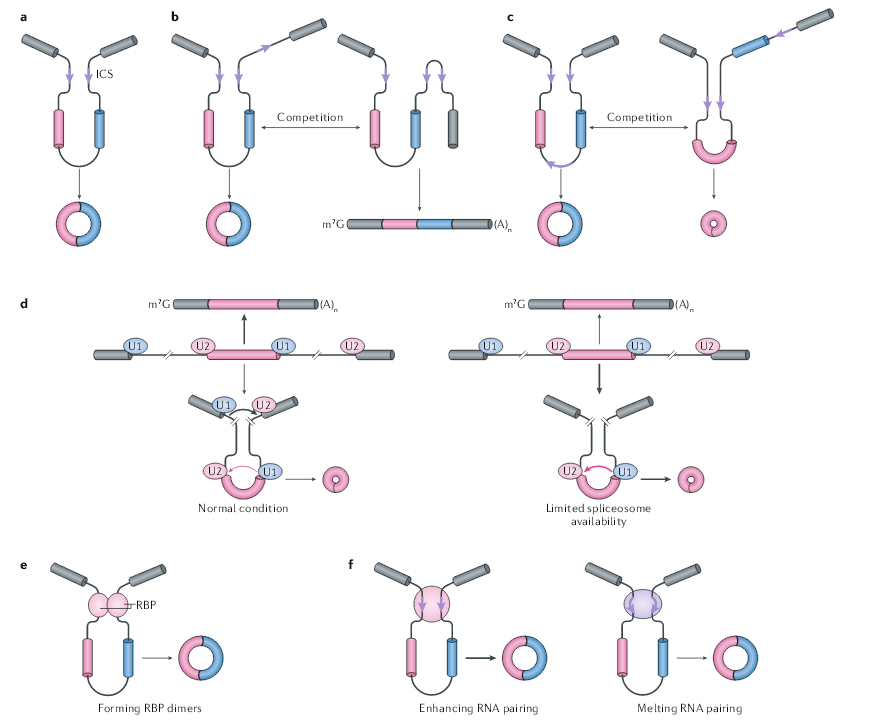
图2 circRNA反向剪接的调控
2.3 circRNA的核输出
与许多线性mRNA类似,含有内含子的circRNA经常被隔离在细胞核中,大多数的circRNA主要位于细胞质中。如何调控circRNA的核输出或保留的机制研究仍不清楚,最近的一项研究使用RNA干扰技术(RNAi)筛选来确定控制circRNA核输出的关键因素。这项研究表明,黑腹果蝇中ATP依赖性的RNA解旋酶Hel25E(也称为WM6)的缺失导致了长(超过800个核苷酸)circRNA在细胞核中的特异性积累。同样,DDX39B或DDX39A(Hel25E的两个人类同源物)的缺失分别导致长(大于1300个核苷酸)或短(小于400个核苷酸)circRNA在细胞核中的积累。这些结果表明,circRNA根据其长度以某种方式参与其输出。此外,人类细胞中的大多数circRNA都短于500个核苷酸并趋于形成RNA双链体,而长circRNA可能采用不同的构象。短circRNA和长circRNA之间的构象差异可能解释了Hel25E的差异募集。最后,N6-甲基腺苷(m6A)修饰广泛发生在circRNA上,考虑到m6A对mRNA不同方面的影响,包括m6A结合蛋白YTHDC1对甲基化mRNA核输出的影响,有待确定m6A是否影响circRNA的输出。
2.4 circRNA的降解
circRNA由于其环状结构,这使它们能够抵抗RNA外切酶的降解。circRNA比其同源线性转录本更稳定,circRNA半衰期的中位数为18.8至23.7小时,而同源线性RNA半衰期的中位数仅为4.0–7.4小时。不管circRNA的先天稳定性如何,最近的研究表明它们在正常条件下和应激条件下都会发生降解。一方面,miRNA与circRNA结合可以启动circRNA降解。例如,circRNA CDR1as含有miR-671结合位点,它们的结合会介导AGO2对 CDR1as的降解。但是,这种降解似乎是CDR1as特有的,绝大部分circRNA结合miRNA的位点仅由几个碱基构成,这不足以激发AGO2介导的靶向降解circRNA作用。
其它的核酸内切酶也参与circRNA的降解。胞质核酸内切酶RNase L在病毒感染过程中病原dsRNA的存在下被激活,之后广泛降解circRNA。核糖核酸酶复合物RNase P / MRP可降解m6A修饰的circRNA。该降解由m6A识别蛋白YTHDF2和HRSP12调控,HRSP12可以连接YTHDF2和RNase P / MRP来介导RNA的降解。此外,高度结构化的circRNA可以被UPF1及其相关的核酸内切酶G3BP1所降解。然而,负责维持正常和未受压细胞中circRNA稳态的其它途径仍尚待鉴定。
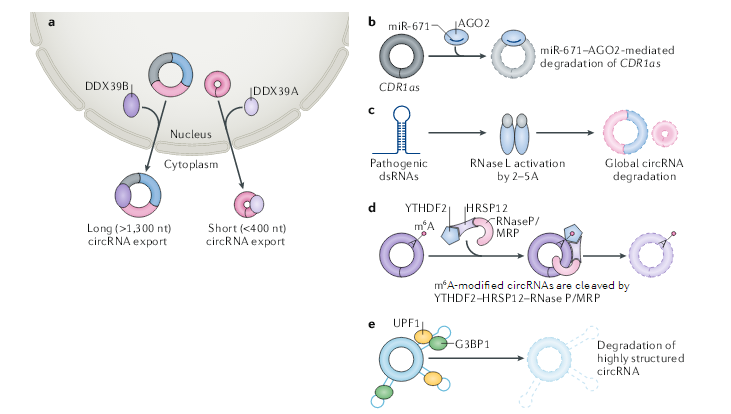
图3 circRNA核输出和降解的调控
3 环状RNA的功能机制
3.1 环状RNA调节转录、剪接和染色质相互作用
细胞核中的circRNA参与转录的调控、选择性剪接和染色质环化(looping)。在拟南芥中,circSEP3调节SEPALLATA3(也称为SEP3)的剪接,SEPALLATA3是花卉同源表型所需同源MADS-box的转录因子。circSEP3源自SEP3的第6外显子,并与其同源DNA形成RNA-DNA双链,导致转录暂停,随后跳过第6外显子,并形成选择性剪接的SEP3 mRNA。在玉米中,着丝粒逆转录转座子转录的RNA中发现了反向剪接,生成的circRNA与着丝粒结合通过形成R环来促进染色质环化。下一步需要探索circRNA如何保留在细胞核中以及它们如何精确地参与基因调控。
3.2 环状RNA可以充当microRNA诱饵
一旦进入细胞质,一些circRNA就会起竞争性内源性RNA(ceRNA)的作用,它们作为miRNA海绵与miRNA结合并阻止其对靶mRNA的抑制作用。尽管担心细胞中实现ceRNA作用所需的circRNA和miRNA结合位点的数量,但已显示出几种丰富的circRNA可以充当miRNA海绵。小鼠circSry包含16个miR-138的靶位点,并与睾丸发育有关。在人类细胞中,circHIPK2是miR124-2HG的海绵,并可以在自噬和内质网应激期间调节星形胶质细胞的活化,而circHIPK3的高表达则通过海绵化多个不同的miRNA来促进细胞增殖或调节胰岛素分泌。此外,circMAT2B97和circASAP1可以通过在缺氧条件下激活circMAT2B–miR-338-3p–PKM2轴或circASAP1–miR-326–miR-532-5p–MAPK1–CSF1信号通路来促进肝癌的发展。
在已报道的所有circRNA中,最引人注目的是CDR1as(也称为ciRS-7),它含有70多个miR-7保守的结合位点,并在哺乳动物脑中大量表达。人类细胞系中CDR1as的表达降低导致携带miR-7结合位点的mRNA表达降低,这表明CDR1可以作为miR-7的海绵并发挥ceRNA作用。在小鼠中,Cdr1as的缺失会导致miR-7的表达降低和其相关的靶mRNA的变化,并表现出兴奋性突触传递功能障碍的神经精神疾病,表示Cdr1as可能会具有稳定miR-7的作用,但是机制尚不清楚。
Cdr1as–miR-7轴还受长链非编码RNA Cyrano(也称为Oip5os1)的调控,Cyrano可以结合miR-7并因此促进miRNA降解,是从miR-7的3’末端的拖尾和修剪开始。这种降解反过来使Cdr1as在小鼠大脑中积累。在Cyrano缺失的小鼠中,miR-7水平的升高会导致神经元中Cdr1as的降解。在小脑中,另一种miRNA miR-671也会促进Cdr1as的下调。尚不清楚miR-671和miR-7在介导Cdr1as抑制中是如何协同的。由于哺乳动物中的circRNA通常以低水平表达,并且与miRNA的结合位点相对较少,因此应仔细考虑低表达的circRNA是如何控制miRNA的稳定性和数量的。
3.3 环状RNA充当蛋白支架
circRNA在其生命周期中经常与不同的蛋白质结合。例如,含有外显子和内含子的circRNA(EIciRNA)可以通过与小核糖核蛋白U1和Pol II相互作用来促进其亲本基因的转录。circFoxo3在小鼠非癌细胞中高度表达,并与细胞周期相关。它与细胞周期蛋白依赖性激酶2(CDK2)和细胞周期蛋白依赖性激酶抑制剂1(p21)相互作用,形成circFoxo3-p21-CDK2三元复合物并抑制CDK2功能,这通常是细胞周期所必需的。circACC1通过与AMPK β和γ调节亚基形成三元复合物,促进AMP激活蛋白激酶(AMPK)全酶的酶促活性,使细胞适应无血清培养。circAMOTL1,在新生儿心脏组织中高度表达。它同时与激酶AKT1和磷酸肌醇依赖性激酶1(PDK1)结合,通过PDK1导致AKT1磷酸化,从而促进有心脏保护功能的AKT1的核定位。
3.4 环状RNA可以竞争性结合蛋白
circRNA可以结合蛋白质,其中多个circRNA可以充当蛋白质的海绵。例如,circMbl通过结合MBL蛋白并阻止其执行其它神经功能。circANRIL与动脉粥样硬化性心血管疾病有关,它通过与核糖体60S亚基装配必需因子结合,抑制血管平滑肌细胞和巨噬细胞中核糖体的产生,从而导致与动脉粥样硬化相关的核仁应激和细胞死亡。circPABPN1大多数定位于细胞质,并抑制RBP HuR(也称为ELAVL1)与其线性同源PABPN1 mRNA的结合,从而导致mRNA翻译减少。
3.5 环状RNA的宏观生物学功能
与上文提及细胞中是否存在足够数量的ceRNA和miRNA结合位点的担忧类似,通常低表达的circRNA是如何对高表达的蛋白进行调控,需要精密检测circRNA及其相关蛋白之间的化学计量关系。例如,HuR会影响RNA的输出,稳定性和翻译,它是一种非常丰富的蛋白质。尽管circPABPN1可以有效抑制HuR与PABPN1 mRNA的结合,但尚不清楚低含量的circPABPN1是如何发挥这种作用,即使考虑到circPABPN1包含多个HuR结合位点也是如此,因为相同的结合位点也存在于同源线性mRNA中,并比环状RNA丰富得多。因此,仍然需要阐明circPABPN1与HuR特异性结合的分子机制。据推测,circRNA(而非其同源mRNA)采用独特的构型和/或经过独特的修饰以实现与HuR的强特异性结合,或者在特定生物亚细胞微环境中发挥作用。除了从特定circRNA分析其功能,胞内总circRNA作为一个整体,也有其生物学功能。胞内总circRNA可以通过结合双链RNA结合蛋白NF90,NF110 及PKR等发挥功能。早期研究中还发现,ALS疾病中累积的套索内含子环状RNA可阻遏TDP43的毒性作用。人类中DBR1双等位基因突变可促进套索内含子环状RNA,导致对脑干严重病毒感染的易感性增高。这些例证均暗示胞内总circRNA也可以发挥特定的功能,不依赖于其序列。
值得注意的是,circRNA的这些作用方式(支架或竞争性结合蛋白)并不是相互排斥的,需要其它研究来确定在不同情况下circRNA和蛋白质相互作用的分子基础。
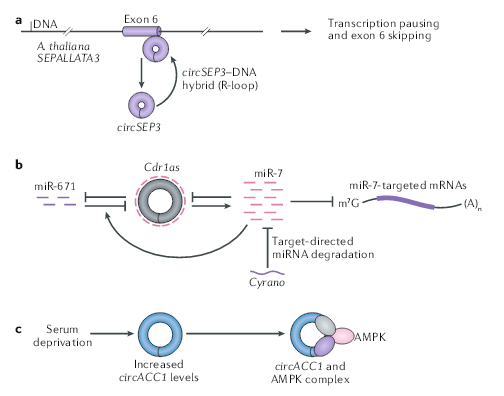
图4 circRNA的功能机制
4 环状RNA在细胞和生理状况下作用
4.1 环状RNA在免疫系统中的作用
使用双色报告系统同时检测剪接和反向剪接的反式作用因子,它们可能会影响circRNA的产生,来寻找内源性circRNA与先天免疫应答之间的联系。该方法已鉴定出100多种可以特异性调节反向剪接的蛋白质,其中包括30多种剪接调节剂,例如FUS和HNRNPL,以及16种在免疫应答中有作用的因子。在这些免疫因子中,存在先天免疫相关的NF90和NF110,如前所述,NF90和NF110通过稳定侧翼内含子反向重复Alu元件配对来促进反向剪接。用模拟病原dsRNA的poly(I:C)处理细胞后,例如水泡性口炎病毒(VSV),NF90和NF110迅速输出到细胞质中,与病毒mRNA结合并介导翻译抑制,同时,它们在细胞核中的缺失导致了circRNA的产生减少。circPOLR2A或circmCherry的异位表达,减轻了NF90或NF110与VSV mRNA的结合,从而导致VSV复制增强。这项研究表明,在感染病毒后,宿主细胞必须以某种方式限制circRNA的产生,而增加的circRNA水平可以促进病毒繁殖。
不仅在病毒感染期间circRNA的产生受到限制,细胞中80-90%的circRNA会被激活的RNase L迅速降解。RNase L可以快速降解circRNA,至少部分原因是由于NF90和NF110的核输出导致细胞中反向剪接效率低下所致。因此,新产生的circRNA数量不足以替代迅速降解的数量。在病毒感染后,RNase L快速且全面降解circRNA,导致释放PKR、NF90和NF110产生抗病毒活性。
circRNA自身在免疫反应中也有作用。 例如,cia-cGAScan可保护静态造血干细胞免受先天性免疫反应介导的疲劳。在小鼠肠干细胞中,circPan3增强了编码IL-13受体亚基α1的mRNA的稳定性,从而最终激活了WNT信号通路,这是维持肠干细胞所必需的。
4.2 环状RNA在细胞增殖和肿瘤发生中的功能
全基因组研究表明,前列腺癌和大肠癌细胞系的circRNA水平普遍降低,据报道,circRNA丰度与增殖之间呈负相关,表明circRNA水平可以通过快速细胞分裂来稀释。这一观点得到支持,用激酶抑制剂dinaciclib处理后,前列腺癌细胞增殖减少导致circRNA水平增加了约50%。circRNA在调节细胞增殖中可能独立于其线性同源RNA。据报道,circPOK与其线性同源转录物无关,通过编码转录因子而起着抑癌作用。在间质性肿瘤发生的背景下,circPOK通过共同激活ILF2-ILF3转录因子复合物来充当非编码原癌RNA。在小鼠异种移植模型中,受损或增强的circACC1表达分别通过调节AMPK全酶的酶促活性导致生长抑制或增强。最近的研究表明,由病毒基因组产生的circRNA与细胞增殖和转化有关。例如,卡波西氏肉瘤疱疹病毒circRNA位于病毒裂解基因的开放阅读框中,并通过诱导裂解周期上调来改变细胞生长。
4.3 环状RNA在神经元中的功能
有人指出,circRNA在哺乳动物的大脑中、神经元细胞系、神经产生过程、以及果蝇的神经组织老化中高水平积累。circRNA在神经元中的高表达可能归因于其稳定性,因此在这些缓慢分裂的细胞中积累。例如,在人类ES细胞和人类ES细胞衍生的前脑神经元中,circRNA产生的动力学基本保持不变,但是前脑神经元的circRNA的丰度和多样性都大大增加。此外,许多circRNA在突触形成过程中变得更加丰富,这些观察表明,circRNA可能调节突触功能。在人、小鼠和果蝇之间,一些大脑特异性的circRNA是保守的,表明它们具有调控神经元的功能,可能由于其高度稳定性而与记忆有关。在Cdr1as基因敲除小鼠中,与神经精神疾病相关的兴奋性突触传递功能障碍也支持circRNA在神经元中的重要性。
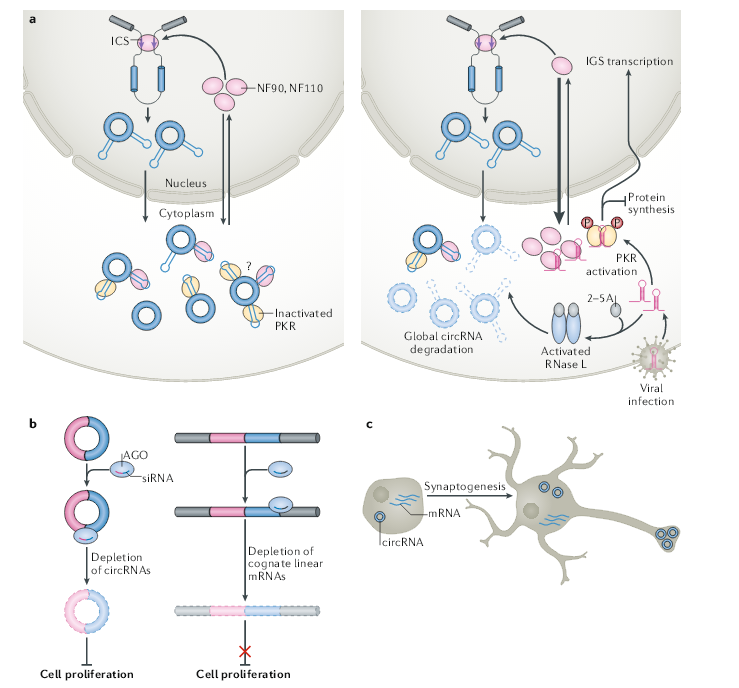
图5 circRNA在细胞和生理状况下的作用
5 环状RNA的潜在应用价值
环状RNA的共价闭环结构赋予circRNA高稳定性,独特的分子构象,体外合成circRNA还具有潜在的免疫原性。最近一些研究也尝试设计基于环状RNA的细胞功能探测和细胞内过程的操纵工具,调控miRNA功能,阻抑先天免疫效应,增强应答,增强蛋白翻译效率。circRNA还是很好的疾病诊断标志物。
近几年的研究让我们从发现并认识了转录组中的一个新成员circRNA。这种转录产物的存在和一些生物学功能,但还有很多的问题没有认识清楚,包括:
(1)circRNA的表达定位机制还不清楚。特别是不同生物学环境下circRNA特有的生成机制,例如是否存在某种因素只介导了反向拼接,而没有参与正常拼接的过程?
(2)circRNA与线性RNA不同可变剪切方式的机制是什么?
(3)m6A是否参与了circRNA的生成和代谢?
(4)在非压力条件下,circRNA是如何降解的?
(5)究竟有多少功能性circRNA分子存在?这还需要大量的工作来筛选。
(6)表达量如此低的circRNA分子如何有效竞争性结合miRNA,结合蛋白?
(7)特定的circRNA分子翻译的产物是它们的关键功能吗?
(8)体内需要抑制多少量的内源circRNA可以产生表型?
(9)circRNA在天然免疫、大脑及其它生理活动中的作用机制是怎样的?
(10)circRNA-蛋白复合物的主要成分是什么?
(11)新技术,例如CRISPR-Cas碱基编辑,CRISPR-Cas13靶向RNA的技术体系能用于分析circRNA的生成和功能研究吗?能避免对线性RNA的影响吗?
这些问题也是困扰circRNA研究的重要科学问题。
参考文献
(1)Ling- Ling Chen, The expanding regulatory mechanisms and cellular functions of circular RNAs,Nature Reviews Molecular Cell Biology (2020),https://www.nature.com/articles/s41580-020-0243-y
.png)
