发表高影响因子的文章是每个科研人员的理想,那些成功发表了高水平文章的“别人家的工作”特别值得学习一下。今天给大家分享的是5月30日在Cell Metabolism杂志发表的一篇研究论文,文章的通讯作者是中国科学技术大学的吴缅教授和安徽医科大学的胡汪来教授[1]。其中吴缅教授是今年第五届circRNA研究论坛的特邀嘉宾之一。
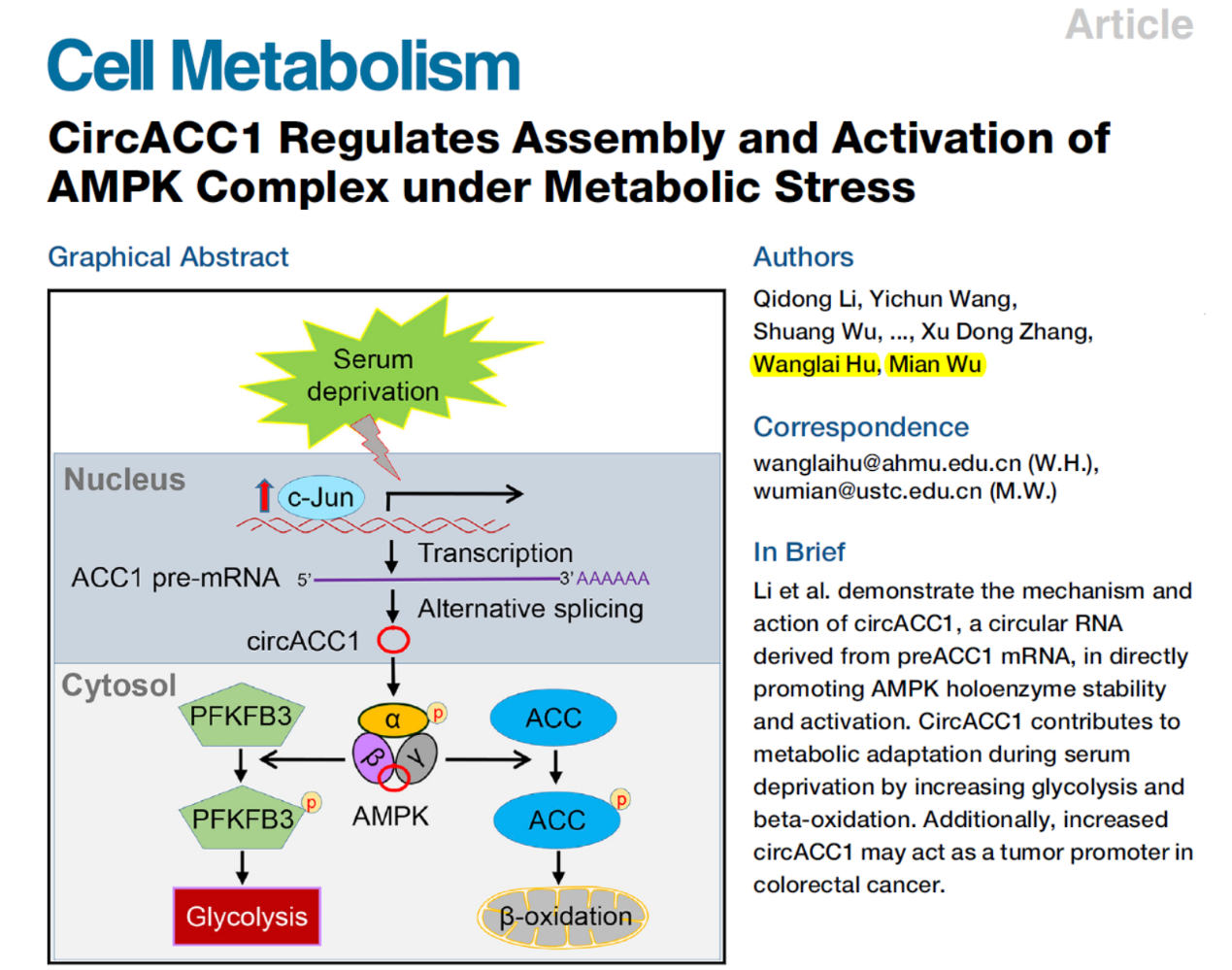
相信大家在刚看到这篇文章的时候一定会在心里琢磨,这项circRNA的工作是关于哪方面的?具体怎么发现和研究这个circRNA的功能的?对circRNA的研究(我自己的工作)有什么借鉴价值?他们的工作为什么能发表在Cell Metabolism杂志上?……
circACC1如何发现和鉴定的?
作者一开始的出发点是希望找到与代谢相关的circRNA,并分析这些circRNA在代谢过程中的作用机制。作者首先将探索的范围指向了与脂代谢有关的91种基因,在2013年的那篇Nature文章(最早提出miRNA Sponge功能模型的文章之一,[2])鉴定到的分子中找出涉及到的基因,上面的91种基因中有6个基因来源的7个circRNA分子在这篇Nature文章中提到了[2]。以此为基础,作者在HCT116细胞中在RNase R消化后QPCR检测了它们的表达情况,七种circRNA都有表达。为找到与脂代谢有关的circRNA分子,作者又针对这些分子做了siRNA,结果表明只有来自ACC1基因的circRNA ,circACC1(hsa_circ_001391,circBank ID:hsa_circ_0000759)与脂代谢有关。
circACC1全长383bp,没有小鼠的同源分子。反向引物也排除了这一分子来源于基因组重排导致的转录产物的可能性,RNase R消化后Northern杂交证明了是环状的RNA产物。Actinomycin D处理(抑制RNA转录)表明circACC1比它的来源基因的线性mRNA稳定性高。此外,作者还基于信息学预测到circACC1有一个打分比较低的IRES元件(64-175bp),将这一段插入到拆分的GFP报告基因载体中没有得到GFP产物。(该报告载体的原理是如果所克隆的IRES是有功能的,在转录生成的环状RNA产物中会驱动下游完整的GFP表达,反之,如果IRES没有功能,或者无法准确的形成报告环状RNA分子,则不能产生GFP蛋白。)
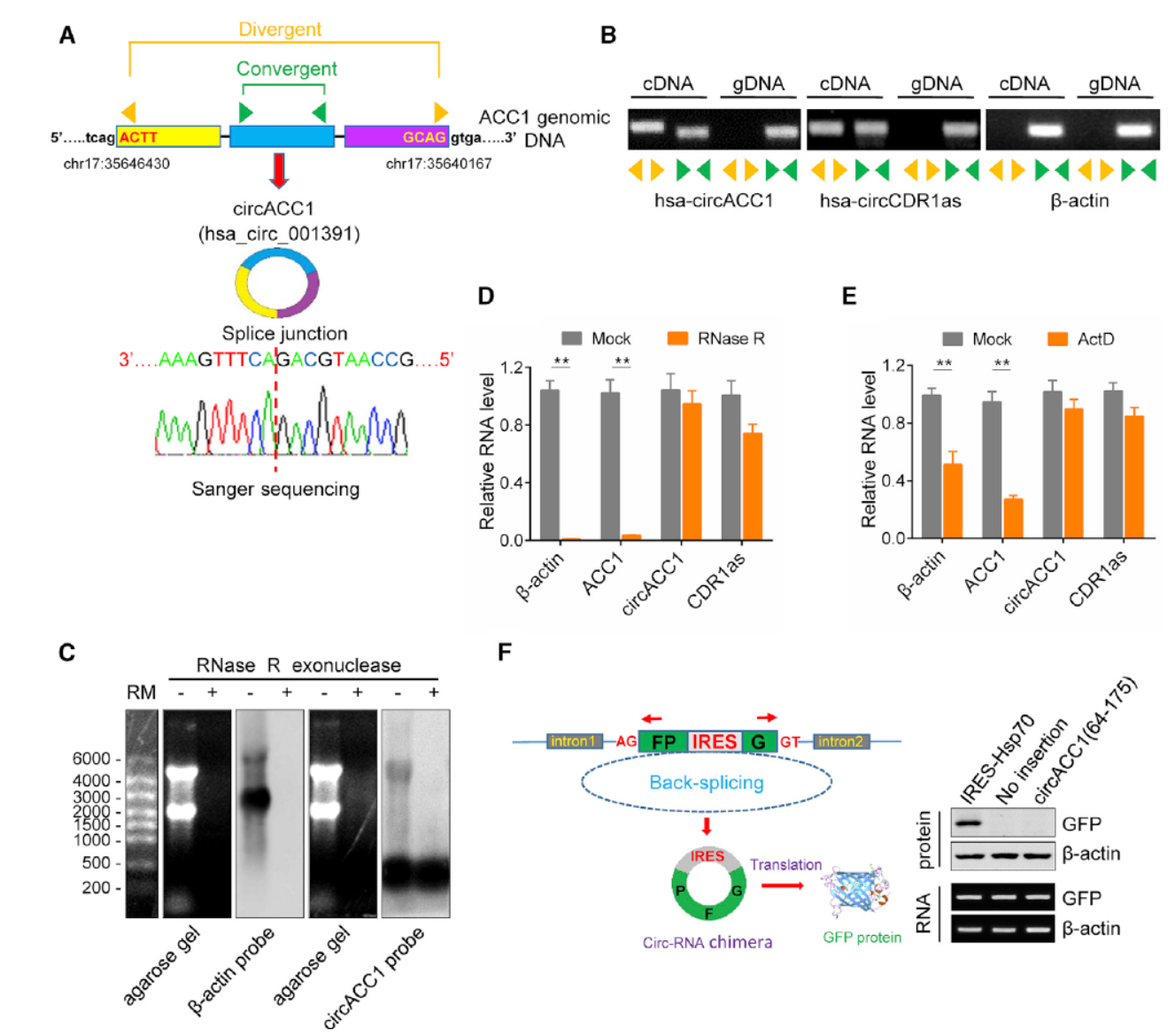
图1 circACC1发现与鉴定 ([1])
如何分析circACC1在脂代谢中的功能?
作者在HCT116细胞和LO2(人肝脏的非肿瘤细胞系)中敲低circACC1发现可以导致脂滴数量的增加,过表达circACC1则降低脂滴数目。敲低circACC1或过表达circACC1均没有对其母基因ACC1的mRNA和蛋白的表达水平造成影响,因此可以确定这些现象都是circACC1的变化导致的,而非因为对母基因的扰动造成的伴随现象。基于这一发现,作者对干扰circACC1后的HCT116细胞中脂类物质的代谢组学分析,包括基于液相色谱的不同脂类物质的分析和气相色谱的不同脂肪酸的含量情况,结果表明干扰circACC1后会导致各种脂类物质的普遍增高。
AMPK是细胞感受能量压力并调控代谢的重要信号中枢,在应激条件下(ATP浓度较低的时候回产生少量的AMP分子),AMPK可被磷酸化激活,然后调控下游代谢相关的基因,包括磷酸化PFK-2促进糖酵解,磷酸化ACC1抑制脂肪酸合成,磷酸化ACC2促进脂肪酸氧化。
在敲低circACC1后Western检测表明敲低circACC1能抑制ACC1的磷酸化,PFKFB3的磷酸化(该基因是PFK-2的一种亚型),与此同时AMPK酶的磷酸化水平和三种亚基的表达量均有所下降。过表达circACC1促进PFKFB3磷酸化,也能恢复因敲低circACC1后所造成的代谢状态变化。敲低circACC1后细胞内ATP,NADPH及胞外乳酸含量均有所下降,ROS增高,过表达circACC1后现象几乎相反。ECAR测试表明敲低circACC1后HCT116 和LO2细胞ECAR水平均有所下降,OCR分析表明敲低circACC1后显著降低回补FFA(棕榈酸酯,正常细胞中添加该底物后可诱导OCR升高)诱导的OCR增高(抑制细胞对脂类底物的利用能力)。综上所述,基于敲低和过表达circACC1后脂代谢的分析表明circACC1可调控脂肪酸的氧化和糖酵解通路,AMPK在circACC1发挥功能的过程中起重要作用。(反复论证,证据链充实)
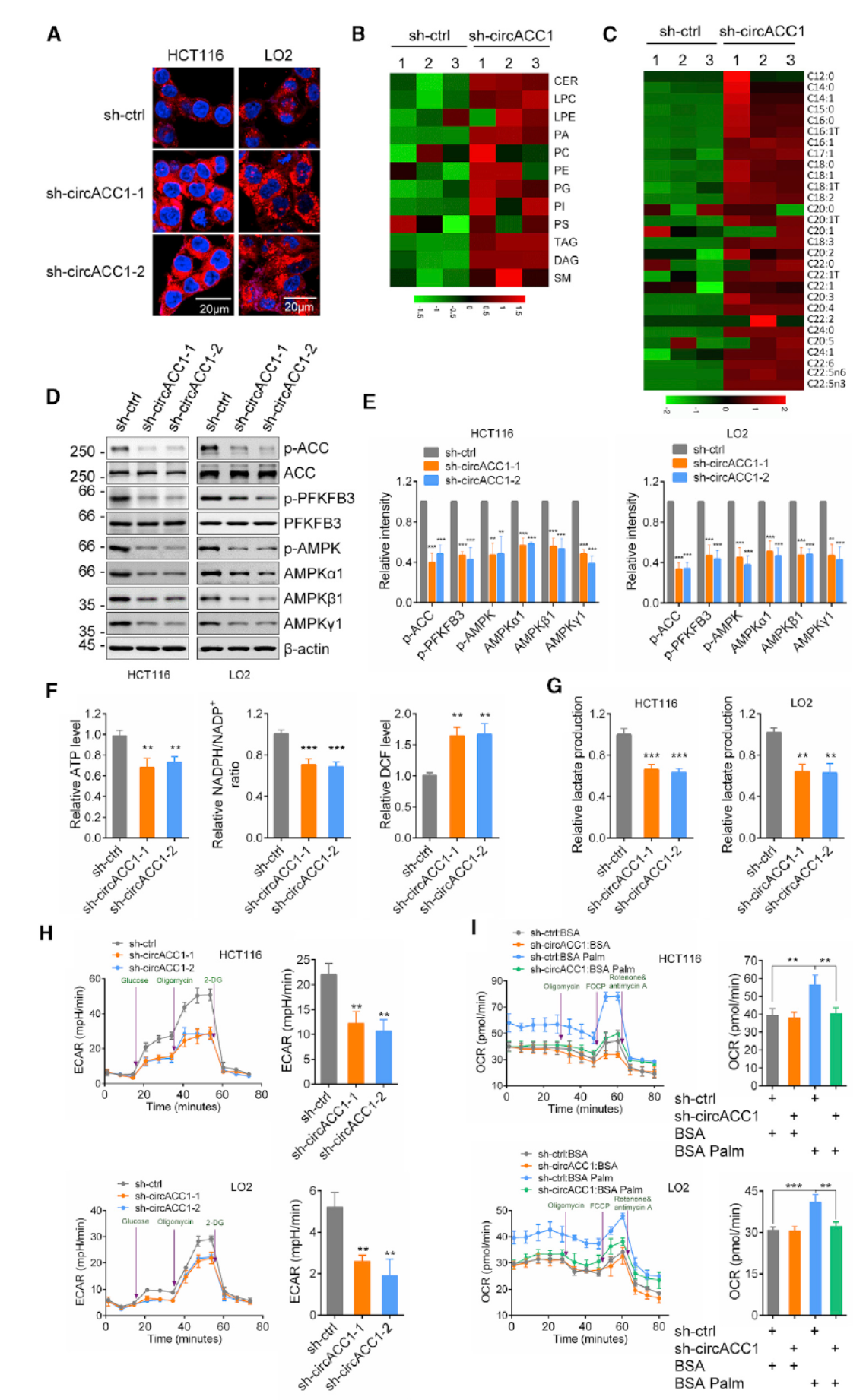
图2 circACC1促进糖酵解和脂肪酸氧化 ([1])
如何发现circACC1与AMPK亚基相互作用的?
AMPK与circACC1的功能有关,那么它们之间的相互作用关系就非常值得分析。实验表明AMPK与circACC1均存在于胞浆中。RNA pull-down实验表明circACC1的反义链探针可以有效捕获AMPK的三个亚基及HuR蛋白。这说明circACC1与AMPK的确存在相互作用,但这还不够,因为AMPK由三种不同的亚基构成,circACC1是否有亚基特异性的结合还不能通过这一实验得出结论。
因此作者通过分别构建Flag融合的三种亚基,RIP实验分析它们捕获circACC1的情况,结果表明α亚基并不能捕获circACC1,而β和γ亚基都可以。商业化的β和γ亚基抗体也可以有效的捕获circACC1,这初步说明circACC1对AMPK的各个亚基的结合是有选择性的。为进一步弄清楚circACC1与AMPK三种亚基之间的相互作用关系,作者构建了Flag融合的γ亚基,HA融合的β亚基,然后将同一个样品进行双重IP实验。第一步先用Flag抗体进行一次IP,产物再用HA抗体进行IP,结果表明两次IP后的产物均可同步检测到circACC1和AMPK的三种亚基,说明它们之间的相互作用是比较紧密牢固的,但关于circACC1与三种亚基之间的相互作用关系依然无法完全清楚。EMSA实验可在体外分别对单个亚基和circACC1进行结合力分析,体外转录后连接得到circACC1,分别与人工表达纯化的AMPK的三种亚基进行结合力分析,结果证明只有β和γ亚基能够结合circACC1。进一步,作者还构建了β和γ亚基的突变体及circACC1的突变体,表明β亚基的C端和γ亚基的N端是与circACC1相互作用的位置。自由能分析结果显示circACC1的稳定结构可分为两个区段,将circACC1序列拆分为两段P1(1-184)和P2(185-383)后进行Pull-down分析,表明P1段是与β和γ亚基相互作用的区段。进一步,将P1段拆分为P1a(1-97)和P1b(98-184),构建删除P1a或P1b的突变型circRNA,Pull-down实验结果表明P1a和P1b分别是circACC1与γ和β亚基相互作用的位置。
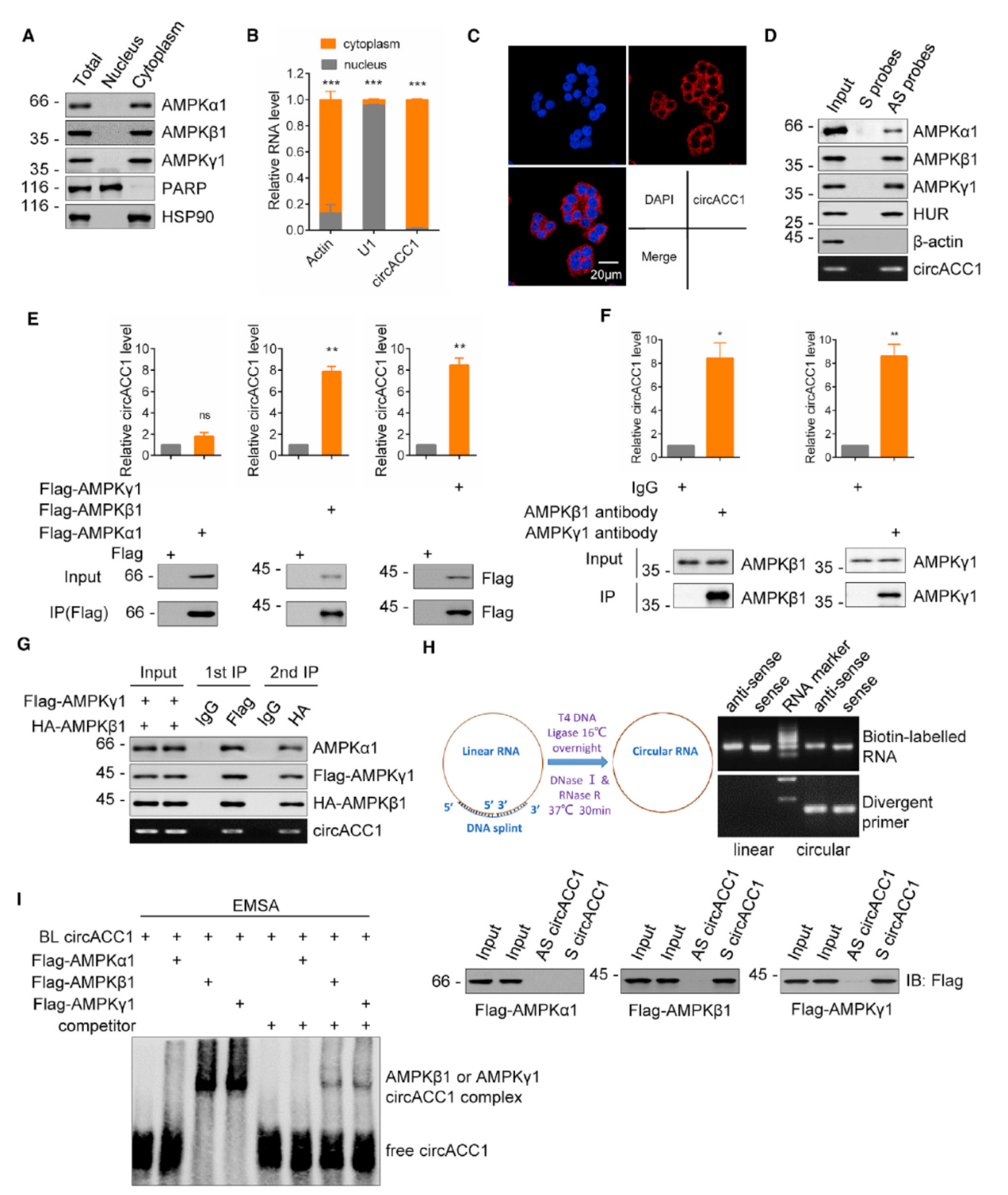
图3 circACC1与AMPK亚基相互作用分析 ([1])
circACC1与AMPK亚基相互作用的生理功能如何研究?
现在明确了circACC1与AMPK的β和γ亚基直接相互作用,那么circACC1如何在AMPK信号通路中发挥作用呢?在上面的实验结果中,曾经发现敲低circACC1可以导致AMPK三种亚基均下调,那么是否circACC1能够调控AMPK的稳定性?蛋白酶体抑制剂MG132能够恢复因敲低circACC1造成的AMPK三种亚基的蛋白含量,并且敲低circACC1能够增加三种亚基的多聚泛素化水平。circACC1只与AMPK的β和γ亚基,为什么在敲低circACC1后会导致所有的亚基都被多聚泛素化-蛋白酶体降解呢?分别干扰AMPK三个不同的亚基,然后分别分析对三种亚基的影响,结果表明单独干扰AMPK的任何一种亚基均可导致三种亚基同时降低。在MG132处理条件下敲低circACC1后分别用不同亚基的抗体分析与另外两种亚基的结合能力,结果发现circACC1敲低后三种亚基之间的结合能力降低(CoIP后捕获另外两种亚基的能力下降)。综合这些发现,可以得出结论,circACC1具有提高AMPK全酶稳定性的作用。
circACC1与AMPK的β和γ亚基相互作用如何调控AMPK全酶的稳定性的?为了回答这个问题,作者用哺乳动物双杂交的实验进行了分析。哺乳动物双杂交实验是分析蛋白相互作用的一种方法,将待测蛋白分别与Bait和Prey融合,如果有相互作用,就可以组合成完整的荧光素酶,可以通过测定底物pG5luc被消耗的速率来定量分析相互作用的强弱。分别将β和γ亚基与Bait和Prey融合,分析敲低circACC1前后对相互作用的影响,结果显示,敲低circACC1对于α和β亚基的相互作用影响较小,对α和γ亚基的相互作用有一定的影响但也不是很显著,对β和γ亚基的相互作用影响比较明显。过表达circACC1促进β和γ亚基的相互作用。
体外分别纯化AMPK三种亚基和ACC1,分析circACC1存在与否对AMPK的影响,结果表明circACC1能够有效促进AMPK全酶的活性,与AMPK激活剂(A-769662)的作用相当。A-769662激活有关的位点AMPKβ (S108A)突变后,circACC1不能再促进AMPK的活性,P1a和P1b删除的circRNA突变体也不能激活AMPK活性,也不能再促进AMPK的稳定性。这些数据说明circRNA通过与β和γ亚基相互作用促进其稳定性,增加其活性。
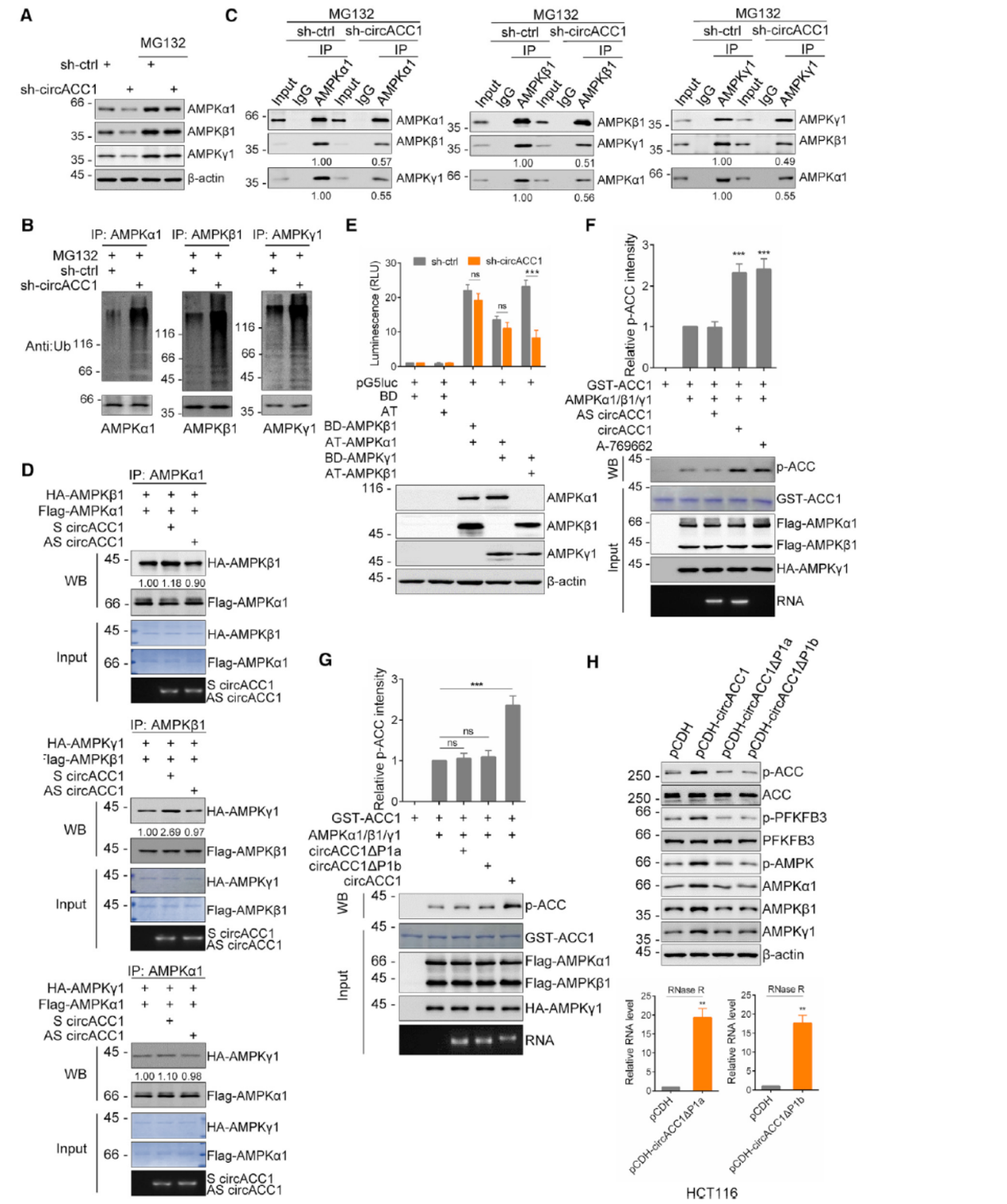
图4 circACC1调控AMPK稳定性和活性 ([1])
circACC1如何调控AMPK的功能?
AMPK在细胞能量代谢中起重要的调控作用,能通过感受一些应激条件调控下游代谢通路变化。作者分析了不同刺激条件对circACC1表达的影响情况,发现血清饥饿能够有效刺激circACC1的表达。设计QPCR引物分别检测ACC1的早期转录本,成熟mRNA和circACC1,在血清饥饿的不同时间点分别分析这几种RNA产物的丰度,表明血清饥饿能够有效激活ACC1基因的早期转录和circACC1的生成,但对circACC1成熟mRNA的影响不明显。血清饥饿的基础上恢复血清则降低ACC1的前体RNA和circACC1的丰度。这说明circACC1的生成是受到特殊机制调控的。
AMPK的活性受到多种上游激酶的调控,包括LKB1,CaMKK2和TAK1,circACC1是否有可能是通过影响这些上游基因额影响AMPK的功能?分别将它们干扰,然后过表达circACC1,分析ACC1,BFKFB3及AMPK的磷酸化状态和AMPK三种亚基的表达情况。结果显示,circACC1均可上调AMPK的活性,这说明circACC1激活AMPK的活性是不依赖这些激酶的。已报道如果同时敲除LKB1和CaMKK2可导致AMPK活性的完全丧失,作者也重复并验证了这一现象,在此条件下过表达circACC1仅能微弱的回复AMPK的活性,说明circACC1仅能在本底水平调节AMPK的活性,并不是显著调控其活性的通路。
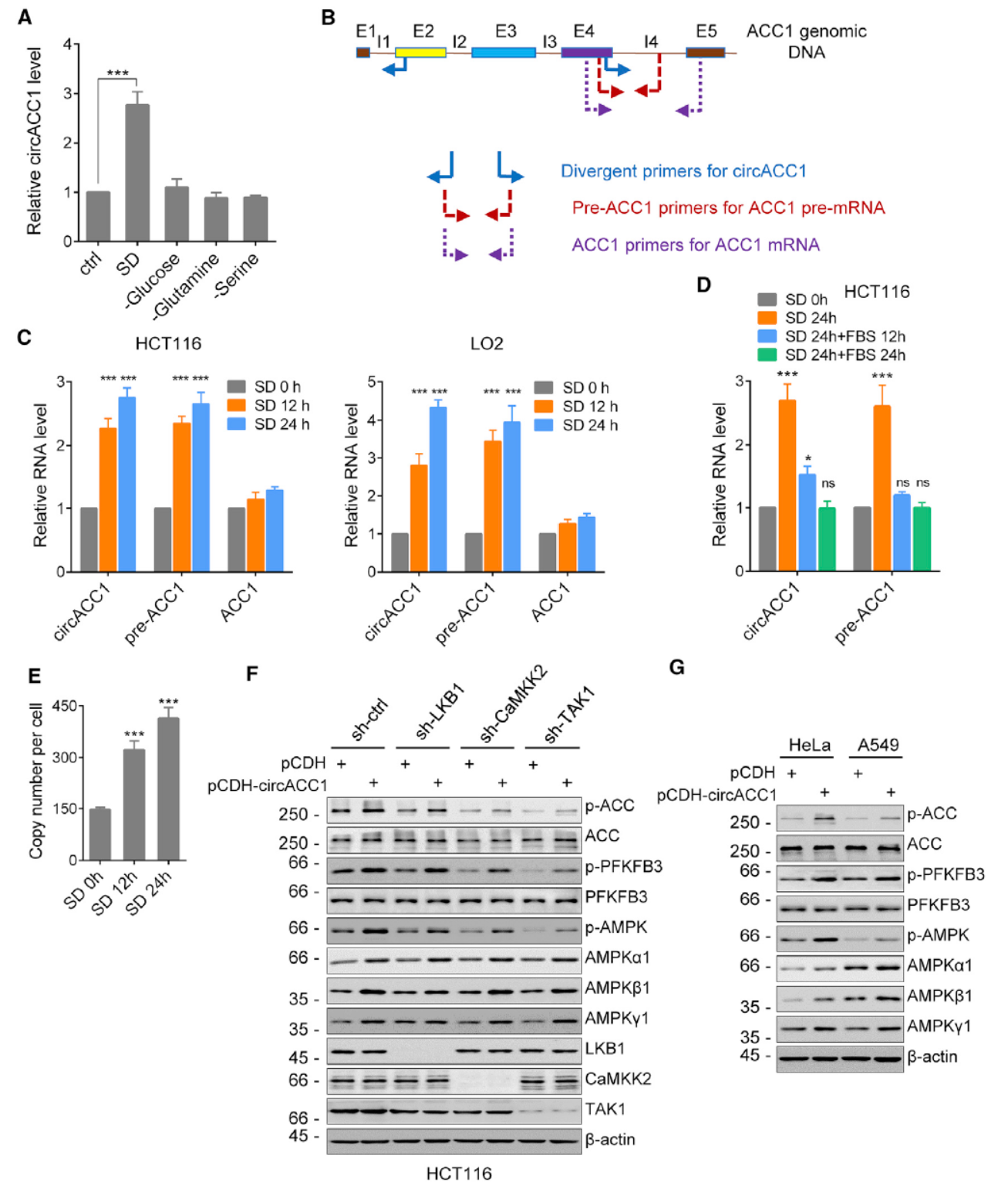
图5 circACC1调控AMPK的基础活性 ([1])
血清饥饿如何刺激circACC1的表达?
分析ACC1基因的启动子,发现有CEBPA,c-Jun,CREB1和SREBF1的结合位点。分别对这些转录因子进行干扰,分析血清饥饿后circACC1的表达是否受到影响,结果表明c-Jun参与了circACC1的表达。磷酸化c-Jun的ChIP实验和荧光素酶报告系统确认了c-Jun与ACC1启动子的结合。血清饥饿后JNK,c-Jun的磷酸化状态,ACC1等代谢酶的磷酸化状态均有上升。干扰c-Jun后ACC1,AMPK和PFKFB3的磷酸化水平略有下降,在此基础上过表达circACC1可回补这些变化,说明血清饥饿后促进c-Jun磷酸化并增强了circACC1的表达,促进AMPK和相关代谢酶的磷酸化。
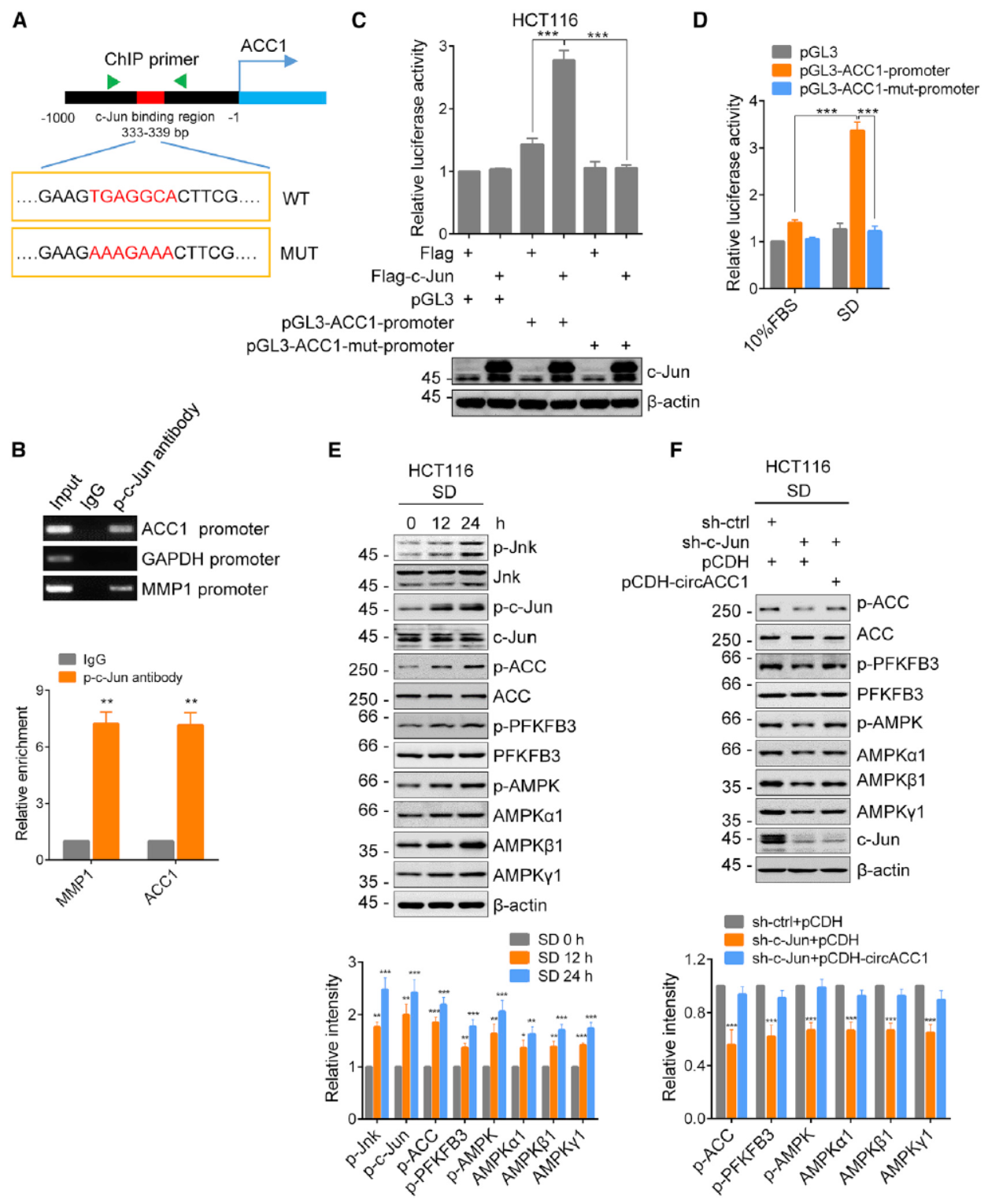
图6 c-Jun介导血清饥饿后circACC1的表达 ([1])
circACC1在肿瘤中的作用是怎样的?
HCT116细胞中敲低circACC1后显著抑制细胞增殖,但培养基中添加ATP或NAC可部分恢复干扰circACC1的克隆生成效率降低。体内成瘤速率分析表明干扰circACC1可显著抑制肿瘤生长速度,过表达circACC1促进肿瘤生长。21对结肠癌与癌旁组织标本分析表明circACC1在其中的16对中表现为癌组织中显著高表达。circACC1的表达与磷酸化c-Jun和AMPK磷酸化及亚基丰度均正相关。
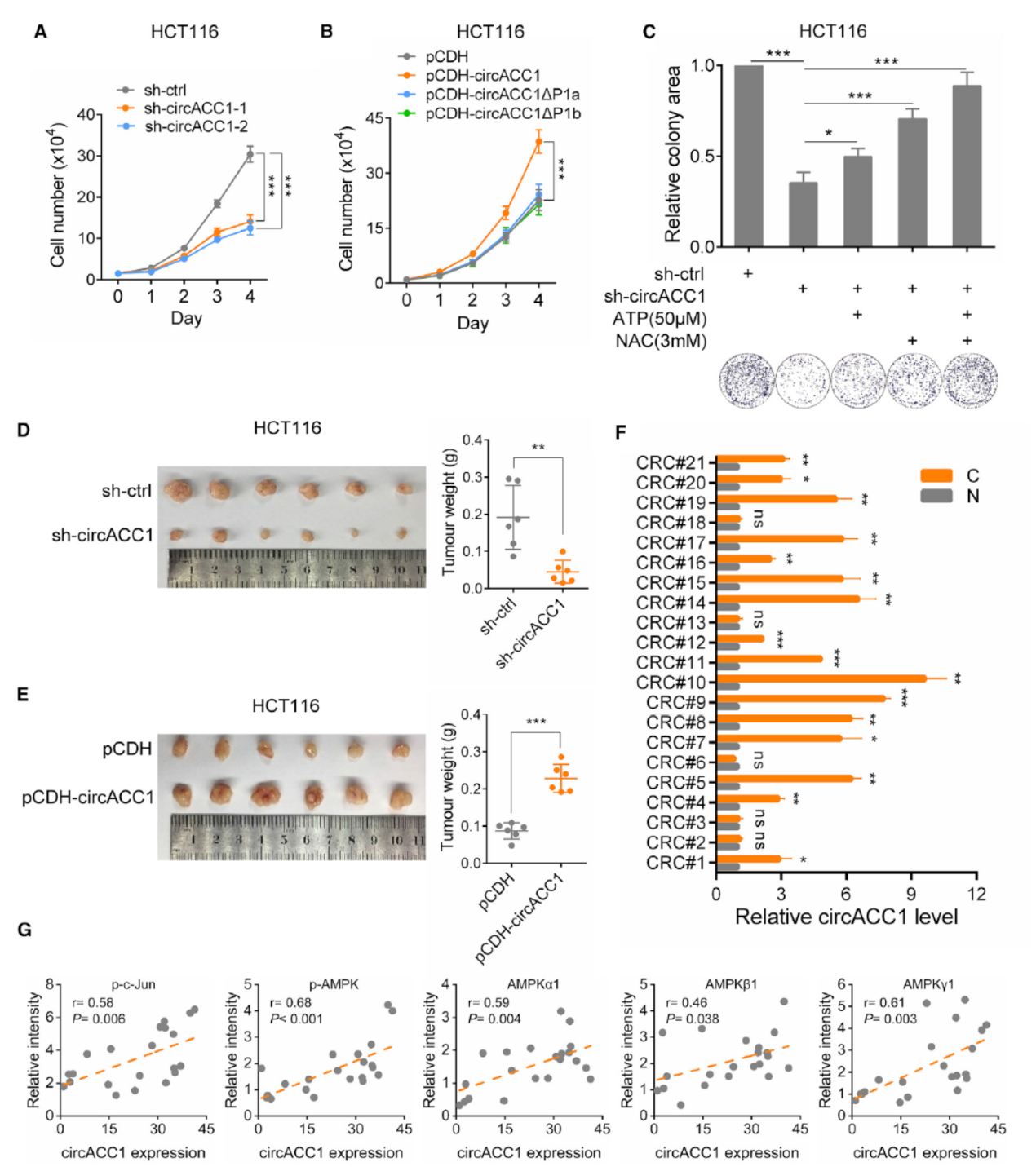
图7 circACC1的肿瘤学功能分析 ([1])
总结
本文先从筛选脂代谢相关基因来源的circRNA是否与脂代谢相关入手,找到了circACC1分子,然后进一步确认了circACC1与脂代谢的相关性,进一步分析了ACC1,AMPK等代谢酶和调控基因的表达和磷酸化状态和表达水平,发现了干扰circACC1能够降低ACC1,FPKFB3的磷酸化水平,同时也降低AMPK磷酸化水平及亚基的丰度。这些发现暗示了circACC1可能与AMPK的功能有关系,相互作用分析确认了circACC1与AMPK的β和γ亚基可直接相互作用,突变分析找出了它们相互作用的区段。基于蛋白稳定性的分析发现了circACC1与AMPK的相互作用能够促进AMPK的稳定性,也同时参与维持AMPK基础活性。作者还发现了血清饥饿可通过c-Jun激活circACC1的表达。最后肿瘤学功能分析表明circACC1具有促进肿瘤生长的作用,病人标本中也存在较高比例的circACC1高表达情况。
在品读完整篇文献后相信大家都会被这篇文章中故事的逻辑性和工作体量所折服,也难怪“人家的工作”可以发表在20分的杂志上了。赞叹之余,我们能够从这篇文章中学习到一些有用的思路和知识,这个当然是见仁见智的,就借此机会分享一下我的一些收获吧:
(1)环环相扣的逻辑是本文的一大亮点。虽然一开始找出circACC1分子的切入点不是很“高大上”,但从验证circACC1是环状RNA,circACC1与脂代谢的相关性开始,每一步的实验设计和得出的结论都有非常扎实的实验证据,每一个环节到下一步的过渡都非常自然合理,都是基于相关研究背景逐一设计实验筛选和锁定对应的机制和分子,没有显得突兀的地方。
(2)充分考虑了干扰circACC1对来源基因ACC1的可能影响并进行了实验验证和排除。一般的干扰试验都是做做QPCR证明没有影响对应来源基因的mRNA造成显著的变化就结束了,本文的工作中不仅验证了对mRNA丰度的影响,还验证了对其蛋白的影响情况,也说明了作者在进行相关探索分析的过程中实验设计的严谨性,非常值得学习。
(3)讨论circACC1与AMPK亚基之间相互作用的思路和设计非常严谨。一般我们发现了某个circRNA与一个蛋白或复合物有相互作用,往往只做到RNA Pull-down,RIP等常规的相互验证试验,本文的作者在Pull-down实验中发现了可以捕获AMPK的三种亚基,作者还基于RIP,双重IP,EMSA实验分析了circACC1与AMPK亚基之间的相互作用关系,也做了对应的突变体分析。探索circACC1与AMPK功能关系的部分就更精彩了,先发现了AMPK稳定性的关系,哺乳动物双杂交实验充分分析了circACC1与AMPK亚基之间相互作用的关系,体外构建AMPK酶活性实验也发现和证明了circACC1与AMPK活性的关系。
(4)血清饥饿可通过c-Jun诱导circACC1表达,但没有找到介导circACC1生成的因子,算是美中不足吧。从本文的数据来看,血清饥饿后显著促进了ACC1的转录,但似乎不会导致mRNA的升高,换言之,这些转录的RNA前体主要形成了circACC1,这个现象是非常有趣的,这也充分说明了circRNA的生成是存在特异性的调控机制的。但遗憾的是本文并未对该问题深入探究。
总而言之,本文的工作非常扎实,逻辑严谨,是非常高质量的circRNA研究工作,值得大家学习。
参考文献
1. Li, Q., et al., CircACC1 Regulates Assembly and Activation of AMPK Complex under Metabolic Stress. Cell Metab, 2019.
2. Memczak, S., et al., Circular RNAs are a large class of animal RNAs with regulatory potency. Nature, 2013. 495(7441): p. 333-8.
.png)
