8月27日,PNAS杂志在线发表了一项有趣的研究:发现环状DNA病毒基因组能够表达环状RNA的产物!文章的通讯作者是匹兹堡大学的Patrick S. Moore和Yuan Chang[1]。

本文报道的故事概括而言,就是报道发现了两种环状DNA基因组的γ-疱疹病毒:EB病毒(EBV)和卡波西肉瘤病毒(KSHV)可以转录产生病毒基因来源的circRNA分子,EBV病毒能够在BART基因区产生仅有外显子组成的circRNA或同时携带外显子和内含子的circRNA分子,前者在胞质和核中均有定位,后者主要定位于核内。KSHV病毒在IRF4和PAN基因区均发现有对应的circRNA生成,它们在胞质和核内均有分布,其中PAN基因来源的circRNA为簇,且正负两条链都有相应的产物。作者还分析了这些circRNA翻译的潜能,从实验数据来看被核糖体捕获的circRNA偏少,这些circRNA更倾向于分布在游离的RNA,但也不能排除这些circRNA可翻译的可能性。
本文为我们呈现了一个非常有趣的现象:环状DNA基因组的病毒在宿主细胞中能够表达出环状RNA的产物,不得不感叹自然进化的玄妙!带着对自然进化的敬畏之心,下面就让我们一起拜读一下这篇文章:
作者为什么要探索环状DNA基因组病毒表达的circRNA?
按照文章的描述,作者一开始是为了寻找EBV阴性的移植后淋巴组织增生性疾病(PTLD)患者是否有未知的新型致瘤性病毒(human tumor viruses),此前曾有报道通过Poly-A测序的方法寻找到Merkel细胞多瘤病毒,但这种测序方法可能会漏掉环状RNA基因组的信息,因此作者希望能利用环状RNA的测序方法找到全新的致瘤性病毒。在比较EBV阳性和阴性的PTLD标本中发现了来自EBV基因组基因产生的circRNA分子。
EBV基因组来源circRNA的鉴定
通过RNase R建库测序,作者发现了在EBV阳性的标本中存在来自EBV基因组中BART基因的两种circRNA分子,一个是由外显子IV与外显子II反向拼接形成的(作者命名为BSJ1,circBART_1),另一种是外显子IV与外显子IIIa反向拼接形成的(作者命名为BSJ2,circBART_2)。除了BART基因,EBV病毒的LMP2和BHLF1基因也有少量circRNA生成。
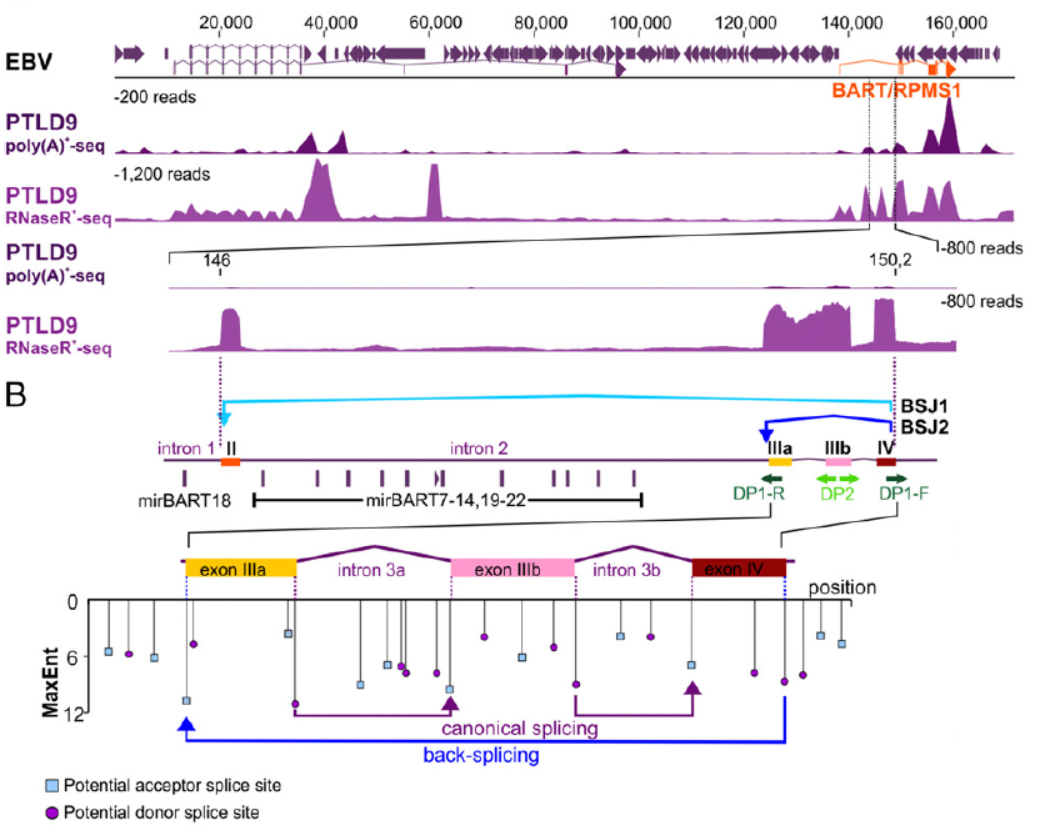
图1 EBV基因组BART基因来源circRNA分子 (来自[1])
通过设计反向扩增引物和测序,鉴定了上述circRNA分子的序列,并分析了它们在不同EBV潜伏状态的细胞株中的表达情况。通过将PCR产物克隆后测序的方法,作者鉴定了多种来自BART基因的circRNA分子的全序列。编号为circBART_1.2(长度501 nt)的仅包含外显子II,IIIa,IIIb和IV。编号为circBART_1.1(长度711 nt)的不仅包含了上述四个外显子,还包含内含子IIIa。编号为circBART_2.2(长度399 nt)的仅包含外显子IIIa,IIIb和IV。编号为circBART_2.1(长度609 nt)的不仅包含了上述三个外显子,还包含内含子IIIa。
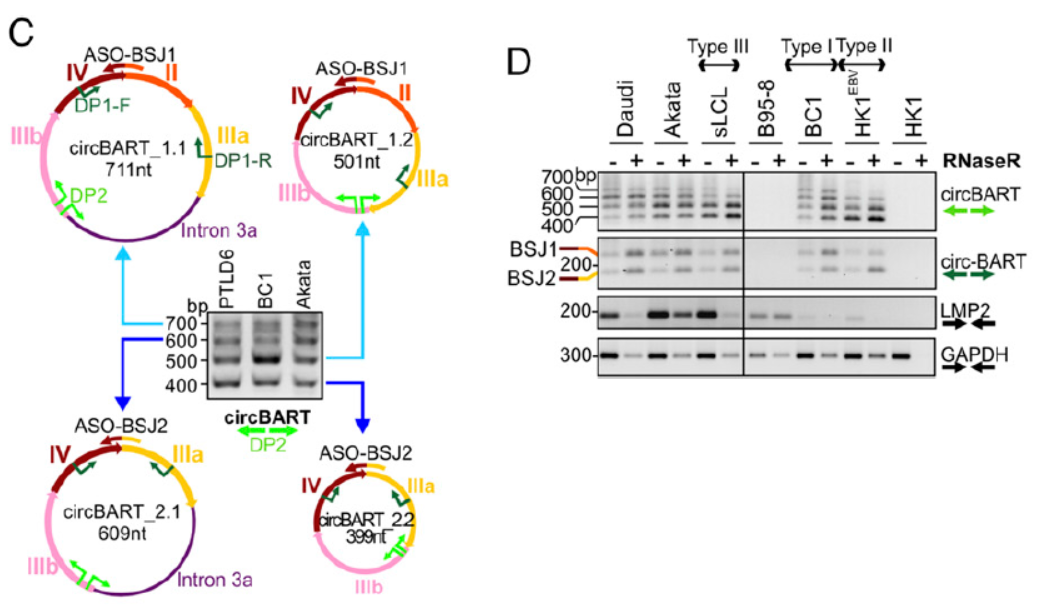
图2 circBART测序鉴定(来自[1],排列略有改动)
进一步,作者测定了EBV阳性和阴性细胞中,两种circBART分子的含量和表达情况,结果表明在EBV阳性的细胞中均可检测到相应circRNA分子的表达。反义寡核苷酸(ASO)结合RNaseH消化实验(该RNase可以基于DNA互补模板降解对应的RNA分子),进一步证明了circBART分子的存在。
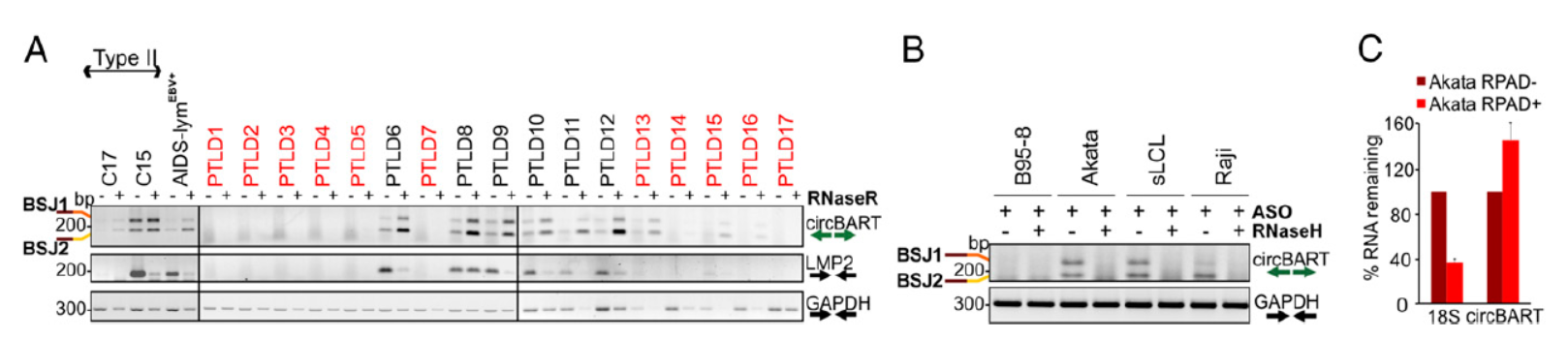
图3 circBART表达分析(来自[1])
KSHV来源circRNA 鉴定
与EBV中circRNA的鉴定思路相似,作者进一步在KSHV阳性的标本中检测是否会有病毒基因组编码基因来源的circRNA分子。在RNase R消化后检测到了在PAN和IRF4基因区存在circRNA产物。PAN基因区的circRNA比较特别,正负两条链的转录产物都有circRNA分子产生,反向拼接的位点也存在高度的多态性,因此该基因区的circRNA产物是成簇出现的(大于100种不同的分子形式)。
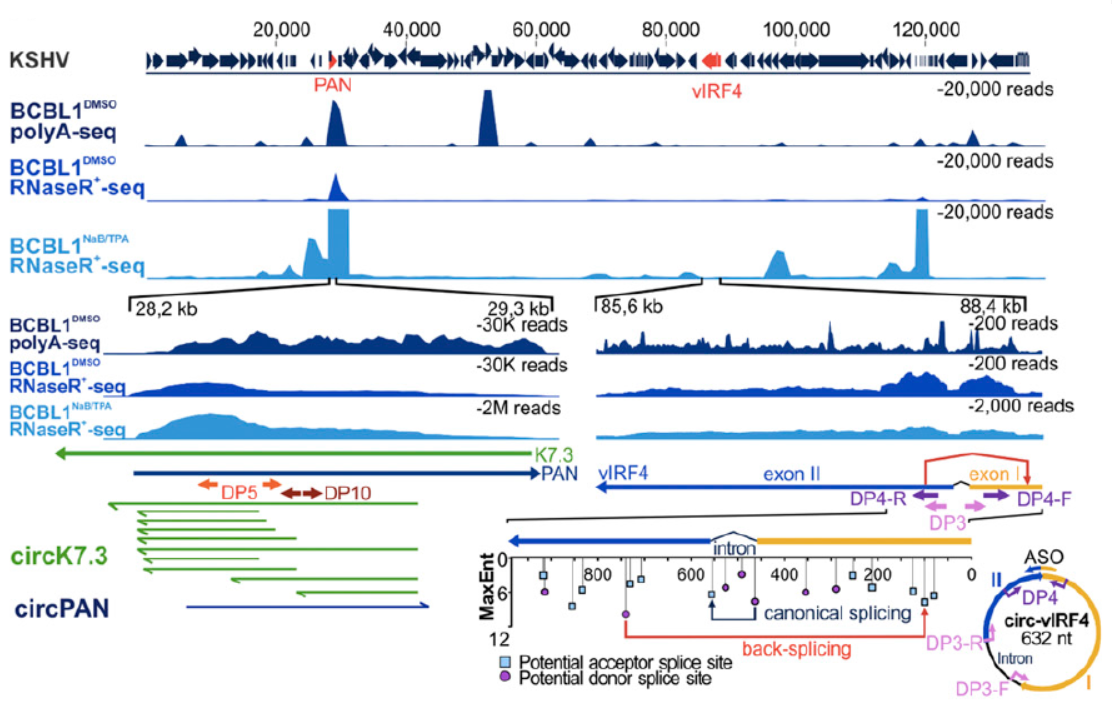
图4 KSHV来源circRNA鉴定 (来自[1])
测序鉴定结果表明,IRF4基因来源的circ IRF4由外显子I,II和内含子I共同构成。PAN基因来源circRNA为成簇出现,正负两条链都可以编码产生circRNA分子。
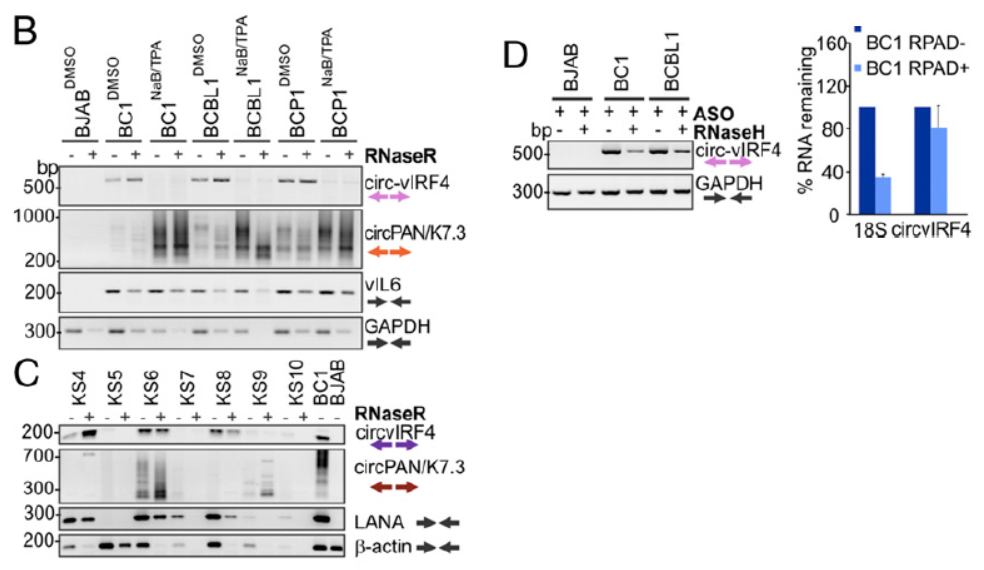
图5 KSHV来源circRNA测序分析(来自[1])
病毒来源circRNA 亚细胞分布及可翻译潜能分析
经过各种鉴定实验已经可以证明EBV和KSHV病毒基因来源的circRNA分子的存在和表达,那么这些分子的亚细胞定位如何呢?通过分离两种病毒共感染的细胞BC-1的胞质和核组分,PCR分析其中不同circRNA分子的含量。结果表明来自EBV基因BART的circRNA定位特点是不带内含子的circRNA(circBART_1.2和circBART_2.2)在胞质和核中均有分布,而包含内含子的circRNA(circBART_1.1和circBART_2.1)主要分布在核中。来自KSHV病毒的IRF4基因的circRNA亚细胞分布没有明显的趋势。
这些病毒基因组来源的circRNA分子的功能是个谜,有没有可能会编码一些全新的蛋白呢?作者通过简单超速离心分离核糖体组分的技术进行分析,按照沉降速率将分离产物分成12层,编号越小的越靠近上层,说明分子量越小。通过测定254nm光吸收值确定核糖体组分位于哪一层的沉降组分。针对12个分层的样品进行RT-PCR分析,看对应的circRNA分子主要分布情况。结果表明几种病毒基因组来源circRNA分子更倾向于分布在游离RNA的组分中,对照的GAPDH和LMP2在核糖体组分中有较高的丰度。由于RNA翻译是动态的可变过程,有核糖体结合的RNA分子被翻译的可能性会更高,但没有结合的也不能说明一定不被翻译。作者在本文的实验中没有捕捉到明确的被翻译信号,出于科研的谨慎,作者给出的结论是不能排除这些病毒基因组来源的circRNA分子可以被翻译。
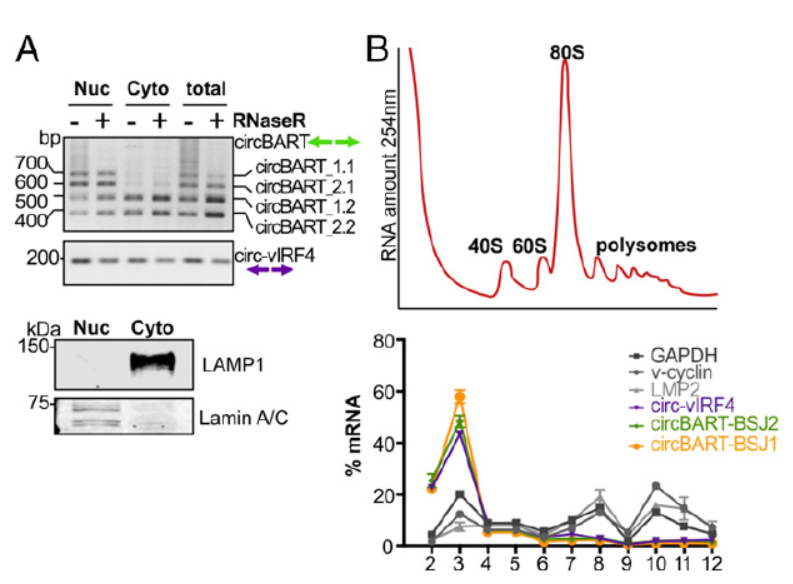
图6 病毒来源circRNA 亚细胞分布及可翻译潜能分析 (来自[1])
本文为我们呈现了一个非常有趣的故事,不得不感叹大自然的神奇,这也是科研最大的魅力所在。本文报道的发现对于病毒学和广大circRNA研究同行都是比较新颖的现象,从circRNA的研究角度来看,本文报道的新现象还是有很多值得进一步探究的问题,包括:
(1) 这些病毒基因组来源的circRNA是通过什么机制形成的?反向互补序列还是RNA结合蛋白介导?内含子被保留的原因和机制是什么?
(2) 这些circRNA的功能和作用机制是怎样的?是否与来源的基因(host gene)的功能更有一定关系?与病毒的潜伏状态或疾病的进程有什么关系?这些病毒来源的circRNA对肿瘤的作用是怎样的?在未感染相关病毒的细胞中过表达这些circRNA分子会有什么效应?……
(3)病毒基因来源的circRNA是否具有普遍性?其他类型病毒是否也有类似的产生circRNA的现象?其它物种中是否也存在类似的现象?这些circRNA是否是进化选择的结果?……
参考文献:
1. Tuna Toptan, B.A., Michael A. Nalesnik, Steven H. Swerdlow, Sarangarajan Ranganathan, Nara Lee, Kathy H. Shair, Patrick S. Moore, and Yuan Chang, Circular DNA tumor viruses make circular RNAs. Proceedings of the National Academy of Sciences 2018.
.png)
