2020年5月18日,苏州大学心血管研究所的李杨欣教授在Theranostics(IF=8.063)杂志上发表了一篇题为“Stem cell-derived exosomes prevent pyroptosis and repair ischemic muscle injury through a novel exosome/circHIPK3/ FOXO3a pathway”的文章,阐述人脐带间充质干细胞衍生的外泌体(UMSC-Exo)释放的circHIPK3可以通过miR-421/FOXO3a途径来防止细胞焦亡并修复缺血性肌肉损伤([1])。

骨骼肌缺血性损伤作为一个严重的临床问题,目前尚无有效的治疗方法。本篇文章的目的是确定人脐带间充质干细胞衍生的外泌体(UMSC-Exo)是否可以通过释放环状RNA来修复缺血性损伤。作者使用缺失和获得功能的方法,证明UMSC-Exo释放的circHIPK3通过海绵吸附miR-421,来减弱其对FOXO3a的抑制作用,进而防止细胞焦亡并修复缺血性肌肉损伤。
1 circHIPK3在缺血性肌肉组织中表达下调
环状RNA作为一类新的非编码RNA,它与急性心肌梗死和急性下肢缺血性损伤密切相关,但其作用机制尚不清楚。为进一步探索急性下肢缺血性损伤的发病机制,作者使用RNA测序技术来分析缺血性肌肉组织和正常肌肉组织中circRNA的表达差异。后肢缺血模型是通过外科手术结扎C57BL / 6小鼠的左股动脉构建的。结果发现,circHIPK3在正常肌肉组织中高表达,在缺血性肌肉组织中表达下降。circHIPK3来源于HIPK3基因的外显子2,它在人与小鼠之间高度保守。为了验证测序结果,作者选取4个促进细胞增殖并抑制细胞凋亡的circRNA和circHIPK3在正常肌肉组织中的表达水平进行比较。结果表明,比较于上述促增殖的4个circRNA,circHIPK3在肌肉组织中的表达更高,这与测序结果相符。得出结论,circHIPK3可能在急性下肢缺血性损伤的发病中起到重要作用。
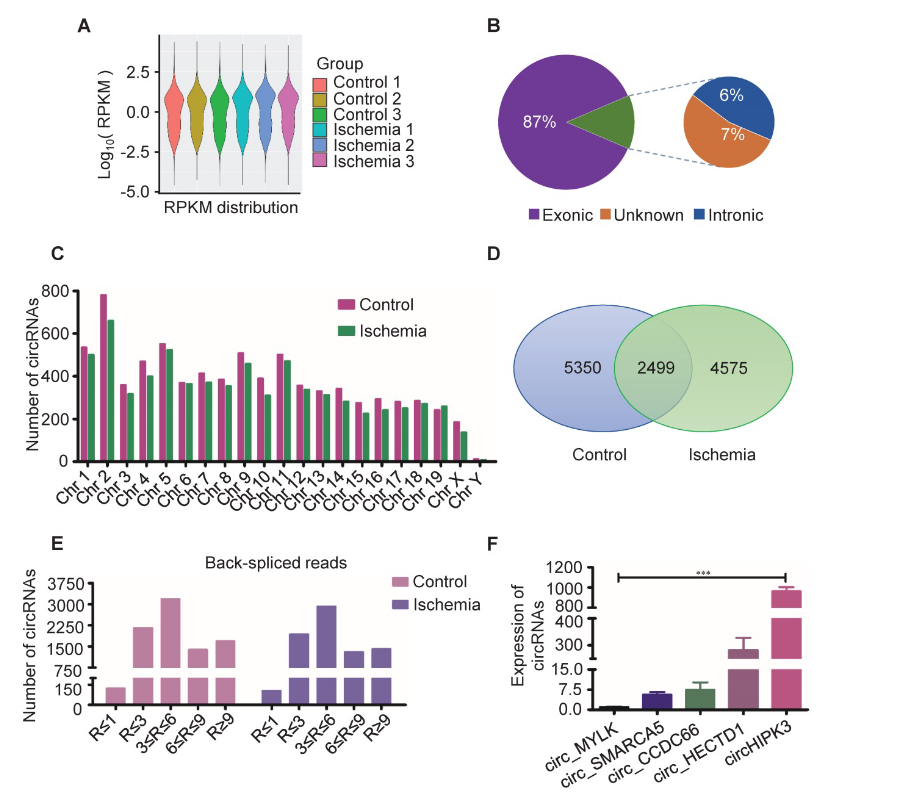
图1 circRNA在缺血和正常肌肉组织中的表达谱
2 外泌体通过释放circHIPK3来修复缺血性肌肉损伤
外泌体可以转运功能性的miRNA和circRNA。已有报道证明,miRNA在缺血性组织修复中发挥着重要作用。但是,circRNA在肌肉修复中所扮演的角色还尚不清楚。最近一项研究表明,circHIPK3可以促进血管生成和内皮细胞增殖。因此,作者想要证明circRNA是否也参与修复缺血性肌肉损伤。RT-PCR表明,在缺血肌肉组织中circHIPK3的表达明显降低,而circHIPK3却在UMSC-Exo中高表达。为确定外泌体是否可以通过递送circHIPK3来修复缺血性肌肉损伤,使用siRNA来敲低外泌体中的circHIPK3,并对缺血性后肢小鼠进行以下处理:(1) 载体(PBS); (2) Exo ; (3)Exo-si-circHIPK3。在处理后24小时至28天,使用激光多普勒成像对灌注进行定量,结果表明,外泌体处理后第7、14、21和28天的血液灌注显着增强。此外,外泌体治疗还改善了肌肉力量和运行距离。然而Exo-si-circHIPK3中,并未观察到外泌体发挥的这些修复作用。这些结果表明,UMSC-Exo通过释放circHIPK3来促进缺血性肌肉修复。
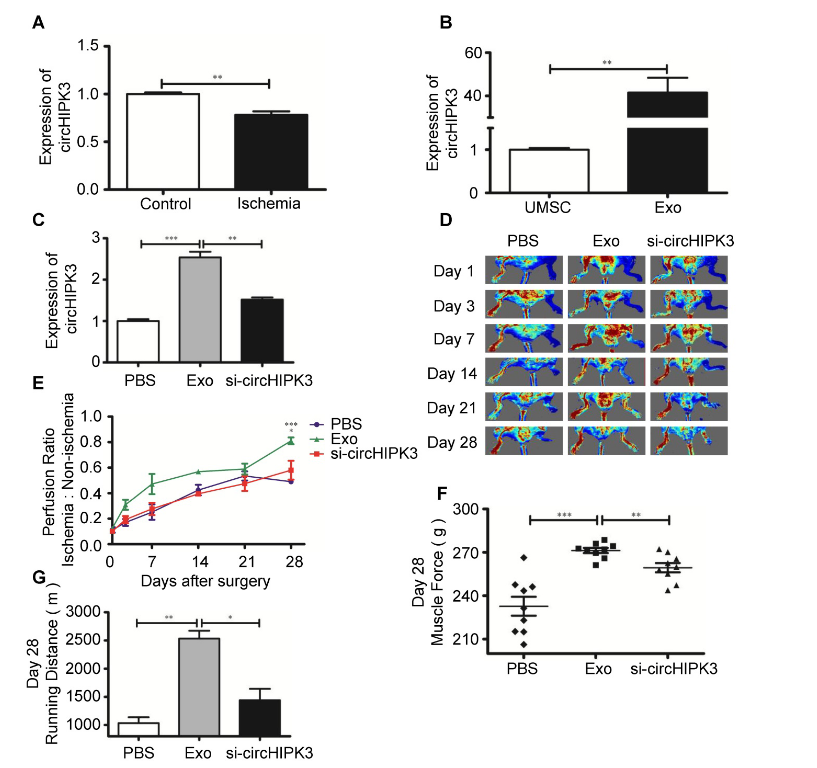
图2 UMSC-Exo通过释放circHIPK3来修复缺血性肌肉损伤
3 缺血性肌肉损伤中的炎症反应
为挖掘急性骨骼肌缺血性损伤的关键分子和信号通路,作者使用RNA测序技术分析缺血腓肠肌和正常腓肠肌中mRNA的表达谱。随后,对差异表达的mRNA进行GO和pathway分析,来预测缺血性肌肉损伤的相关通路。在生物过程中,作者发现GO:0006954(炎症反应途径)和GO:0002376(免疫系统途径)明显上调。KEGG通路分析显示,PATH:04621(NOD样受体信号通路)和PATH:04620(Toll样受体信号通路)被显着激活。这些发现使作者专注于缺血性肌肉损伤中的炎症反应途径及其相关分子。
为了寻找RNA与蛋白之间的相关性,选取RNA测序的样本进行蛋白质测序。火山图和聚类分析显示,在缺血组与对照组中共存在80个差异表达的蛋白。GO分析显示,差异表达的蛋白在GO:0070252(肌动蛋白介导的细胞收缩)、GO:0030239(肌原纤维组装)和GO:0043403(骨骼肌组织再生)这3个特定的生物学过程中富集。文氏图显示,在转录和蛋白质组学分析中,有28个基因和相关蛋白在缺血组和对照组中有相似的变化趋势,这一结果被热图分析进一步证实。其中,NLRP3和IL-1β在缺血组中的表达显著上调。重要的是,使用归一化处理Spearman相关系数来计算NLRP3和IL-1β的mRNA-蛋白相关性,结果表明,与对照组相比,缺血组NLRP3和IL-1β的mRNA水平与它们的蛋白水平呈正相关。以上得出结论,缺血性损伤会伴随炎症反应,circHIPK3是否通过调节炎症反应来修复缺血损伤,仍有待证明。
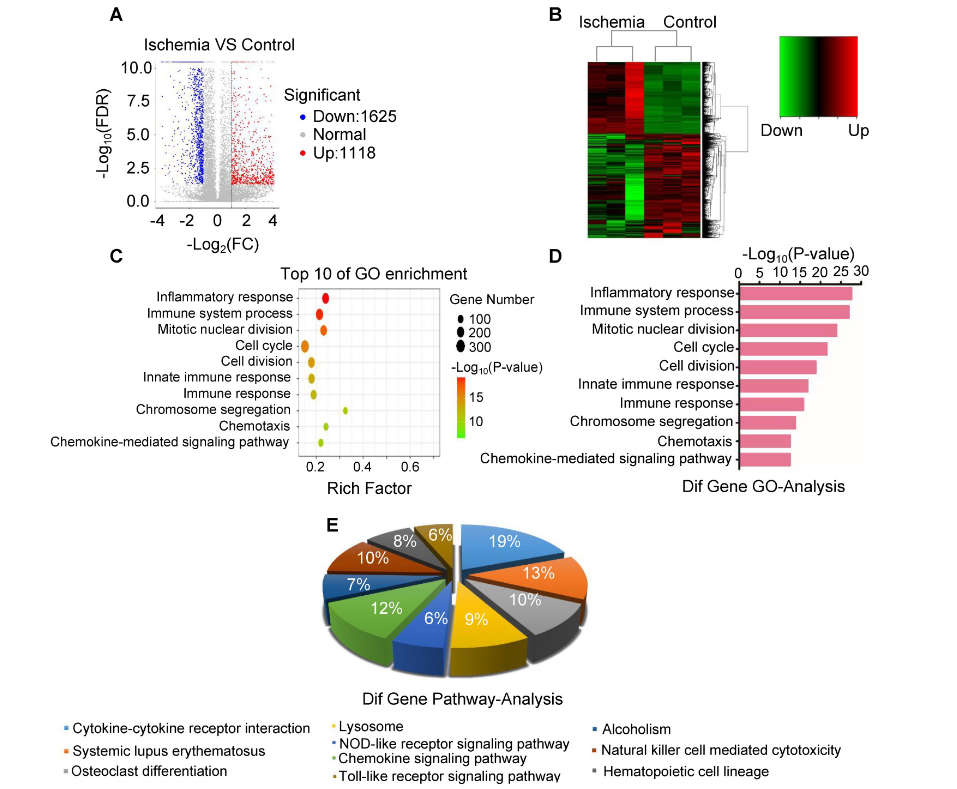
图3 mRNA表达及其相关通路分析
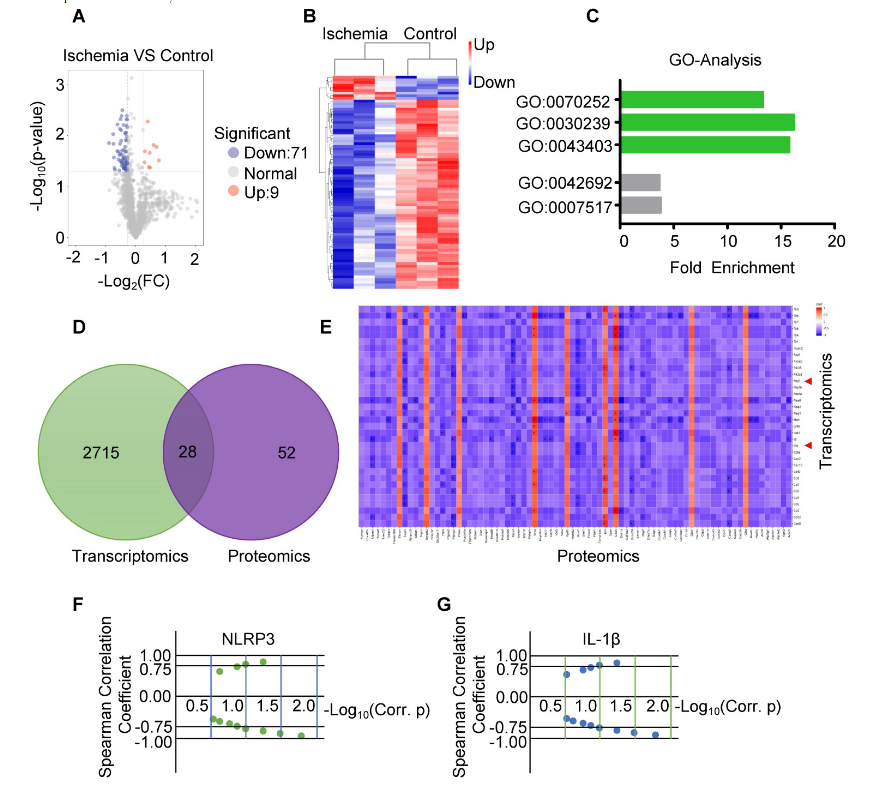
图4 通过蛋白质测序分析蛋白质表达
4 在体内,外泌体通过释放circHIPK3抑制骨骼肌细胞焦亡
细胞焦亡又称细胞炎性坏死,是由炎症性攻击导致的细胞程序性死亡。与凋亡不同,细胞焦亡是caspase-1依赖性的过程,导致细胞快速裂解并释放炎性成分。缺血性损伤引起的炎性刺激(例如细胞碎片)可以激活炎性体NLRP3 。激活后,NLRP3通过释放包括IL-18和IL-1β在内的炎性细胞因子来触发细胞焦亡。但是,尚未探索这种新的信号通路在缺血性损伤中的作用。
最近有研究表明,急性心肌梗死会导致促炎细胞因子的释放,例如IL-1β。circVMA21可以通过miR-200c-XIAP途径减轻炎症细胞因子诱导的NP细胞凋亡。为确定circHIPK3是否也具有调节炎症细胞因子表达的作用,作者分别使用RT-PCR和ELISA检测IL-1β和IL-18的mRNA和蛋白水平。结果显示,相比于对照组,它们在缺血组的表达更高,这表明缺血性肌肉损伤会诱导细胞焦亡。缺血组中提高的细胞因子水平可以被外泌体治疗所下调,而敲低circHIPK3会逆转这种作用,表明外泌体下调细胞因子表达的过程依赖于circHIPK3。此外,RT-PCR和Western blot实验表明,缺血性损伤会诱导NLRP3和caspase-1的表达,包括mRNA和蛋白水平,而外泌体治疗会导致NLRP3和caspase-1的表达显着下调。总而言之,这些数据表明外泌体可以通过转运circHIPK3来抑制骨骼肌细胞焦亡。
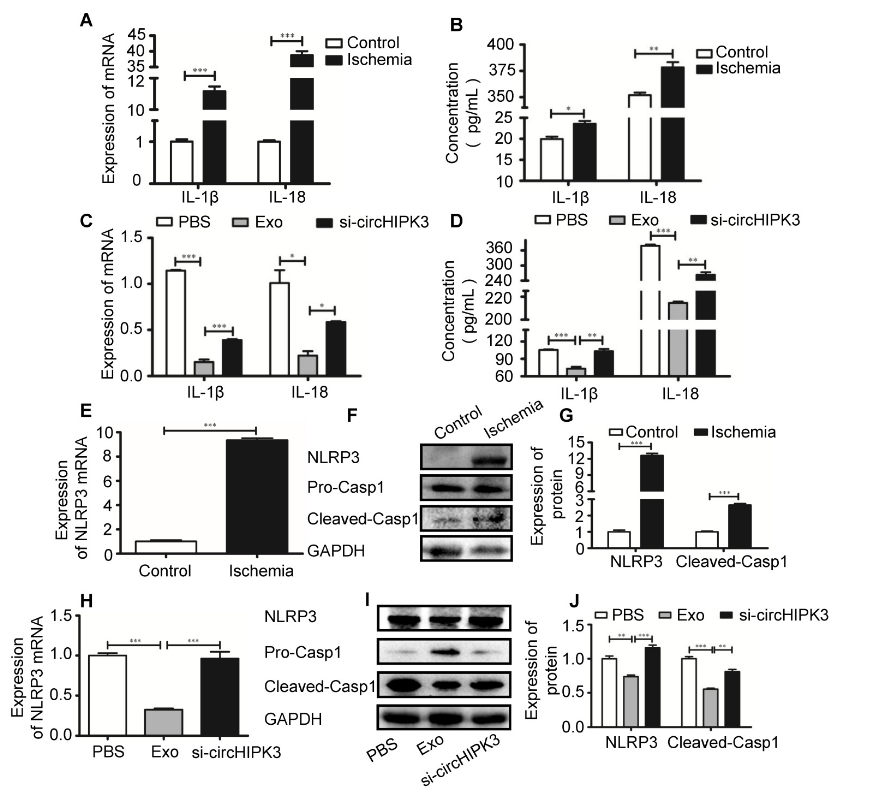
图5 外泌体通过转运circHIPK3来抑制骨骼肌细胞焦亡
5 在体外,外泌体通过释放circHIPK3促进C2C12细胞增殖并抑制细胞焦亡
为了阐明circHIPK3介导组织修复的分子机制,作者将小鼠成肌细胞系C2C12细胞与PKH26标记的外泌体共孵育,使用荧光显微镜验证C2C12细胞可以成功地将外泌体摄取。接下来使用EdU实验来检测细胞的增殖能力,结果表明外泌体处理会促进细胞增殖。为确定外泌体对细胞焦亡的影响,作者使用LPS预处理C2C12细胞,并通过添加ATP来触发炎性体形成。炎性体的形成是通过PCR和western blot检测NLRP3和caspase-1的表达来验证。外泌体处理可以导致NLRP3和caspase-1表达的下调,而敲低circHIPK3会逆转这种作用。这些结果表明,在体外,外泌体可以通过递送circHIPK3来促进细胞增殖并抑制细胞焦亡。
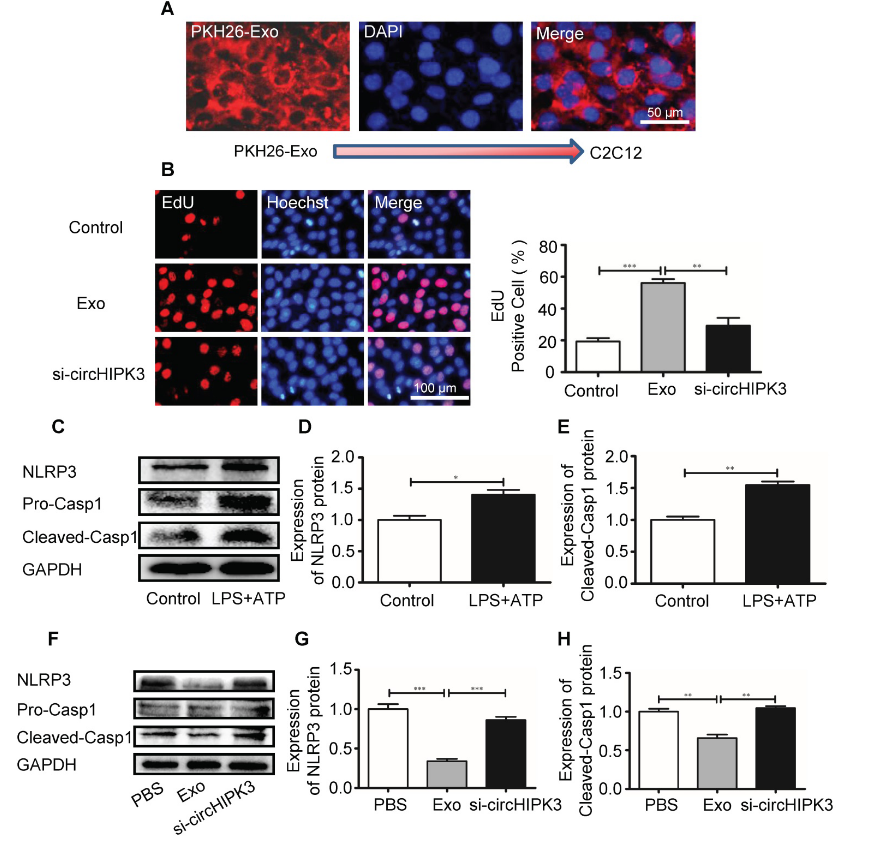
图6 circHIPK3在体外抑制C2C12细胞焦亡
6 circHIPK3作为miR-421的海绵分子
环状RNA可以通过海绵吸附miRNA来减少可自由利用的miRNA分子,从而调节基因表达。生物信息学分析表明,miR-421含有circHIPK3的结合位点,荧光素酶报告基因实验证实了circHIPK3-miR-421的相互作用。此外,在C2C12细胞中敲低circHIPK3会增加miR-421的表达。EdU实验表明,外泌体处理会促进C2C12细胞增殖,而敲低circHIPK3会逆转这种作用。在敲低circHIPK3的基础上,抑制miR-421表达会促进细胞增殖。Western blot实验显示,在miR-421抑制剂处理的C2C12细胞中,NLRP3和caspase-1的表达被下调。这些实验证实,外泌体释放的circHIPK3是通过海绵吸附miR-421,来发挥促细胞增殖和抑制细胞焦亡的作用。
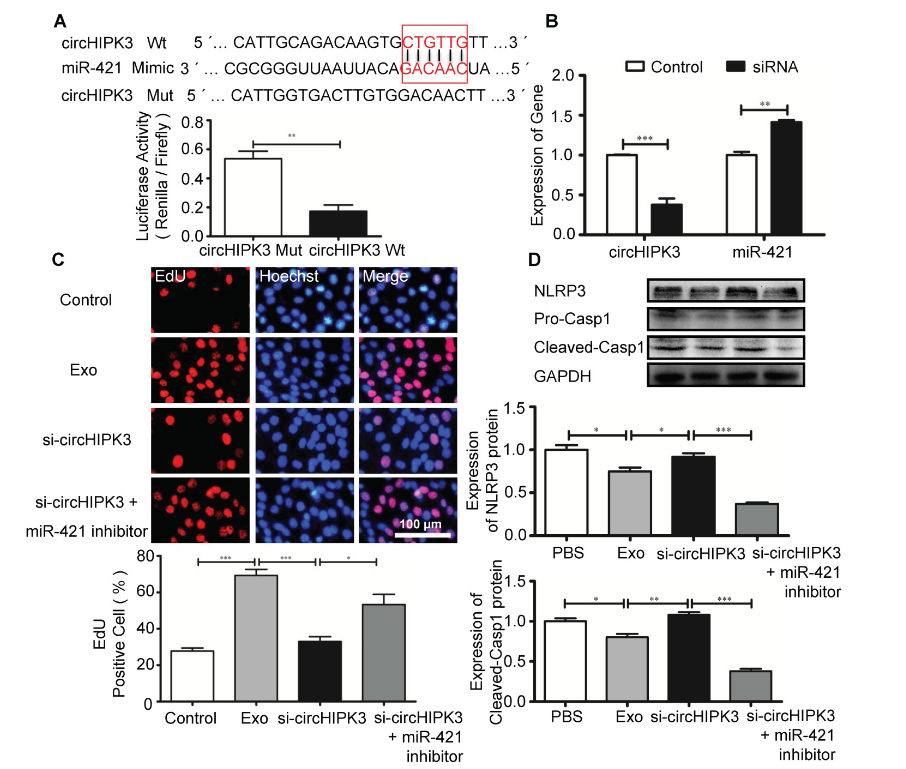
图7 circHIPK3调节miR-421的表达
7 FOXO3a作为miR-421的直接靶点
FOXO3a是调节细胞焦亡的转录因子。在缺血性后肢组织中,过表达miR-421会下调FOXO3a的mRNA水平。使用生物信息学预测miR-421及其靶基因之间的潜在结合位点。结果显示,FOXO3a的3′-UTR与miR-421有良好的相关性,通过萤光素酶报告基因实验证实miR-421可以直接沉默FOXO3a的表达。作者使用miR-421模拟物/抑制剂在C2C12细胞中过表达/敲低miR-421。RT-PCR和Western blot实验表明,过表达/敲低miR-421会导致FOXO3a表达水平的下调/上调。重要的是,外泌体可以促进FOXO3a的表达,而敲低circHIPK3会逆转这一作用。此外,在敲低circHIPK3的基础上,抑制miR-421水平会促进FOXO3a的表达,这进一步证明了FOXO3a是miR-421的直接靶标。 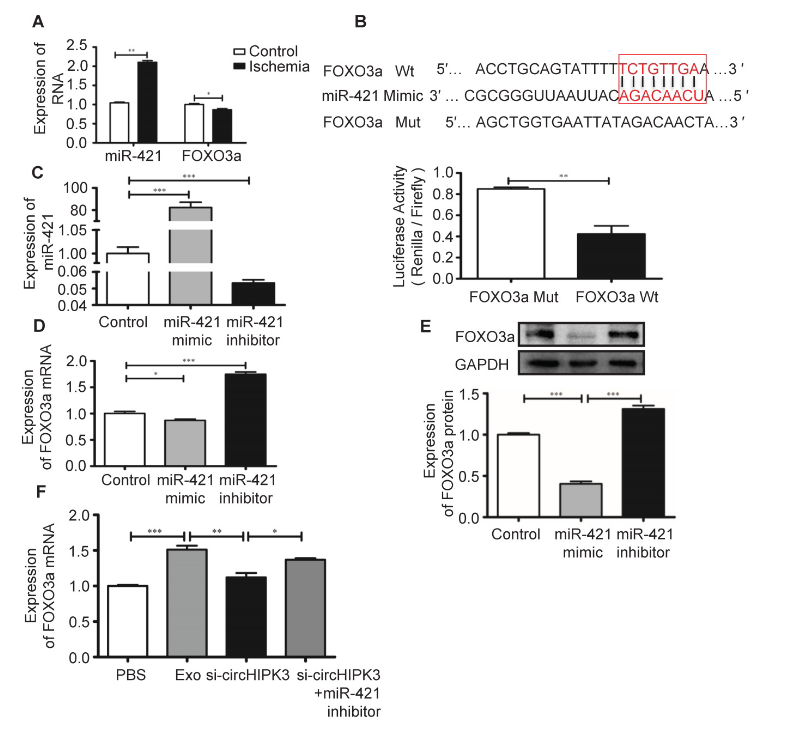
图8 FOXO3a作为miR-421的下游靶标
参考文献:
[1] Yan B, Zhang Y, Liang C, et al. Stem cell-derived exosomes prevent pyroptosis and repair ischemic muscle injury through a novel exosome/circHIPK3/ FOXO3a pathway. Theranostics. 2020;10(15):6728-6742. Published 2020 May 18. doi:10.7150/thno.42259
.png)
