2020年7月27日,同济大学医学院的周永新 、孙祖俊和李冬为共通讯作者在Molecular Cancer(IF=15.302)杂志上发表了一篇题为“Exosomal circPACRGL promotes progression of colorectal cancer via the miR-142-3p/miR-506-3p- TGF-β1 axis”的文章,阐述一种新的大肠癌来源的外泌体circRNA,circPACRGL,作为一个促癌分子,通过miR-142-3p / miR-506-3p-TGF-β1轴来促进大肠癌细胞的增殖、迁移和侵袭,以及N1-N2中性粒细胞的分化([1])。

大肠癌(CRC)是世界范围内最常见的恶性肿瘤之一,具有很高的转移和复发风险。考虑到传统疗法的缺点,如毒性和耐受性,因此,迫切需要寻找敏感的大肠癌诊断标志物进行早期发现,并探索大肠癌治疗的新靶点。近年来,外泌体在癌症中的作用受到越来越多的关注,外泌体主要作为细胞间通讯的重要调节因子,但是癌症来源的外泌体circRNA在大肠癌中的功能和调控机制还尚未挖掘。本篇文章中,作者首次揭示了肿瘤来源的外泌体circPACRGL在大肠癌增殖和转移中的致癌作用,为深入了解circRNA在大肠癌进程中的作用提供了机制方面的见解,并为大肠癌的治疗提供了一个有价值的靶点,即circPACRGL。
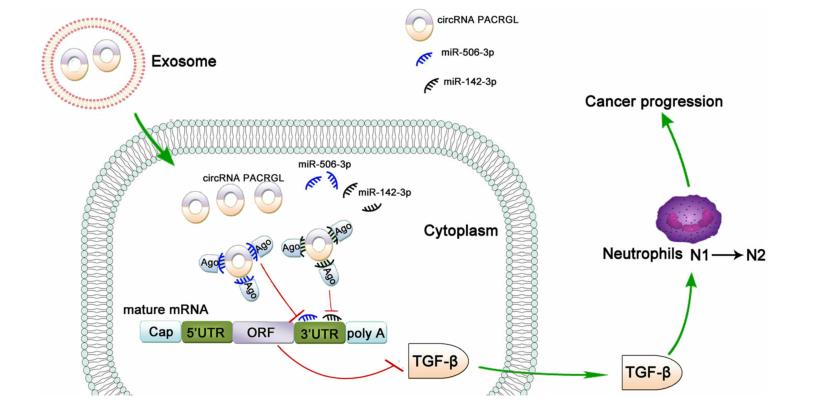
图1 癌症进展中circPACRGL通过miR-142-3p /miR-506-3p-TGF-β1轴调节N1-N2中性粒细胞的分化
1 、大肠癌衍生的外泌体促进CRC细胞的增殖、迁移和侵袭
以往的研究表明,肿瘤来源的外泌体与其增殖和迁移密切相关。为了探索外泌体在CRC中的作用机制,作者从两种CRC细胞系HCT116和SW480的上清液中分离出癌细胞衍生的外泌体。透射电子显微镜和纳米粒子跟踪分析(NTA)检测到这些外泌体为圆形颗粒,大小约为80-100 nm,具有双层膜,与常见的外泌体大小一致。CRC衍生的外泌体还通过western blot进行了表征,包括外泌体特异性标志物(CD9、CD54和Annexin)的表达上调,以及GM130表达的显着降低。接下来,作者想知道CRC衍生的外泌体是否影响CRC细胞的增殖、迁移和侵袭。 CCK8、划痕实验和transwell分析显示,与对照组相比,过表达外泌体显着增强了CRC细胞的增殖、迁移和侵袭。流式细胞仪分析显示,在过表达外泌体的CRC细胞中,凋亡细胞百分比显着低于对照细胞。此外,western blot结果显示,CRC衍生的外泌体增加了BCL-2、N-钙黏着蛋白、波形蛋白和MMP9的蛋白水平,并降低了E-钙黏着蛋白、Cleaved-caspase3和Cleaved-caspase9的蛋白水平。作者还测试了CRC衍生的外泌体在体内转移瘤模型中的作用。通过尾静脉向裸鼠注射对照和外泌体处理过的HCT116-萤光素酶细胞(n = 6),每周通过体内成像系统监测肿瘤的转移情况。作者发现外泌体治疗显着增加了HCT116细胞的转移。总体而言,以上数据表明,CRC衍生的外泌体可促进CRC增殖、迁移和侵袭。
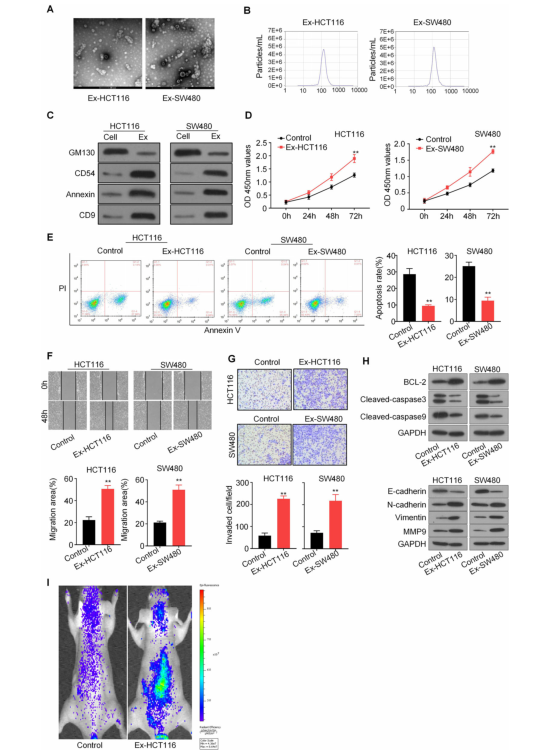
图2 CRC衍生的外泌体促进CRC细胞的增殖、迁移和侵袭
2、circPACRGL在肿瘤来源的外泌体刺激的大肠癌细胞中显著上调
据报道,肿瘤来源的外泌体中富含circRNA。为了找出与CRC相关的circRNA,作者通过RNA测序分析了三对外泌体刺激的HCT116和SW480细胞(Ex-HCT116和Ex-SW480)以及每个未处理的对照细胞的表达谱。通过Venn分析将HCT116和SW480内差异表达的基因取交集。研究发现,circPAGAL(也称为has_circ_0069313)是两个Ex组中上调最显著的基因,并通过RT-qPCR证实。接下来,作者决定重点关注于circPAGRAL。作者发现,与对照相比,在外泌体刺激的CRC细胞中circPAGRAL水平持续且显着增加。但是,该结果与用CRC患者血清来源的外泌体(Serum-EXO)处理的CRC细胞中的结果不一致。circPACRGL是一种通过微阵列分析鉴定的新型CRC衍生的外泌体circRNA,目前还没有被充分研究。作者认为,circPACRGL在血清外泌体中的表达差异是由肿瘤组织特异性和患者情况所引起的。作者进一步从CRC患者的肿瘤组织中分离出外泌体。qRT-PCR结果表明,circPAGRAL的表达在肿瘤外泌体(Tumor-EXO)处理的CRC细胞中明显上调。这些结果表明,在肿瘤来源的外泌体刺激下,CRC细胞中circPACRGL的表达显著上调,且circPACRGL可能来源于肿瘤衍生的外泌体。为了研究circPACRGL是否为CRC进展所必需的,作者采用了缺失功能分析。将circPACRGLsiRNA转染到HCT116和SW480细胞后,RT-qPCR验证敲低效率。在敲低circPACRGL的基础上,使用肿瘤来源的外泌体刺激两种CRC细胞,显示circPACRGL mRNA表达显着增加。这些结果表明,circPACRGL主要来自肿瘤来源的外泌体,而不是肿瘤细胞内的表型变化。
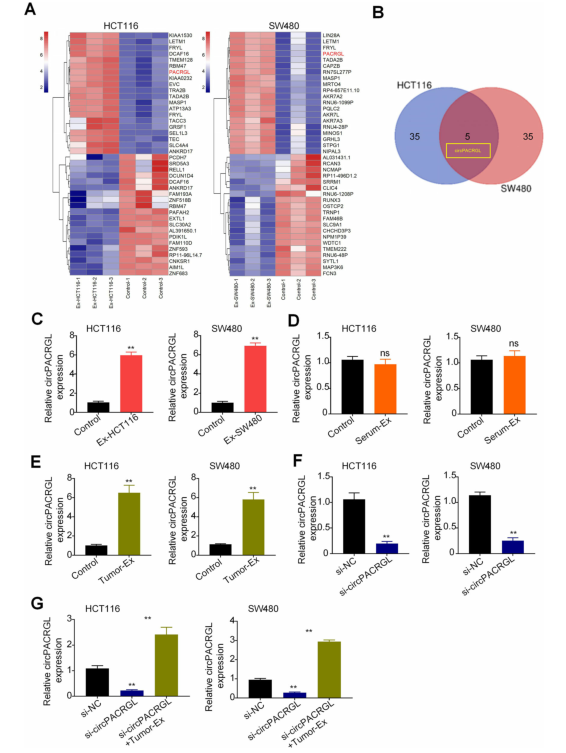
图3 circPACRGL在肿瘤来源的外泌体刺激的大肠癌细胞中显著上调
3、circPACRGL作为miR-142-3p和miR-506-3p的海绵分子
大量证据表明,circRNA可以作为miRNA的海绵分子来参与调控过程,这主要发生在胞质中。荧光原位杂交(FISH)结果显示,circPACRGL转录本信号主要分布在HCT116和SW480细胞的胞浆中,但在胞核中也存在少量的杂交信号。随后,作者使用生物信息学数据库Starbase2.0,来预测可能与circPACRGL相结合miRNA。在这些预测的候选miRNA中,作者发现circPACRGL同时具有miR-142-3p和miR-506-3p的结合位点。双萤光素酶报告基因检测进一步证实miR-142-3p和miR-506-3p以序列依赖性的形式与circPACRGL直接结合。此外,作者发现,与对照组相比,在CRC细胞来源的外泌体刺激的HCT116和SW480细胞中,miR-142-3p和miR-506-3p表达均显着降低。这些结果表明,circPACRGL可以海绵吸附miR-142-3p和miR-506-3p,并抑制二者的表达。
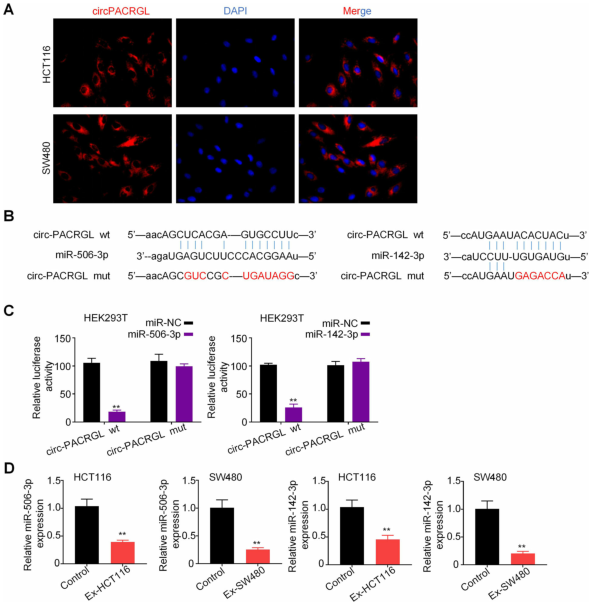
图4 circPACRGL用作miR-142-3p和miR-506-3p的海绵分子
4、TGF-β1是miR-142-3p / miR-506-3p的共同靶标
miRNA是通过结合下游靶标mRNA的3’UTR,来沉默靶基因的表达(包括mRNA和蛋白),进而发挥调控作用。作者使用生物信息学工具StarBase 2.0来预测miR-142-3p和miR-506-3p的下游靶基因,作者发现转化生长因子-β1(TGF-β1)是最好的候选靶基因之一。据报道,TGF-β1参与肿瘤的发生和发展,并与N1/N2中性粒细胞的分化相关。为了探索miR-142-3p和miR-506-3p对TGF-β1表达的影响,作者进行了萤光素酶报告基因检测,证实了TGF-β1是miR-142-3p和miR-506-3p的共同靶基因。qRT-PCR和western blot分析进一步表明,与miR-NC组相比,转染miR-142-3p / miR-506-3p mimics可显着降低TGF-β1的mRNA和蛋白水平。为了进一步证实miR-142-3p和miR-506-3p对TGF-β1的调节作用,作者使用miR-142-3p / miR-506-3p mimics来处理CRC衍生的外泌体刺激的CRC细胞。作者观察到,导入CRC衍生的外泌体后,CRC细胞中TGF-β1的mRNA和蛋白水平均显着增加,而与miR-142-3p / miR-506-3p mimics共同治疗后,导致TGF-β1表达的促进作用被有效抑制。综上所述,TGF-β1是miR-142-3p和miR-506-3p的共同靶标。
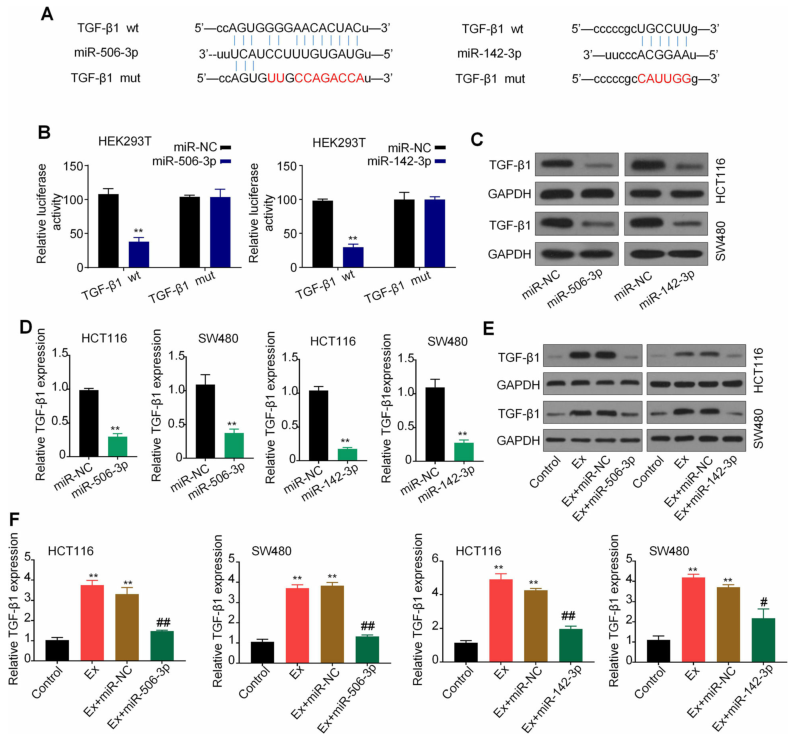
图5 TGF-β1是miR-142-3p / miR-506-3p的共同靶标
5、circPACRGL通过调节miR-142-3p /miR-506-3p-TGF-β1轴促进CRC细胞增殖、迁移和侵袭
根据以上数据,作者推测circPACRGL可能通过miR-142-3p /miR-506-3p-TGF-β1轴来调控CRC细胞增殖、迁移和侵袭。CCK8结果显示,在CRC衍生的外泌体治疗组(Ex-HCT116)中,CRC细胞增殖明显高于对照组。此外,与Ex-HCT116组相比,敲低circPACRGL显著降低了CRC细胞增殖,而经miR-142-3p/miR-506-3p抑制剂处理或过表达TGF-β1后,这种抑制作用会相应减弱。在细胞凋亡中也观察到了类似的效果。流式细胞仪检测表明,外泌体刺激的CRC细胞中,凋亡细胞百分比明显低于对照组。相比之下,敲低circPACRGL可以促进CRC细胞凋亡,但是这种促进作用可以被外泌体刺激所抑制。此外,在miR-142-3p / miR-506-3p抑制剂处理或过表达TGF-β1后,CRC细胞的凋亡率显着降低。接下来,划痕实验和Transwell分析均显示CRC衍生的外泌体可以增强CRC细胞的迁移和侵袭能力,而在circPACRGL敲低的细胞中则发生了相反的作用,CRC衍生的外泌体治疗可以挽救circPACRGL敲低细胞的迁移和侵袭能力受损。与CCK8和细胞凋亡检测结果一致,miR-142-3p / miR-506-3p抑制剂处理或过表达TGF-β1显着促进了circPACRGL敲低细胞的迁移和侵袭能力。
为了排除外泌体内其他成分的促癌作用,作者使用Lipo3000将circPACRGL进一步转染到CRC细胞中,以确认circPACRGL对增殖、迁移和侵袭的影响。CCK8和transwell结果显示,转染circPACRGL后,HCT116和SW480细胞的增殖、迁移和侵袭能力明显增强。以上结果表明,circPACRGL通过调节miR-142-3p /miR-506-3p-TGF-β1轴促进CRC细胞增殖、迁移和侵袭。
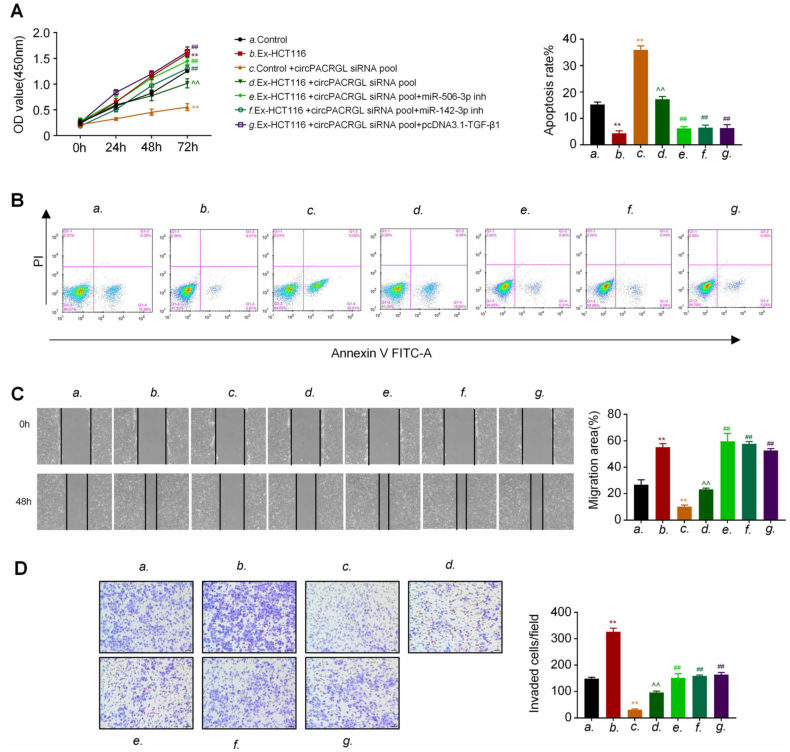
图6 circPACRGL通过调节miR-142-3p /miR-506-3p-TGF-β1轴促进CRC增殖、迁移和侵袭
6、CRC衍生的外泌体circPACRGL通过miR-142-3p /miR-506-3p-TGF-β1轴调节N1-N2中性粒细胞的分化
已有研究表明,高水平的TGF-β1与肿瘤的发生发展以及中性粒细胞由N1向N2的表型转换相关,而促肿瘤的N2中性粒细胞可促进肿瘤的增殖和转移。之前的研究结果表明,circPACRGL通过miR-142-3p /miR-506-3p-TGF-β1轴促进大肠癌的进展。作者进一步探讨CRC衍生的外泌体circPACRGL是否也可以通过这个轴调节中性粒细胞的N1-N2分化。流式细胞仪检测结果显示,CRC衍生的外泌体可以增加N2中性粒细胞的百分比,这与N2标记物CD11b + / Ly6G + / Ly6Clow的上调相一致。相比之下,作者观察到在circPACRGL敲低的细胞中,N2中性粒细胞的百分比显着降低,而加入CRC衍生的外泌体后,这种抑制作用被取消。此外,miR-142-3p / miR-506-3p抑制剂处理或过表达TGF-β1可以显着增加circPACRGL敲低细胞中N1-N2的分化。总体而言,作者发现CRC衍生的circPACRGL通过miR-142-3p /miR-506-3p-TGF-β1轴促进N1-N2中性粒细胞的分化。
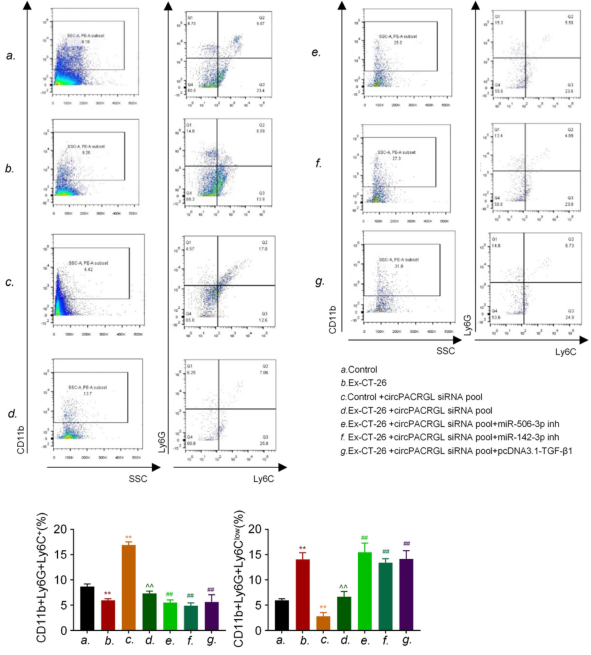
图7 癌症衍生的外泌体circPACRGL通过miR-142-3p /miR-506-3p-TGF-β1轴调节鼠大肠癌细胞中N1-N2中性粒细胞的分化
参考文献:[1] Shang A, Gu C, Wang W, et al. Exosomal circPACRGL promotes progression of colorectal cancer via the miR-142-3p/miR-506-3p- TGF-β1 axis. Mol Cancer. 2020;19(1):117. Published 2020 Jul 27. doi:10.1186/s12943-020-01235-0
.png)
