液-液相分离(LLPS)指的是一种细胞内不同成分(大分子蛋白质,RNA,DNA)间相互碰撞、融合形成液滴,从而使一些成分被包裹在液滴内,一些成分被阻隔在液滴外的现象。促进蛋白质间相互作用的蛋白结合区域,以及内在无序区域均可以触发LLPS。SGs是无细胞质膜核糖核蛋白(RNP)缩合物,在热休克、氧化应激、渗透应激或营养缺乏等各种环境应激下形成[1]。

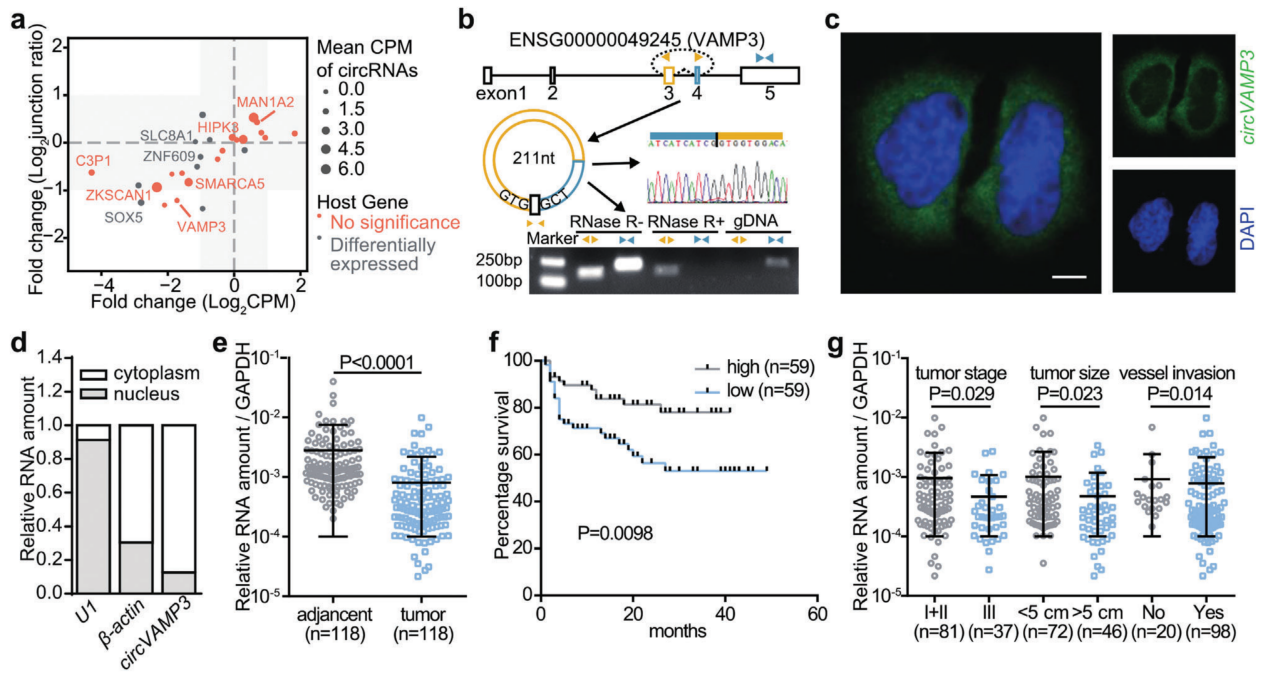
图1. circVAMP3在HCC中降低并与患者预后负相关
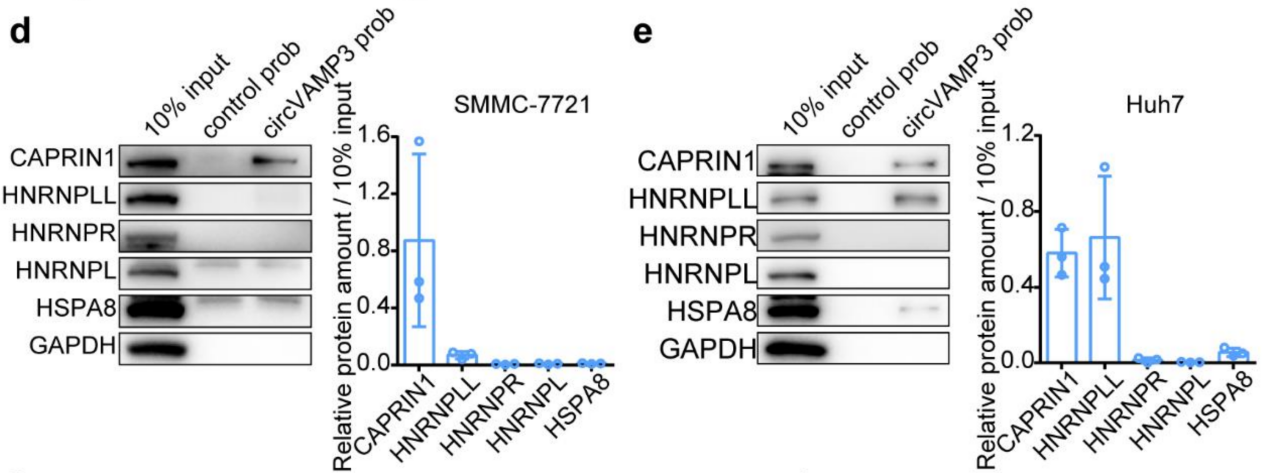
图2. 肝癌细胞RNA pull-down产物Western Blot分析
CAPRIN1蛋白通过其保守的RGG结构域与circVAMP3产生多个结合位点,这表明circVAMP3可以通过支撑CAPRIN1蛋白促进LLPS。由于circVAMP3不直接与G3BP1相互作用,因此circVAMP3不能促进G3BP1的体外LLPS。考虑到G3BP1可以与CAPRIN1相互作用形成蛋白复合物,circVAMP3可能通过与CAPRIN1相互作用来支架和浓缩CAPRIN1-G3BP1复合物,从而触发LLPS。如图3所示,作者通过IF及体外LLPS实验发现,circVAMP3触发CAPRIN1的相分离,促进应力颗粒的形成。
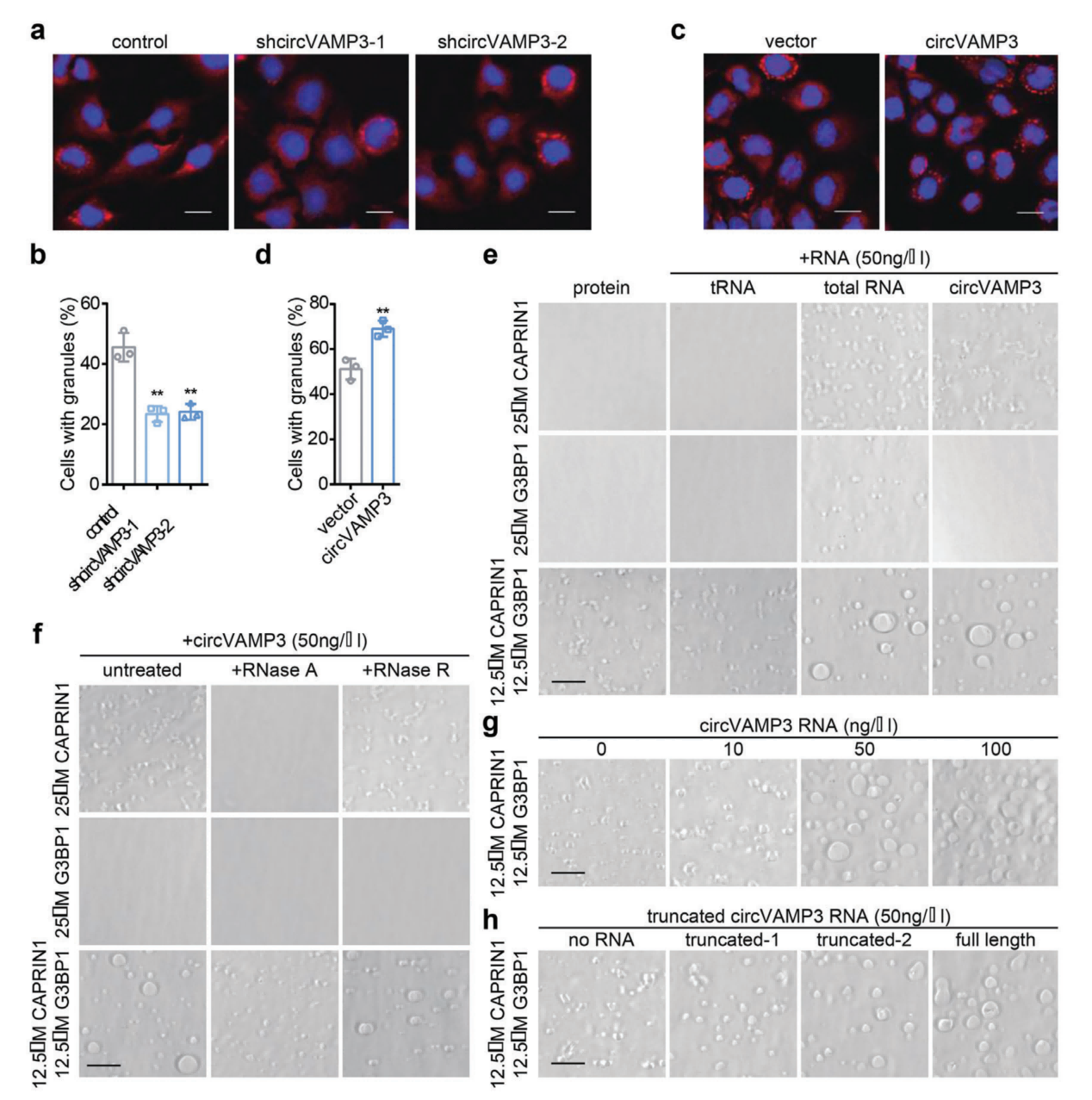 图3. circVAMP3促进LLPS
图3. circVAMP3促进LLPS
已有研究发现CAPRIN1的相分离可能调控mRNA的翻译[3]。因此,circVAMP3可能通过调控c-MYC翻译来影响c-MYC蛋白的表达水平。
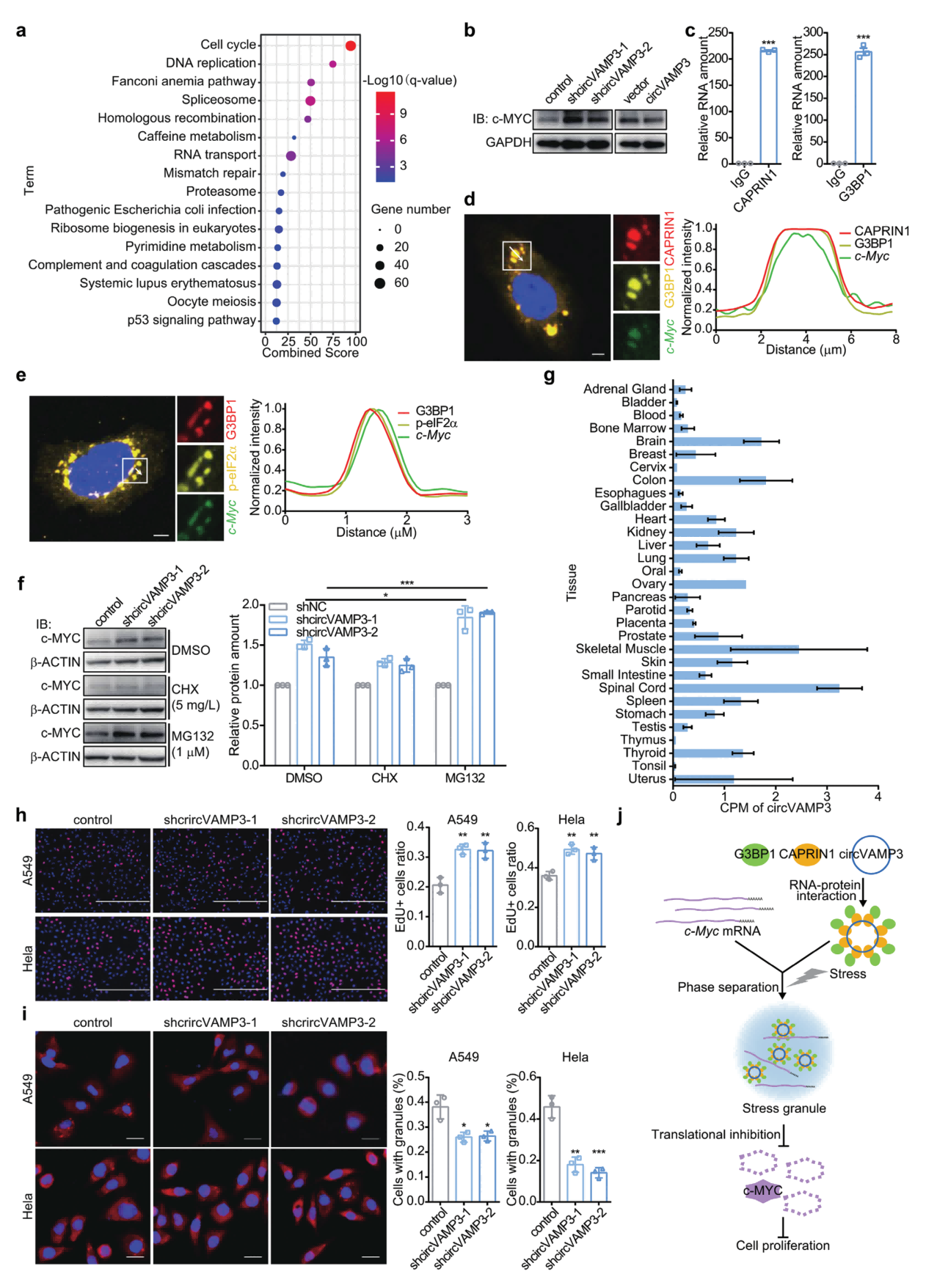 图4. circVAMP3抑制c-Myc的翻译,并在其他癌症中发挥其肿瘤抑制功能
图4. circVAMP3抑制c-Myc的翻译,并在其他癌症中发挥其肿瘤抑制功能
总之,本研究鉴定了一种重要的环状RNA,circVAMP3,它可以与CAPRIN1物理相互作用,促进SGs的形成并抑制c-Myc的翻译。鉴于circVAMP3在人体各种组织中含量丰富,并在相应的肿瘤组织中表达下调,它可能成为肝癌等多种癌症的新的诊断和治疗靶点。
原文链接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/advs.202103817
参考文献:
- Aulas, M. M. Fay, S. M. Lyons, C. A. Achorn, N. Kedersha, P. Anderson, P. Ivanov, J. Cell Sci. 2017, 130, 927.
- W. Du, W. Yang, E. Liu, Z. Yang, P. Dhaliwal, B. B. Yang, Nucleic Acids Res. 2016, 44, 2846.
- Wang, L. Cao, R. F. Thorne, X. D. Zhang, J. Li, F. Shao, L. Zhang,M. Wu, Sci. Adv. 2021, 7, eabe5708.
.png)
