

作者在心衰患者和左心室压力超负荷诱导的心脏重塑小鼠的心脏组织中筛选出显著性低表达,且具有高度保守性的Circ-INSR基因。分别在HF患者(人和鼠)心脏组织中验证了Circ-INSR的低表达,并在体内的阿霉素介导的心脏毒性组织中验证了其表达,体外条件下,阿霉素处理的HL-1心肌细胞样细胞和人诱导多功能干细胞衍生的心肌细胞重现了Circ-INSR的低表达。Circ-INSR在细胞质定位。
缺乏Circ-INSR会损害心肌细胞的代谢活性和存活。总之,细胞活力在阿霉素应激下降低,在Circ-INSR基因敲除后进一步恶化。小鼠体内实验表明,在阿霉素应激期间,心肌细胞中Circ-INSR的缺失导致代谢活动受损并诱导细胞凋亡,说明Circ-INSR具有心脏保护作用。为验证Circ-INSR的心脏保护作用,体外细胞实验证明,Circ-INSR可治疗并预防阿霉素诱导的心肌细胞代谢缺陷和凋亡。体内实验发现,Circ-INSR同样在体内具有治疗作用,可在体内保护阿霉素诱导的心脏毒性。
Circ-INSR来源和作用机制:
随后,作者对Circ-INSR的来源机制进行探讨,使用RERGNA 2.0软件工具预测潜在的剪接调节基序(Alu元件),预测发现Brca1是最有希望的调控基因。干扰Brca1可以显著性抑制Circ-INSR的表达,Brca1是一种不依赖于宿主基因的Circ-INSR表达的调节基因。
对Circ-INSR的下拉产物进行质谱分析,并对蛋白的结合效率进行验证,Circ-INSR和SSBP1之间存在相互作用,荧光定位证实了二者之间的结合关系。
转化角度分析:
1. AAV递送Circ-INSR治疗HF:
Circ-INSR对鼠心肌细胞损伤具有保护作用;人类Circ-INSR也可以调节人心肌细胞的代谢活性并防止细胞死亡。
2. 体外制备Circ-INSR治疗HF:
随着体外制备环状RNA技术的发展,作者旨在开发一种更加成熟的环状RNA治疗策略。如图1所示,基于Circ-INSR对阿霉素介导HF的影响,使用体外转录的Circ-INSR可以实现对阿霉素介导的心肌细胞死亡更优的治疗和保护作用。
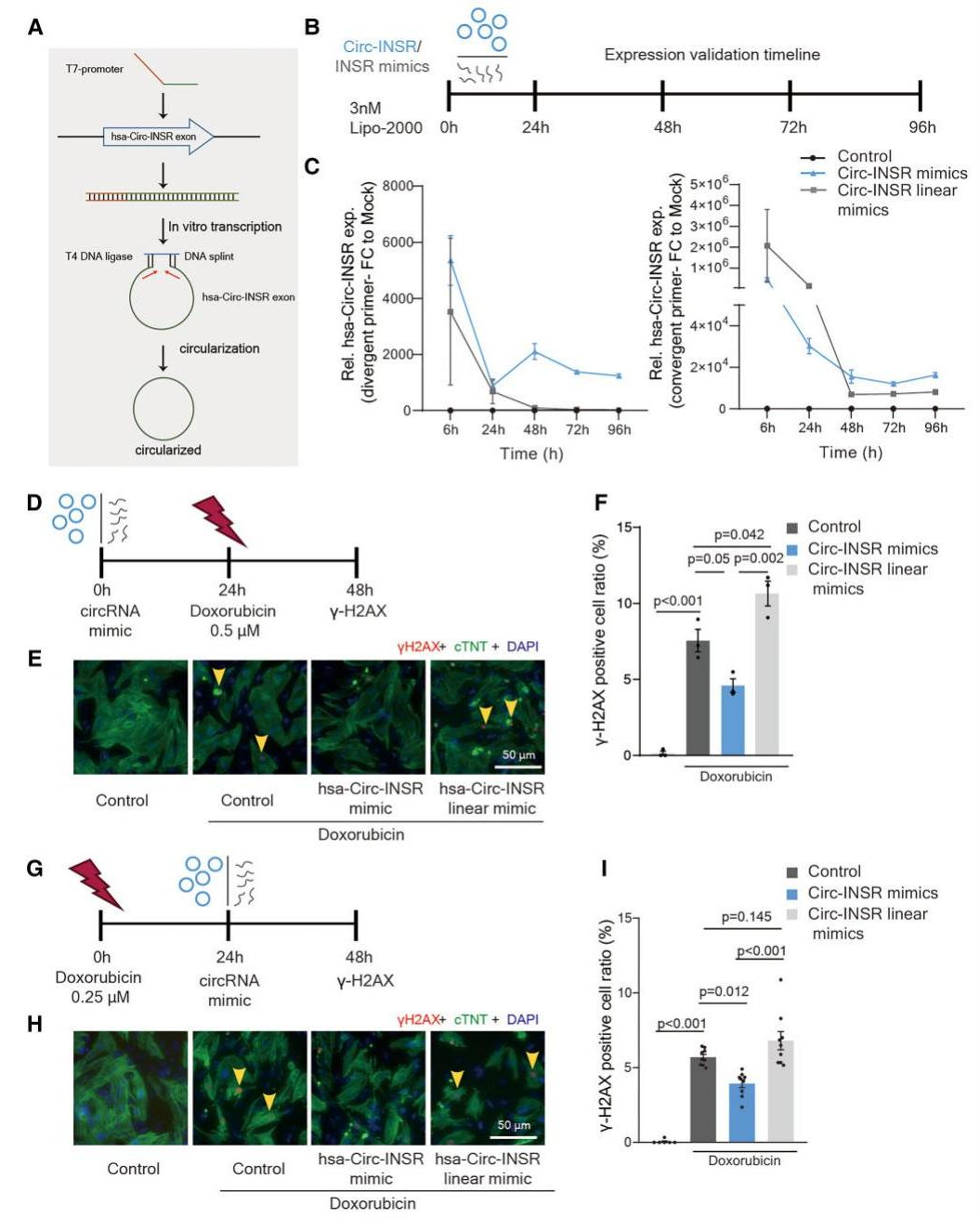
图1.Circ-INSR模拟物对HF的治疗作用
除了阿霉素外,其他蒽环类药物或抗癌药物如紫杉烷类药物也会引起意想不到的剂量和时间依赖性HF。因此,作者还测试了用不同浓度的其他抗癌药物(如表柔比星和紫杉醇)治疗心肌细胞后Circ-INSR的表达。数据表明,Circ-INSR在其他心脏毒性模型中可能也很重要,但在这方面还需要进一步的详细研究。
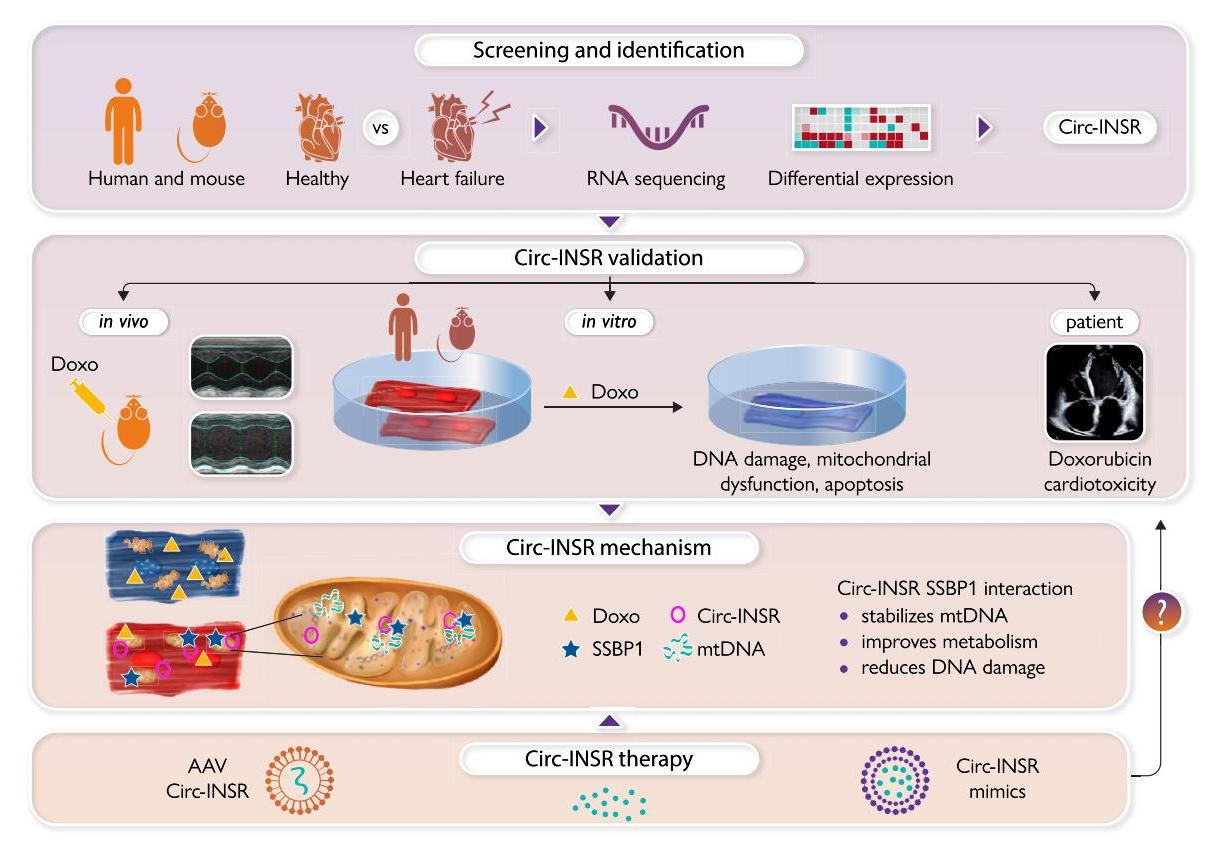
图2. 结构化图文摘要
[2].Santer L, Baer C, Thum T. Circular RNAs: a novel class of functional RNA molecules
with a therapeutic perspective. Mol Ther 2019;27:1350–1363.
.png)
