环状RNA是在真核生物中通过反向剪切产生的共价闭合RNA分子,具有核酸外切酶抗性和比线性RNA更高的稳定性。越来越多的研究表明,环状RNA作为生物标记物,对疾病的靶向诊断、预后和治疗具有重要的临床意义。进一步研究环状RNA的作用有助于解析肾透明细胞癌的潜在机制。

首先,在cRCC样本中,作者从GEO数据库(GSE100186;GSE137836)对比筛选挑9个显著性上调的circRNA,并经qRT-PCR检测筛选出表达丰度最高的circPOLR2A,最后选择cRCC细胞系中的两种细胞786O(circPOLR2A丰度最高)和Caki1(circPOLR2A丰度最低) 进行后续circPOLR2A功能验证。结果显示,circPOLR2A在cRCC细胞中稳定表达,并在体外条件下增强cRCC细胞增殖、迁移和侵袭,并抑制凋亡(如图1)。
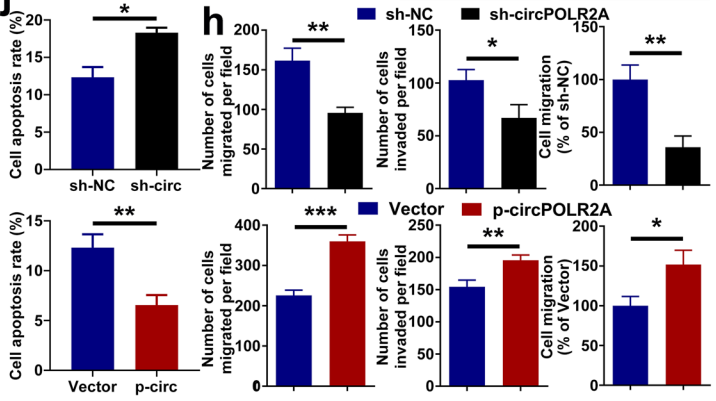
图1 circPOLR2A增强cRCC细胞功能
随后作者探索circPOLR2A作为致癌基因在cRCC中发挥作用的潜在机制。使用circPOLR2A的生物素标记探针进行了pull-down实验并对产物进行质谱分析,发现circPOLR2A在cRCC细胞中并不发挥miRNA海绵功能。而通过蛋白组学分析、WB和pull-down等实验方法检测发现circPOLR2A和PEBP1的表达呈现负相关。
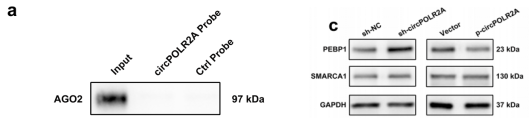
图2 circPOLR2A对PEBP1蛋白水平的影响
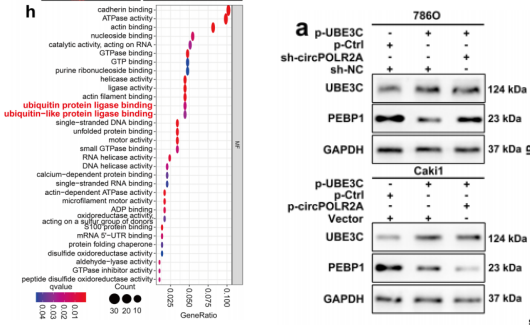
为进一步解析circPOLR2A机制,作者通过TeGO富集分析表明,circPOLR2A和PEBP1相互作用可能和蛋白质泛素化和降解途径相关。过表达和敲除circPOLR2A后加以蛋白酶抑制剂MG132处理发现,circPOLR2A可抑制PEBP1蛋白表达。随后作者引入UBE3C(一种参与PEBP1泛素化的特异性泛素E3连接酶)发现UBE3C和circPOLR2A存在结合并针对PEBP1表达具有协同作用。这提示:circPOLR2A可通过泛素-蛋白酶体途径介导UBE3C与PEBP1相互作用,从而降解PEBP1蛋白。
ERK通路在癌症的形成中起着重要作用。PEBP1作为Raf1/MEK/ERK通路的关键靶标,其上调将抑制ERK通路。作者发现过表达circPOLR2A抑制PEBP1的表达,促进p-ERK1/2的表达,而相反,敲低circPOLR2A则逆转这一结果。这提示:circPOLR2A通过下调PEBP1的蛋白水平激活ERK信号通路。
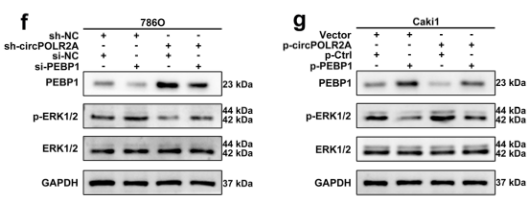
图4 circPOLR2A调控ERK信号通路
有研究表明,m6A修饰阅读器YTHDF2参与RNA代谢过程[2]。作者使用几种方法验证m6A修饰是否参与了circPOLR2A生成。首先使用SRAMP数据库预测circPOLR2A含有4个高置信度的m6A基序;使用MeRIP分析出circPOLR2A同识别m6A修饰的RARA(阳性对照)均在m6A靶点显著富集;又敲低m6A写入器METTL3和YTHDF2显著诱导circPOLR2A的表达;再构建m6A位点突变的circPOLR2A质粒circPOLR2A-MUT,发现敲低METTL3和YTHDF2显著诱导circPOLR2A-WT组中circPOLR2A的表达,而突变组无明显变化;最后作者使用RNA甲基化抑制剂DZNep处理发现,敲低YTHDF2诱导的circPOLR2A表达减弱。综上提示:m6A修饰参与了circPOLR2A的代谢过程。
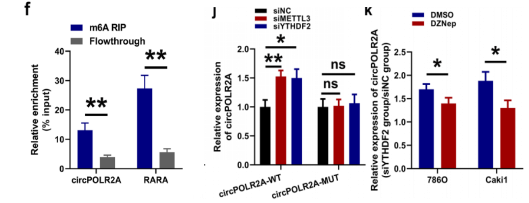
图5 m6A解读器YTHDF2调控circPOLR2A的表达
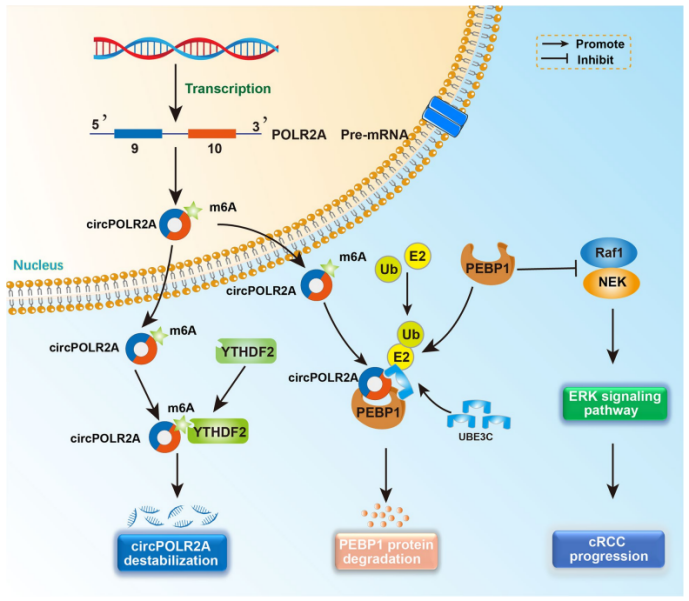
circPOLR2A在cRCC中的潜在的分子机制
原文链接:
https://doi.org/10.1186/s12943-022-01607-8
参考文献:
[1]Dabestani S, Thorstenson A, Lindblad P, Harmenberg U, Ljungberg B, Lundstam S. Renal cell carcinoma recurrences and metastases in primary nonmetastatic patients: a population-based study. World J Urol. 2016;34:1081–6.
[2]Chen Y, Ling Z, Cai X, Xu Y, Lv Z, Man D, et al. Activation of YAP1 by N6-Methyladenosine-modifed circCPSF6 drives malignancy in hepato cellular carcinoma. Cancer Res. 2022;82:599–614.
转载请联系邮箱授权:circRNA@163.com
.png)
