尿液是一种有价值的诊断介质,在临床应用中已经成为仅次于血液的第二种最常用于临床诊断的体液类型。尿细胞外囊泡(urinary Extracellular Vesicles, uEVs),被认为是一种动态的生物活性液体,提升uEVs研究的标准化和可重复性,可反映肾脏,尿路上皮和前列腺组织中的分子过程以及生理和病理状况。

首先,作者从福尔马林浸泡的前列腺肿瘤和uEVs(来自前列腺患者)中提取总RNA进行差异表达分析发现,与肿瘤相比,uEVs在尿液中携带各种类型的RNAs,并且亚群非常丰富。在非编码 RNA中,lncRNA和circRNA的两个亚家族在uEVs中表现出差异富集。
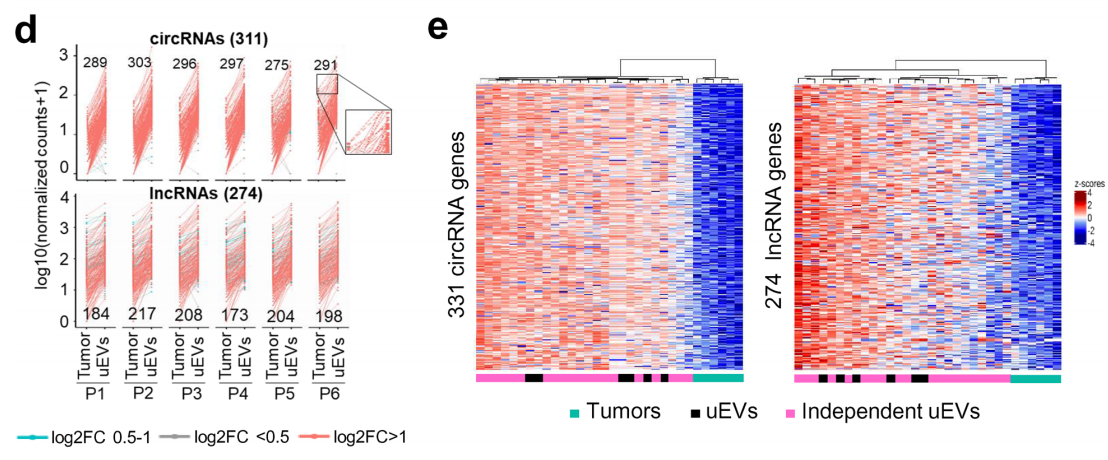 图1 lncRNA及circRNA在肿瘤和uEVs中的差异表达
图1 lncRNA及circRNA在肿瘤和uEVs中的差异表达
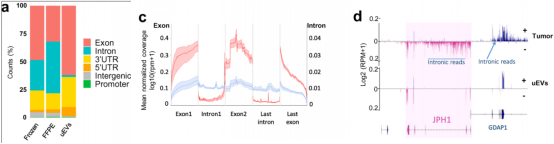
图2 uEVs中成熟的RNA大多来自细胞质
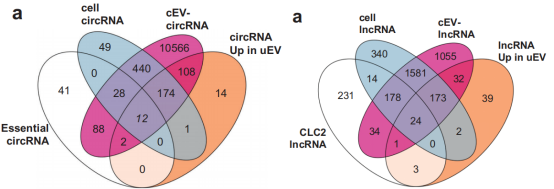
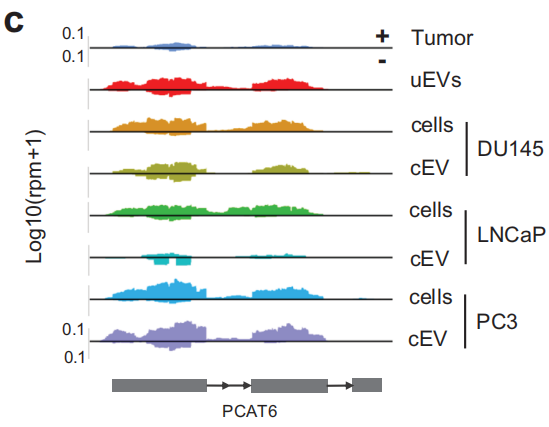 图3 circRNA和lncRNA表达富集状况
图3 circRNA和lncRNA表达富集状况
为了解析uEV-lncRNA是否可以编码出稳定的肽段,作者对PC3、LNCaP 和 HCT116 细胞系进行了蛋白质组学质谱分析,并将MS检测到的肽与来自PC3-lncRNA 的预测编码肽进行了比较,发现了15个uEV-lncRNAs,预测编码768个高亲和力的新抗原,其中三个编码的ORF产生了质谱检测到的未修饰的多肽。然后,核糖体分析数据集观察到,15个lncRNA中有5个与活跃翻译的核糖体相关,并且包含了质谱检测到的未修饰的一个多肽,表明该uEV-lncRNA可翻译并产生稳定的肽。综上表示,uEVs中含有带ORFs的lncRNAs,并且具有很高的翻译潜力。
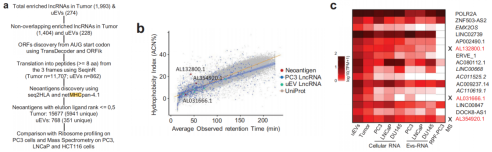
图4 EVs中富集的lncRNA具有翻译功能
原文链接:
https://doi.org/10.1002/jev2.12210
参考文献:
[1]Van Niel G, d’Angelo G, Raposo G. Shedding light on the cell biology of extracellular vesicles[J]. Nature reviews Molecular cell biology, 2018, 19(4): 213-228.
[2]Hulstaert E, Morlion A, Cobos F A, et al. Charting extracellular transcriptomes in the human biofluid RNA atlas[J]. Cell Reports, 2020, 33(13): 108552.
转载请联系邮箱授权:circRNA@163.com
.png)
