
01
筛选特异性的环状RNA
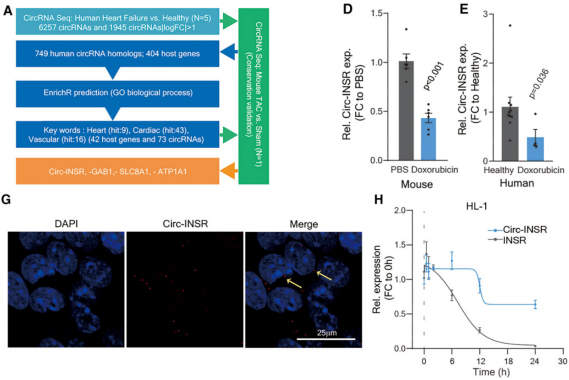
图1.Circ-INSR的筛选
02
验证环状RNA的功能
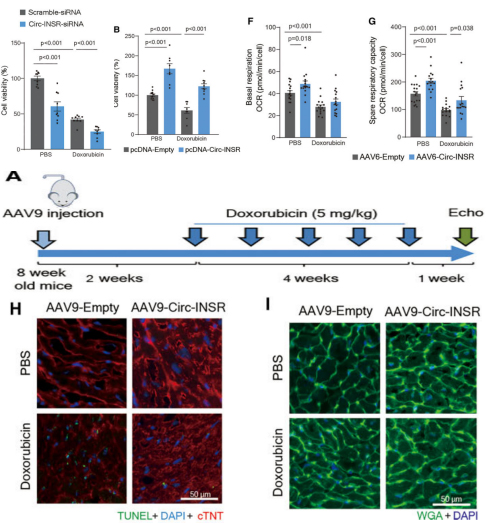
图2.Circ-INSR功能的验证
03
Circ-INSR表达调控基因的寻找和Circ-INSR作用机制的探索
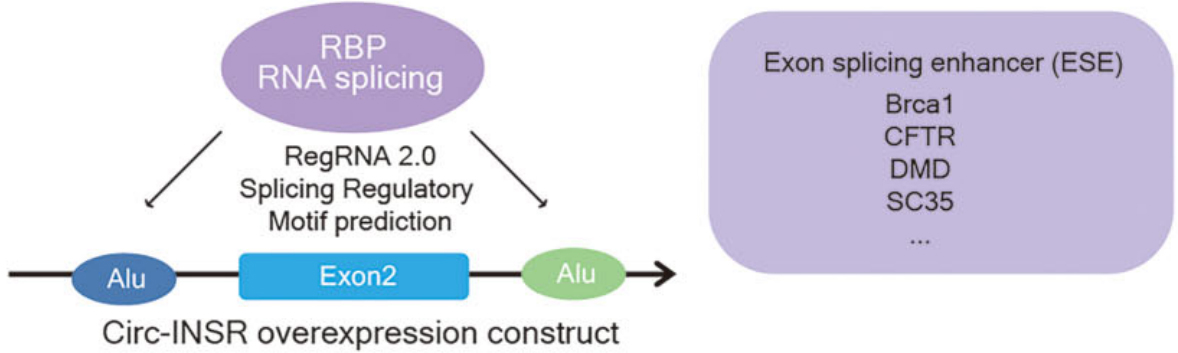
图3.Brca1基因的预测
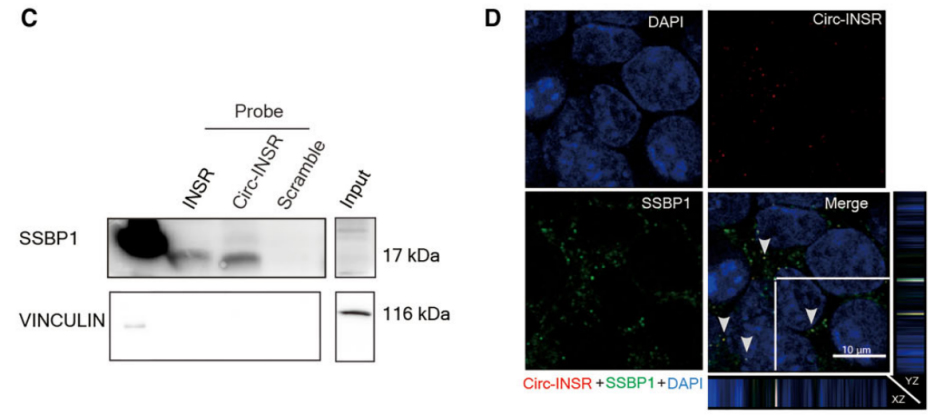
图4.Circ-INSR与SSBP1的互作
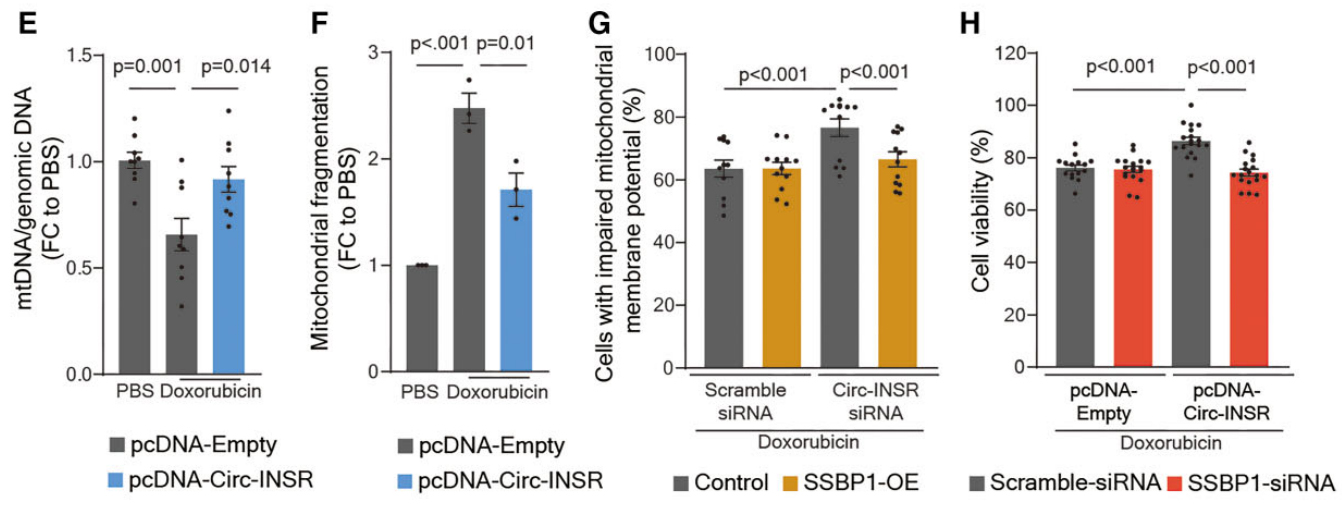
图5.SSBP1是Circ-INSR的下游靶基因
04
Circ-INSR初步转化—腺病毒
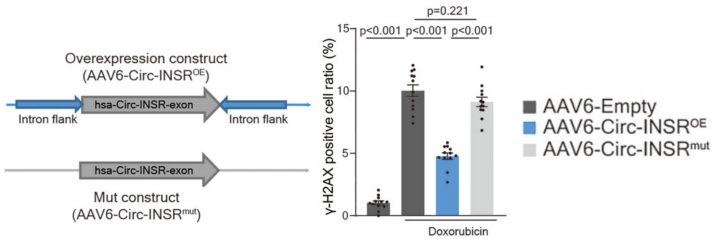
图6.腺病毒表达Circ-INSR治疗HF
05
Circ-INSR升级版转化—体外制备
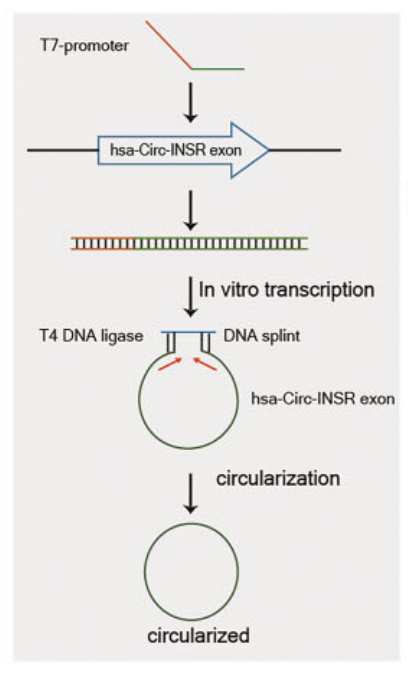
图7.夹板法体外制备Circ-INSR
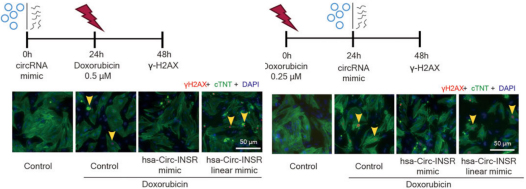
图8.体外制备的Circ-INSR治疗HF
综上所述,作者开发一种更加成熟的环状RNA治疗策略:基于Circ-INSR对阿霉素介导HF的影响,使用体外制备的Circ-INSR,优化了腺病毒自身的不足,针对阿霉素介导的心肌细胞死亡,开创了更优的治疗和保护方案。作者还鉴定了Circ-INSR与SSBP1的物理和功能相互作用,SSBP1在调节心肌细胞凋亡和线粒体膜电位方面发挥作用。除了阿霉素外,作者指出其他蒽环类药物或抗癌药物如紫杉烷类药物也会引起剂量-时间依赖性HF,Circ-INSR在这些心脏毒性模型中可能也很重要,需要广大研究者为此做出进一步的探索。
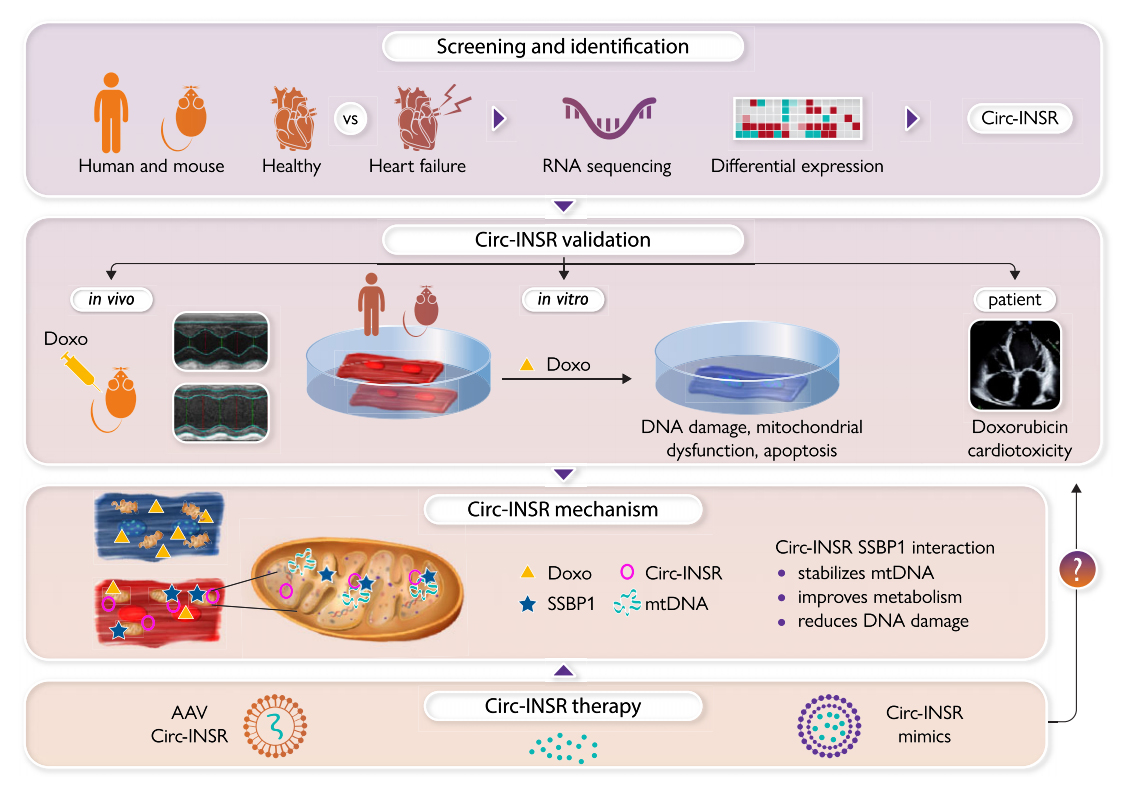 图9. 结构化图文摘要
图9. 结构化图文摘要
写在最后
[2].Santer L, Baer C, Thum T. Circular RNAs: a novel class of functional RNA molecules with a therapeutic perspective. Mol Ther 2019;27:1350–1363.
转载请联系邮箱授权:circRNA@163.com
.png)
