目前对于circRNA发挥作用的机制研究主要集中在circRNA作为miRNA海绵及RNA结合蛋白的支架分子上,蛋白质编码环状RNA由于其特殊的环状特性,能以更稳定的方式表达蛋白质,近年来成为研究的热点。一些文章已经证明了这些环状RNA及其蛋白产物在癌症中的关键作用,包括胶质母细胞瘤、肝癌和结肠癌[4-6]。然而蛋白质编码环状RNA在TNBC中的重要作用尚未被充分研究。
2021 年 8 月 25 日,山东大学齐鲁医院乳腺外科杨其峰教授作为通讯作者在Molecular Therapy发表文章circ-EIF6 encodes EIF6-224aa to promote TNBC progression via stabilizing MYH9 and activating Wnt/beta-catenin pathway。研究发现一种新的蛋白编码环状RNA(circ-EIF6),circ-EIF6通过编码肽段EIF6-224aa,与致癌基因MYH9直接相互作用,抑制泛素-蛋白酶体途径进而激活Wnt/ β -catenin途径降低MYH9降解,促进TNBC细胞在体内和体外的增殖和转移。这为TNBC患者提供了一个潜在的预后生物标志物。

一、circ-EIF6在TNBC中上调,高表达水平预示不良预后
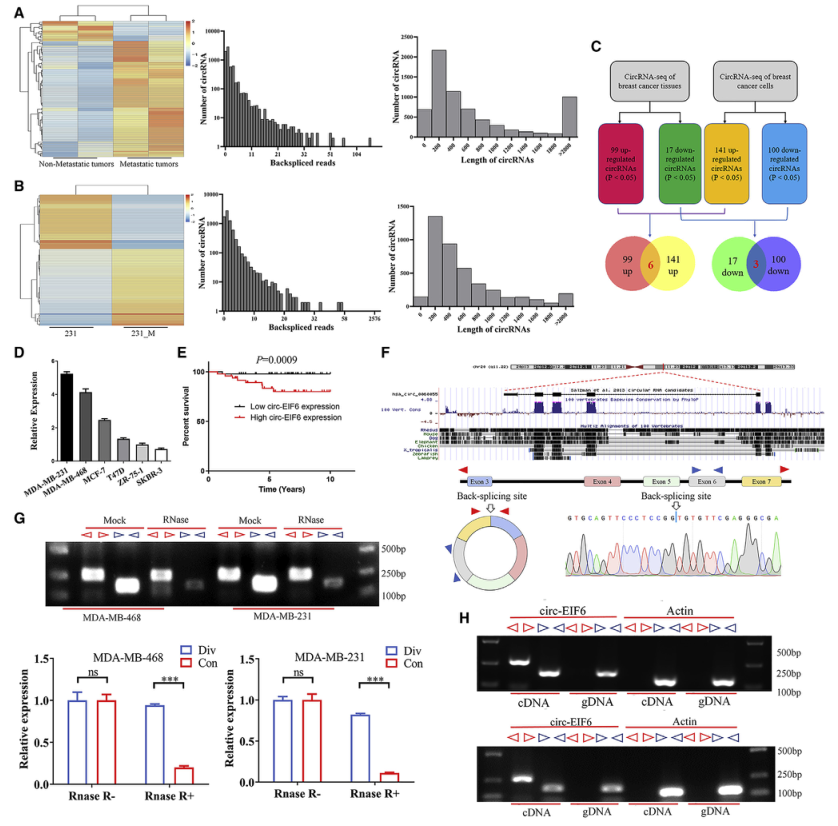
图1.BC中circ-EIF6的鉴定及其特征
二、敲低circ-EIF6可抑制TNBC细胞的增殖、迁移和侵袭
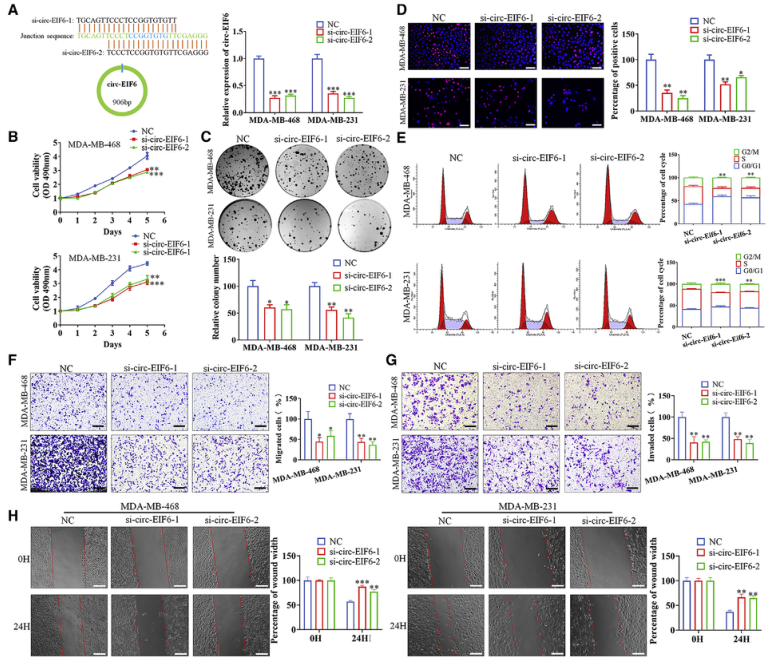
图2.敲低circ-EIF6可抑制TNBC细胞的增殖、迁移和侵袭
三、circ-EIF6编码了一个224-aa的新肽EIF6-224aa
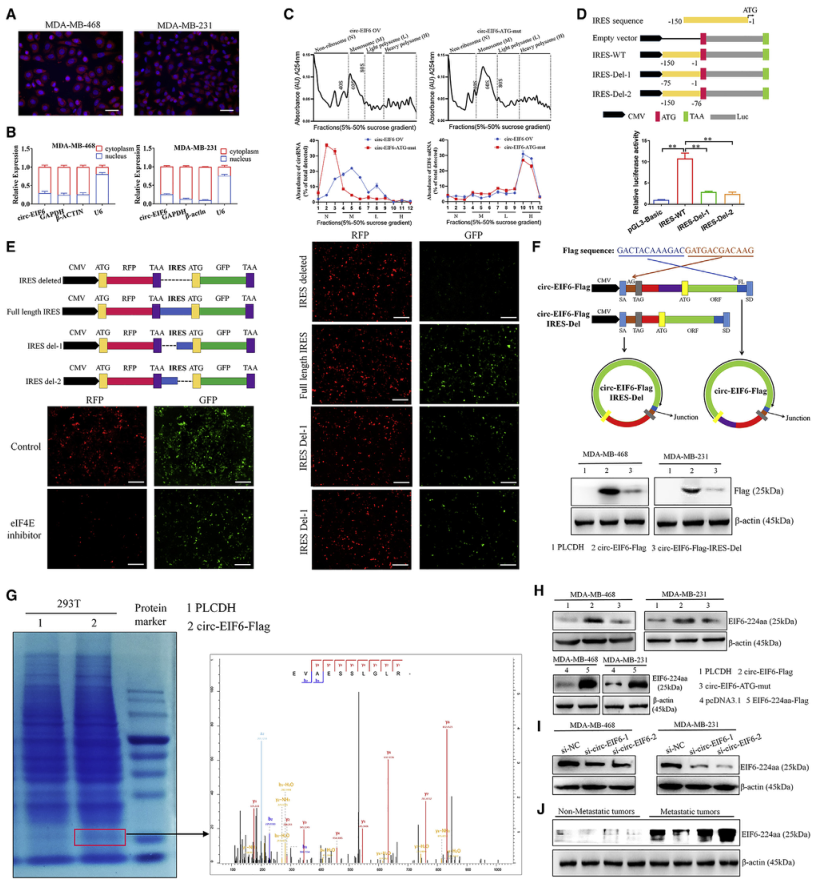
图3. circ-EIF6编码了一个224-aa的新肽EIF6-224aa
四、EIF6-224aa促进TNBC细胞增殖和转移,而circ-EIF6无促进作用
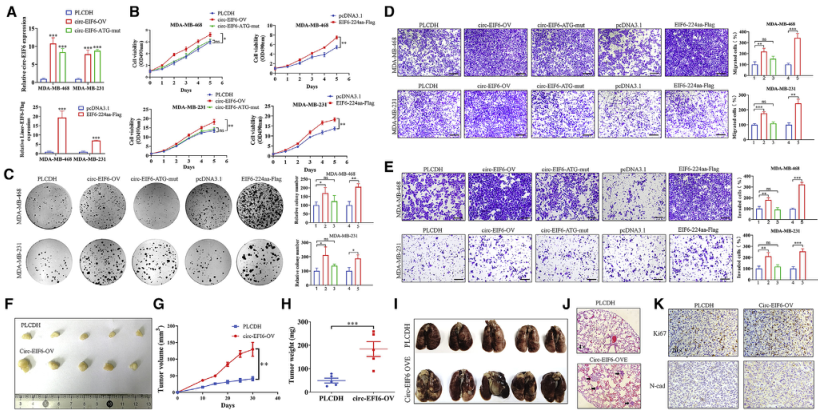
图4. EIF6-224aa促进TNBC细胞增殖和转移
五、EIF6-224aa直接与MYH9蛋白相互作用,保护其不被降解
通过CHX-chase和泛素化分析,在EIF6-224aa- flag过表达载体转染的TNBC细胞中加入蛋白合成抑制剂Cycloheximide (CHX)和蛋白酶体抑制剂MG132,采用western blot法检测MYH9蛋白的表达。如图5G和H所示,过表达EIF6-224aa降低了MYH9的降解速度,说明circ-EIF6表达的内源性EIF6-224aa保护了MYH9的降解。上述结果表明过表达EIF6-224aa降低了MYH9蛋白的泛素化水平,从而保护MYH9免受蛋白酶体降解。
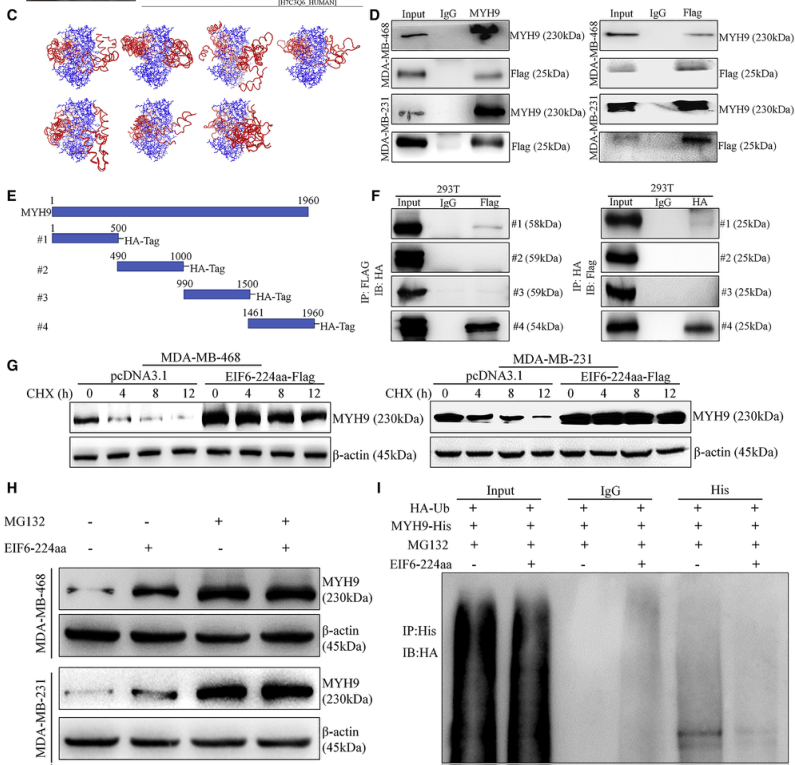
图5. EIF6-224aa直接与MYH9蛋白相互作用
六、EIF6-224aa通过激活MYH9/Wnt/ β -catenin通路促进TNBC进展
已有研究报道MYH9的表达与Wnt/ β -catenin通路的激活相关,作者在研究中验证了EIF6-224aa过表达和MYH9敲除对Wnt/ β -catenin通路及下游靶基因的影响。过表达EIF6-224aa后,β -catenin蛋白表达上调,而用siRNA敲除MYH9后,β -catenin蛋白表达下调。下游靶蛋白(cyclin D1、c-Myc、N-cadherin、E-cadherin、vimentin)的表达发生相应变化。此外,作者还检测到了下游靶基因(CCND1、AXIN2、SURVIVIN、LEF1、NKD1和TCF1) mRNA表达的变化,并证明了Wnt/ β -catenin通路中的靶基因通过EIF6-224aa上调,而敲低MYH9可以拮抗EIF6-224aa的作用(图6)。
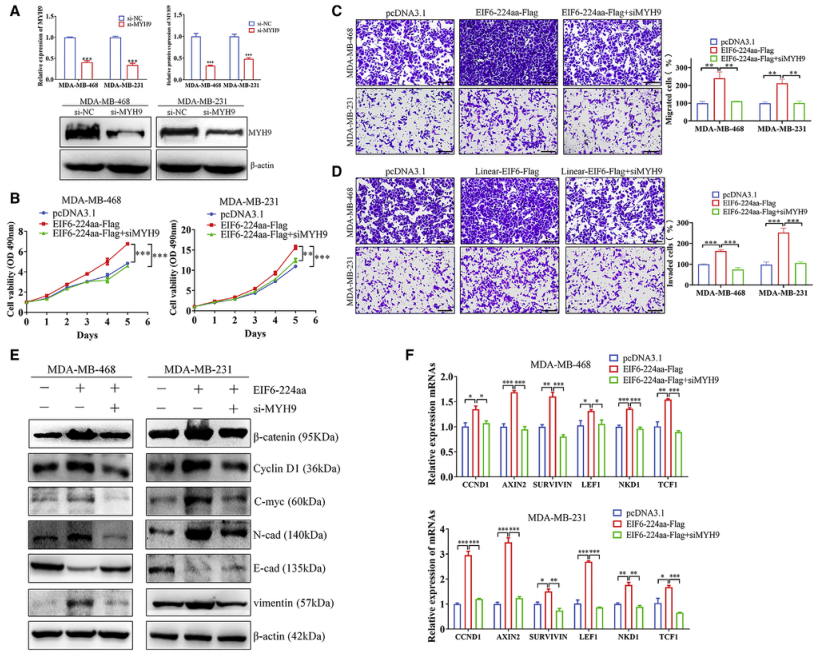
图6. EIF6-224aa通过激活MYH9/Wnt/ β -catenin通路促进TNBC进展
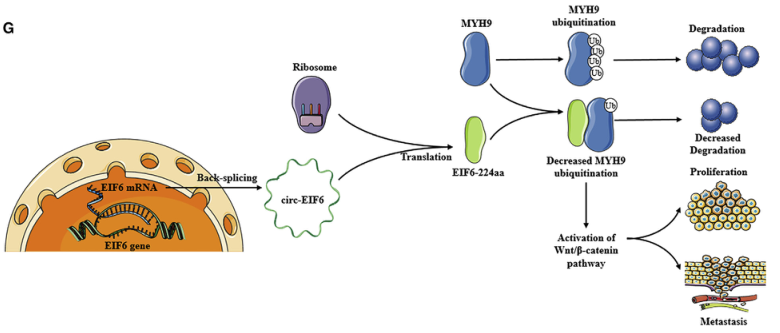
图7 circ-EIF6调节TNBC增殖和转移的机制示意图
此外,circ-EIF6在TNBC患者中是一个潜在的预后生物标志物。新发现的编码circ-EIF6拓宽了对TNBC潜在机制的认识,并为TNBC患者的治疗提供了一个潜在的预后和治疗靶点。
https://doi.org/10.1016/j.ymthe.2021.08.026
参考文献:
1. Anders, C., and Carey, L.A. (2008). Understanding and treating triple-negative breast cancer. Oncology (Williston Park) 22, 1233–1239, discussion 1239-1240, 1243.
2. Bianchini, G., Balko, J.M., Mayer, I.A., Sanders, M.E., and Gianni, L. (2016). Triple-negative breast cancer: challenges and opportunities of a heterogeneous disease. Nat.Rev. Clin. Oncol. 13, 674–690.
3. Haffty, B.G., Yang, Q., Reiss, M., Kearney, T., Higgins, S.A., Weidhaas, J., Harris, L.,Hait, W., and Toppmeyer, D. (2006). Locoregional relapse and distant metastasis in conservatively managed triple negative early-stage breast cancer. J. Clin. Oncol. 24,5652–5657.
4. Liang, W.C., Wong, C.W., Liang, P.P., Shi, M., Cao, Y., Rao, S.T., Tsui, S.K., Waye,M.M., Zhang, Q., Fu, W.M., and Zhang, J.F. (2019). Translation of the circularRNA circb-catenin promotes liver cancer cell growth through activation of the Wnt pathway. Genome Biol. 20, 84.
5. Zheng, X., Chen, L., Zhou, Y., Wang, Q., Zheng, Z., Xu, B., Wu, C., Zhou, Q., Hu, W.,Wu, C., and Jiang, J. (2019). A novel protein encoded by a circular RNA circPPP1R12A promotes tumor pathogenesis and metastasis of colon cancer via Hippo-YAP signaling. Mol. Cancer 18, 47.
6. Ye, F., Gao, G., Zou, Y., Zheng, S., Zhang, L., Ou, X., Xie, X., and Tang, H. (2019).circFBXW7 Inhibits Malignant Progression by Sponging miR-197-3p and Encoding a 185-aa Protein in Triple-Negative Breast Cancer. Mol. Ther. Nucleic Acids 18, 8 8–98
转载请联系邮箱授权:circRNA@163.com
.png)
