circRNA(环状RNA)是一种通过选择性剪接形成的非编码RNA。circRNA的环状结构使其难以在体内降解,并在肿瘤和血清外泌体中特异性表达。因此,circRNA可被视为肿瘤发生的有效RNA生物标志物。就机制而言,研究表明circRNA可能通过充当ceRNA来海绵miRNA或充当支架来调节肿瘤进展[3]。并且外泌体携带的circRNA可在细胞间通信中发挥重要作用。

01、RNA-seq测序鉴定低氧PC细胞外泌体中的环状RNA
circRNA在血清外泌体中被广泛检测到,并被认为是血清外泌体中潜在的肿瘤标志物。因此,为了探索circPDK1是否可以在血清外泌体中检测到,以及它作为肿瘤标志物的潜力,作者收集了20名PC患者和10名健康个体的血液样本作为对照。结果发现,来自血清外泌体的circPDK1在PC患者中大量表达,而在健康对照组中几乎不存在。综上所述,circPDK1在PC中显著上调,并与PC的不良预后相关,可在血清外泌体中稳定传递和富集。这表示,circPDK1可作为PC的早期诊断的circRNA生物标志物。
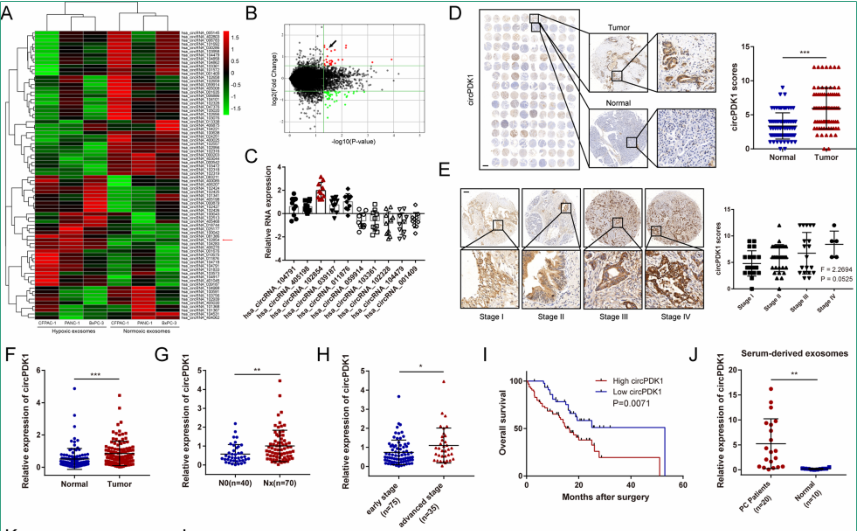
图1. RNA-seq测序鉴定低氧PC细胞外泌体中的circPDK1
02、circPDK1特性
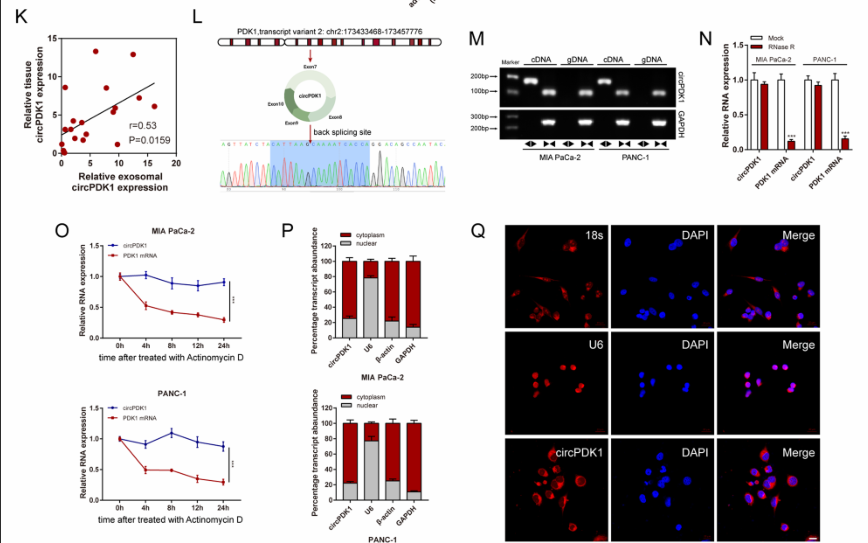
图2.circPDK1特性
03、缺氧环境下HIF1A促进外泌体circPDK1表达

图3.缺氧环境下HIF1A促进外泌体circPDK1表达
04、细胞功能研究——缺氧下外泌体circPDK1促进PC细胞体外和体内增殖和迁移
体内裸鼠实验——为了探讨外泌体circPDK1在体内的恶性作用,作者建立了裸鼠异种移植瘤模型(MIA PaCa-2细胞系),并每3天静脉注射各组小鼠一次MIA PaCa-2产生的外泌体(常氧外泌体、缺氧外泌体、缺氧NC外泌体和缺氧sh1-circPDK1外泌体)。注射完成后,取小鼠肿瘤组织,发现低氧的NC外泌体(circPDK1高表达)增加了异种移植瘤的体积和重量以及肺转移结节,而低氧的sh1-circPDK1外泌体消除了这一结果。IHC检测PCNA、E-cadherin和vimentin发现,circPDK1高表达也促进PCNA和vimentin表达以及/N-cadherin低表达,而sh1-circPDK1结果与之相反。体内与体外实验结果一致,均表明缺氧诱导的外泌体circPDK1在体内促进PC细胞生长和迁移。
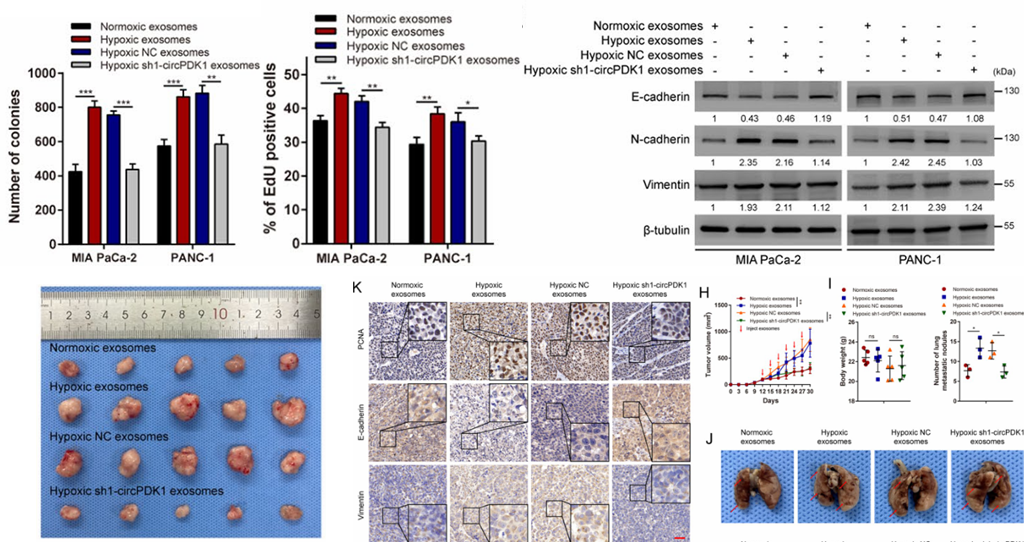
图4.缺氧下外泌体circPDK1对PC细胞功能的影响
05、机制探索1——在PC中circPDK1起miR 628 3p海绵的作用
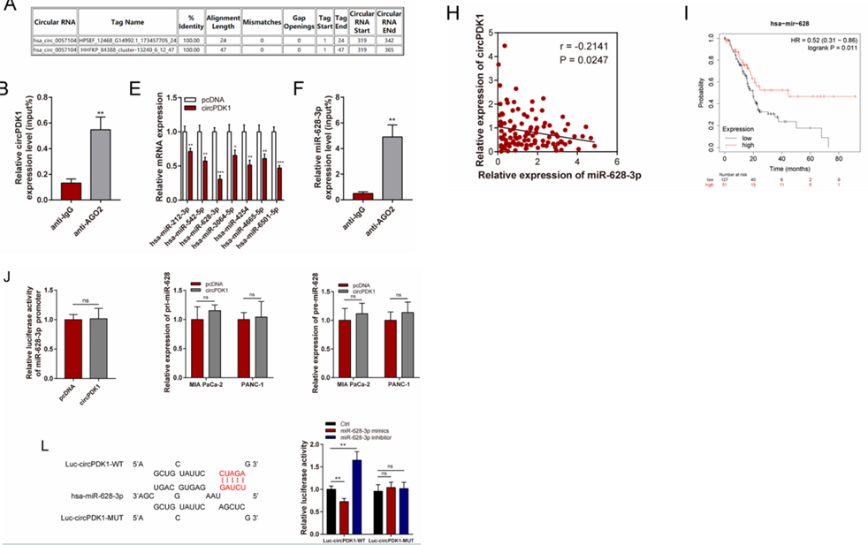
图5.circPDK1发挥miR 628 3p分子海绵作用
5-1、circPDK1作为miR-628-3p的ceRNA促进BPTF的表达
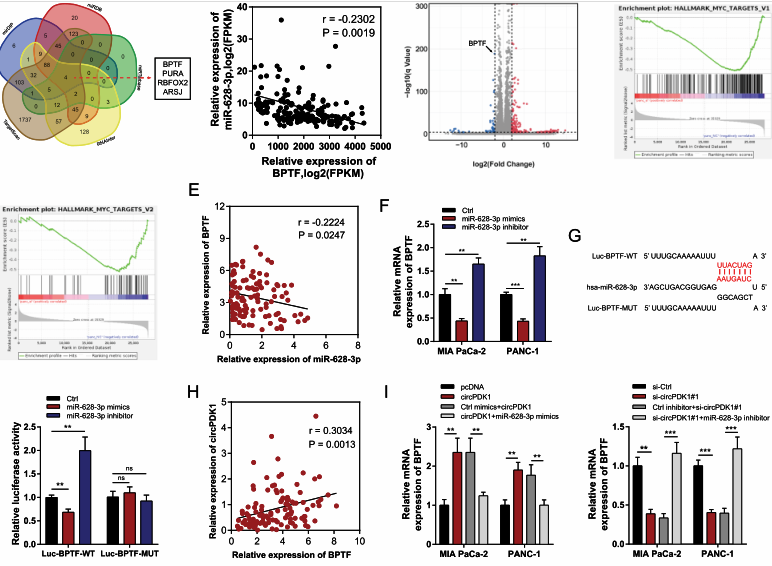
图6.circPDK1作为ceRNA促进BPTF的表达
06、机制探索2——circPDK1与BIN1相互作用,增强BIN1的泛素化

图7.circPDK1与BIN1相互作用,增强BIN1的泛素化
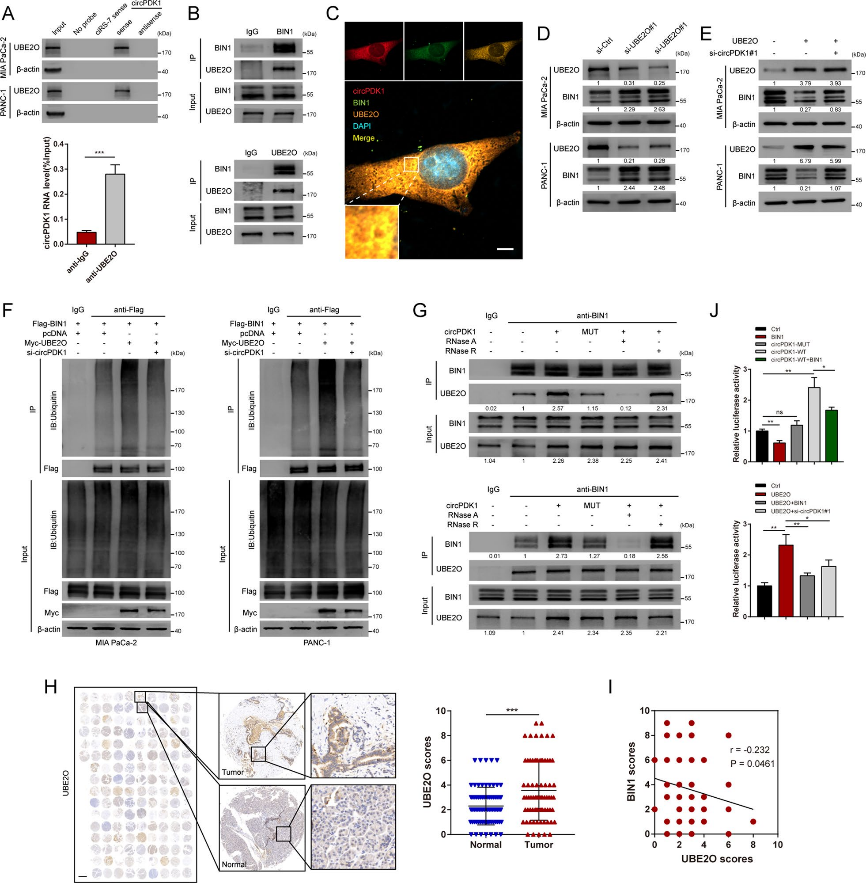
图8.circPDK1作为BIN1与UBE2O结合的支架
07、circPDK1通过激活c myc促进糖酵解
已知c-myc是Warburg效应的关键介导因子,它直接激活各种糖酵解靶基因,以满足快速增殖和转移的需要[8]。因此,作者探索了circPDK1是否与糖酵解相关。通过qRT-PCR和Western blotting对糖酵解基因进行分析,结果发现,敲低circPDK1对这些糖酵解基因的表达没有明显的抑制作用,仅仅是减少乳酸和ATP的产生和葡萄糖的摄入,以及细胞外酸化率(ECAR)和耗氧率(OCR)。但是PET-CT扫描显示敲低circPDK1会显著抑制小鼠皮下肿瘤中的葡萄糖代谢,并且敲低circPDK1会抑制c-myc活性。进一步的研究发现,BIN1逆转了circPDK1过表达诱导的糖酵解,miR-628-3p结果与之类似,二者也均能抑制c-myc活性。同时,敲低circPDK1和过表达BIN1也会抑制UBE2O诱导的糖酵解电位。总的来说,这些数据表明c-myc介导了circPDK1在糖酵解中的作用。
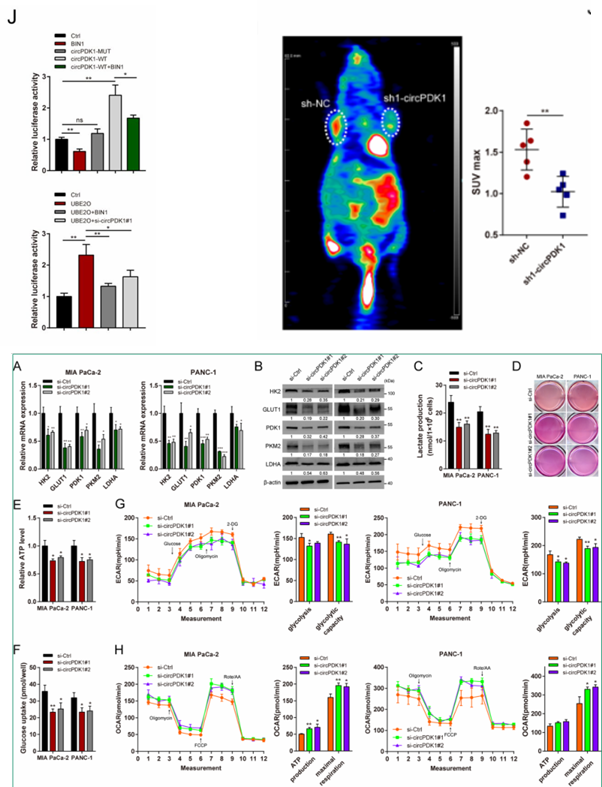
图9.circPDK1通过激活c myc促进糖酵解
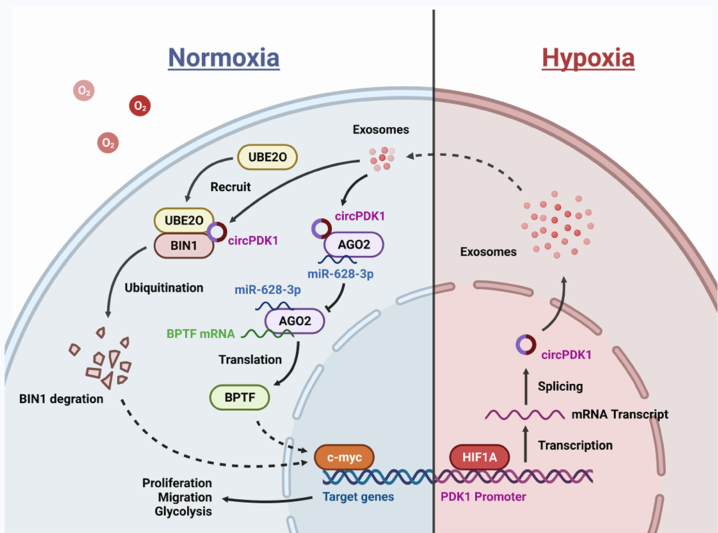 摘要图
摘要图
https://doi.org/10.1186/s13045-022-01348-7
参考文献:
[1] Kamisawa T, Wood LD, Itoi T, Takaori K. Pancreatic cancer. Lancet. 2016;388:73 85.
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017. CA Cancer J Clin. 2017;67:7 30.
[3] Chen LL. The expanding regulatory mechanisms and cellular functions of circular RNAs. Nat Rev Mol Cell Biol. 2020;21:475 90.
[4] Li Y, Zheng Q, Bao C, Li S, Guo W, Zhao J, et al. Circular RNA is enriched and stable in exosomes: a promising biomarker for cancer diagnosis. Cell Res. 2015;25:981 4.
[5] Zeng Z, Zhao Y, Chen Q, Zhu S, Niu Y, Ye Z, et al. Hypoxic exosomal HIF- 1α-stabilizing circZNF91 promotes chemoresistance of normoxic pancre- atic cancer cells via enhancing glycolysis. Oncogene. 2021;40:5505 17.
[6] Richart L, Carrillo-de Santa Pau E, Río-Machín A, de Andrés MP, Cigudosa JC, Lobo VJS, et al. BPTF is required for c-MYC transcriptional activity and in vivo tumorigenesis. Nat Commun. 2016;7:10153.
[7] Kinney EL, Tanida S, Rodrigue AA, Johnson JK, Tompkins VS, Sakamuro D. Adenovirus E1A oncoprotein liberates c-Myc activity to promote cell proliferation through abating Bin1 expression via an Rb/E2F1-dependent mechanism. J Cell Physiol. 2008;216:621 31.
[8] Stine ZE, Walton ZE, Altman BJ, Hsieh AL, Dang CV. MYC, Metabolism, and Cancer. Cancer Discov. 2015;5:1024 39.
转载请联系邮箱授权:circRNA@163.com
.png)
