环状RNA(circRNA)是一组具有独特闭合环状结构的内源性RNA分子,在癌症的发生和发展中具有多种功能,例如作为microRNA(MiRNA)海绵的功能或作为蛋白质合成的模板。在之前的研究中,我们发现circAXIN1通过编码一种新的致癌蛋白AXIN1-295aa来促进GC的发展。此外,最近的研究报告了一些circRNA作为蛋白质支架来影响两个或更多蛋白质之间的相互作用。然而,circRNA作为蛋白质支架的确切机制以及circRNA的这种功能如何影响肿瘤的发生和GC的进展仍不清楚。

1、数据库预测,获得目的circRNA
作者为了研究在GC中潜在的异常调节的circRNA,对5对GC和癌旁组织进行了高通量circRNA测序。共鉴定出478个调控异常的circRNA,表明这些circRNA可能参与了GC的发育。随后进一步分析了每对组织中circRNA的表达谱,以确定重叠的circRNA。circ_CEA(CircBase ID:HSA_CIRC_0051240)是唯一在所有五对GC组织中均显著上调的circRNA。因此,该circRNA被选中用于进一步研究。
2、circRNA表达研究
作者进一步检测了circ_CEA在GC组织中的表达水平。qPCR关于52例GC和相应的癌旁组织分析表明,circ_CEA在GC中显著上调。利用GSE152309的基因表达总集(GEO)数据库中的RNA-seq数据对circ_CEA和CEA之间的表达相关性进行了分析。结果显示,在10例胃组织中,circ_CEA与CEA呈正相关。综上所述,circ_CEA可能是影响GC总生存率的不良预后因素。此外,FISH结果显示,circ_CEA定位于细胞中的核和胞浆。

图1. circ_CEA在胃癌组织和细胞系中表达上调
3、circRNA表型研究
为了研究circ_CEA在应激诱导的细胞凋亡中的作用,将过表达和敲低circ_CEA的AGS细胞置于血清饥饿中72小时,然后用Annexin V/PI染色通过流式细胞仪检测细胞凋亡。敲低circ_CEA可增加血清饥饿诱导的早期细胞凋亡,circ_CEA过表达则有相反的结果。
4、circ_CEA与P53和CDK1蛋白相互作用
在这些蛋白中,与P53信号通路相关的P53和CDK1引起了人们的关注。P53在各种应激刺激下被激活,并通过诱导细胞凋亡而起到抑制肿瘤的作用。为了进一步证实circ_CEA是否与p53和CDK1蛋白相互作用,在293T和AGS细胞中进行了RIP检测。作者还研究了circ_CEA和FOXO_3之间的相互作用,FOXO_3是参与细胞应激反应和细胞凋亡的重要转录因子。在有或不有circ_CEA过表达的293T细胞中,抗P53抗体共沉淀了circ_CEA。在转染circ_CEA表达载体的293T细胞中,抗CDK1或FOXO_3抗体也可共沉淀。与293T细胞的研究结果一致,在转circ_CEA表达载体的AGS细胞中,抗P53、CDK1和FOXO_3抗体共沉淀了circ_CEA。进一步,利用生物素标记的针对circ_CEA连接位点的寡核苷酸探针,对293T细胞进行了CIRCCEA表达载体的RNA下拉检测。与对照探针相比,circ_CEA探针沉淀了更高水平的p-p53 ser315、p53、CDK1和FOX03蛋白。CDK1是Ser/Thr蛋白激酶家族中的一员,已被报道在Ser315处介导P53的磷酸化。进一步,用circ_CEA探针和抗P53抗体在AGS细胞中进行FISH分析,证实了circ_CEA和P53的共存。这些结果表明,circ_CEA与P53、CDK1和FOXO_3蛋白相互作用。
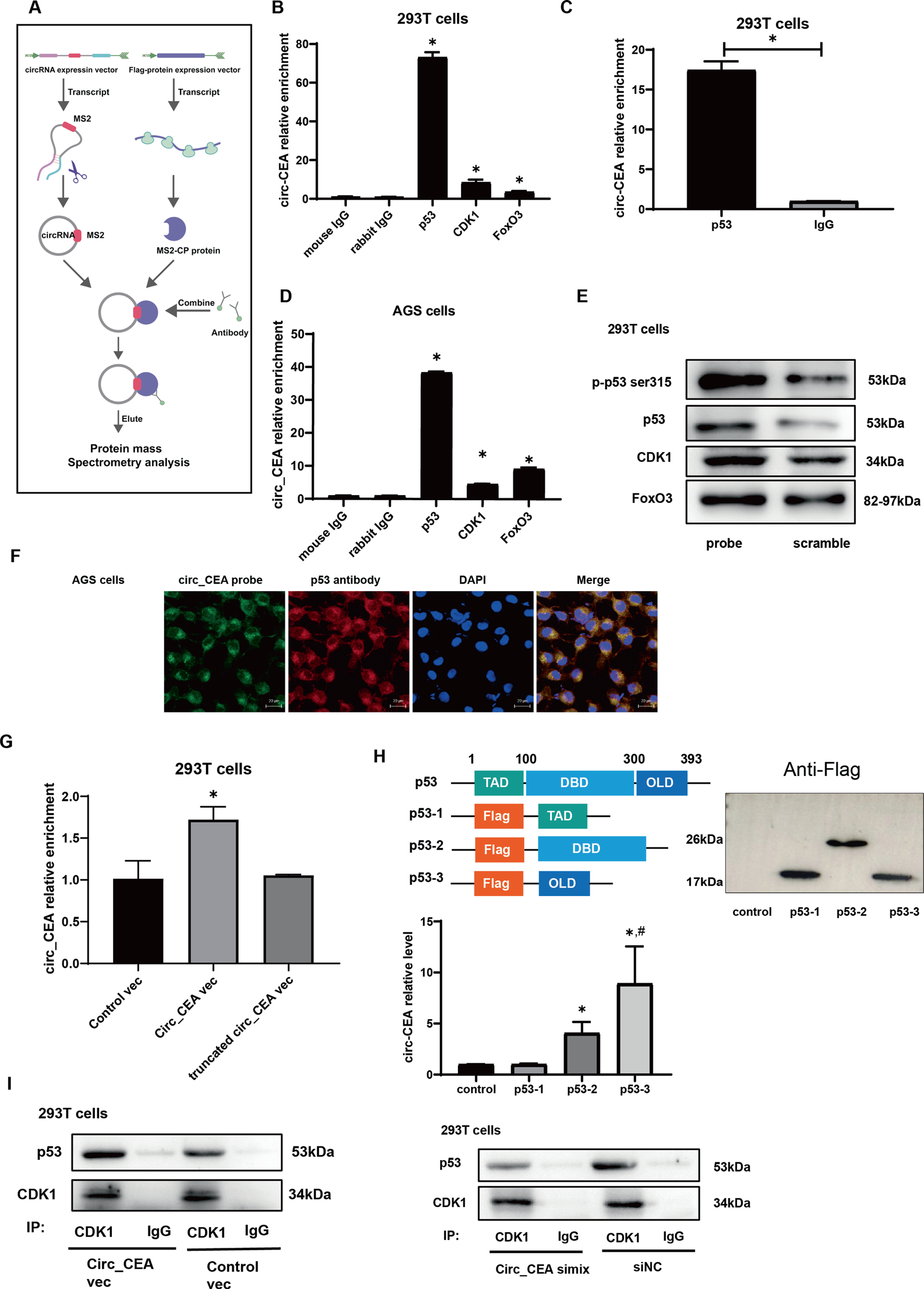
图2.circ_CEA抑制应激诱导GC细胞凋亡的机制探讨
5、circ_CEA促进CDK1介导的P53在Ser315位的磷酸化并抑制P53在胃癌中的活性
6、下调circ_CEA抑制体内肿瘤生长并促进细胞凋亡与胃癌肺转移的实验研究
qPCR分析证实,circ_CEA siRNA注射后,circ_CEA在体内的表达明显受到抑制。接下来,TUNEL分析显示,单独给予circ_CEA siRNA或Dox诱导皮下移植瘤中等程度的凋亡,而联合给予进一步促进凋亡。qPCR分析显示,circ_CEA Simix诱导P53促凋亡靶基因noxA、Puma、Fas、Bax和FOX03靶基因Bim显著上调。提示circ_CEA基因敲低可抑制肿瘤生长,促进细胞凋亡,其机制可能与体内调控P53靶基因表达有关。
与对照组相比,Dox或circ_CEA Simix单独给药显著减少了肺部转移灶,而联合给药对肺转移的抑制作用明显更大。此外,服用Dox或Dox+Simix的小鼠体重明显低于对照组或circ_CEA Simix组。对照组和circ_CEA Simix组小鼠体重无显著差异,表明circ_CEA Simix给药没有引起严重的副作用。在治疗癌症患者时,化疗毒性是一个主要问题。化疗药物与circ_CEA siRNA联合治疗可降低毒副作用,提高疗效。研究结果表明,circ_CEA下调可减少体内肺转移。联合应用circ_CEA、siRNA和Dox对肿瘤转移有协同抑制作用。
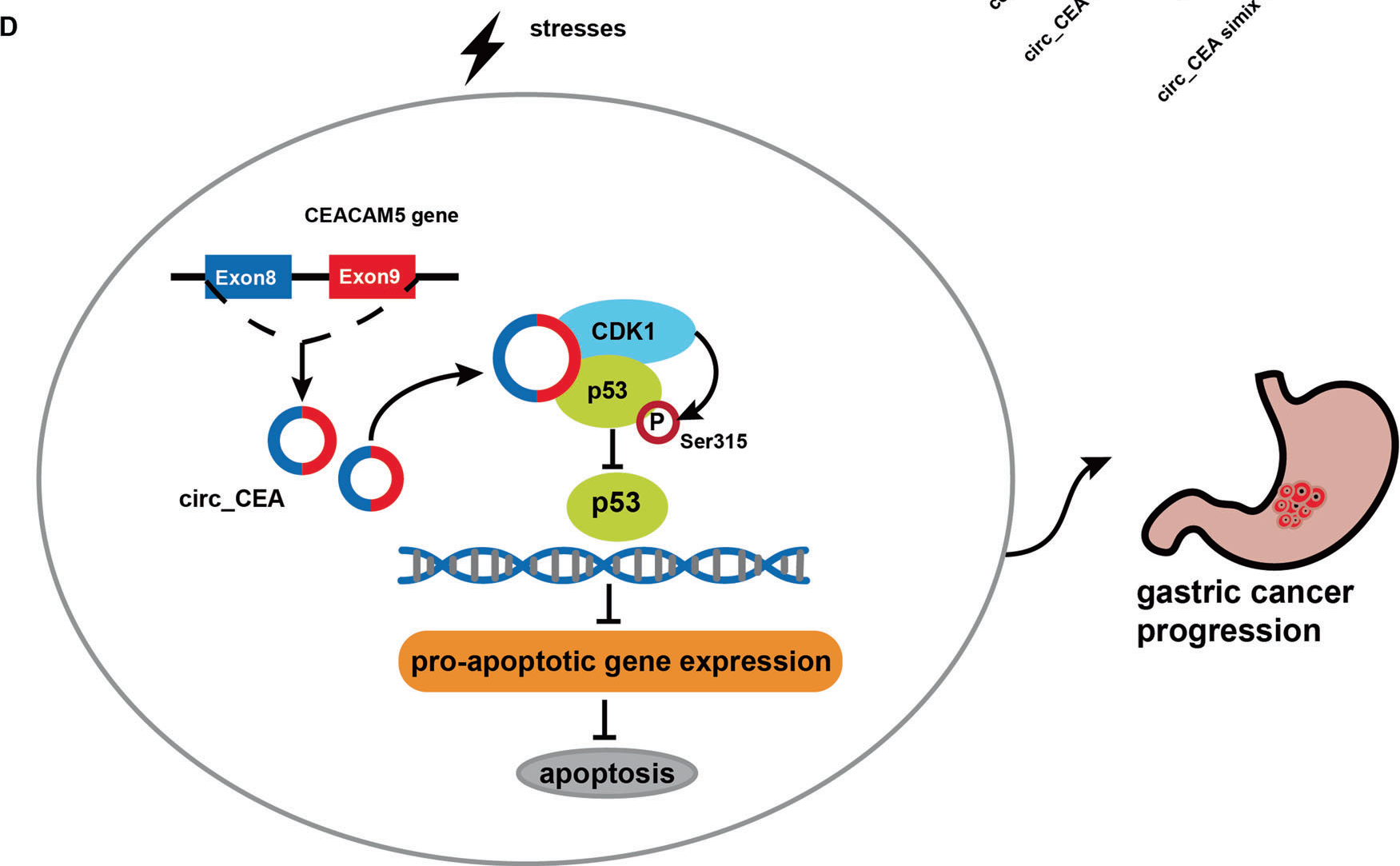
图3.circ_CEA抑制应激诱导GC细胞凋亡的机制
https://www.nature.com/articles/s41419-022-05254-1
参考文献:
[1]Rawla P, Barsouk A. Epidemiology of gastric cancer: global trends, risk factors and prevention. Prz Gastroenterol. 2019;14:26–38
[2]Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394–424.
转载请联系邮箱授权:circRNA@163.com
.png)
