
宫颈癌细胞中诱导TGF-β后,CDR1的表达显著上调
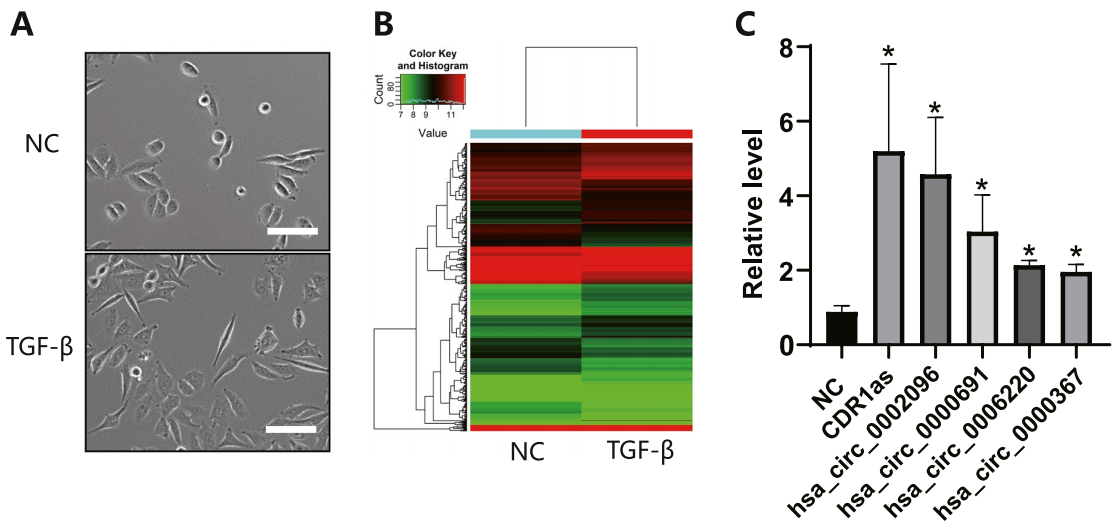 图1 TGF-β诱导子宫颈癌细胞的EMT
图1 TGF-β诱导子宫颈癌细胞的EMTCDR1预示着淋巴结转移和更差的总生存率
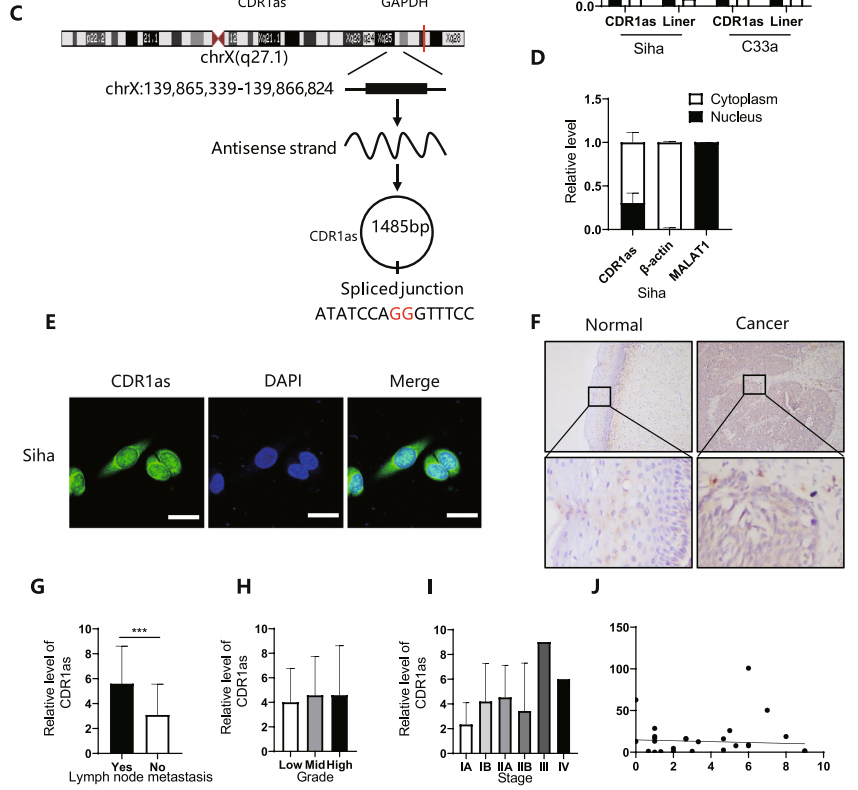 图2 CDR1预示淋巴结转移和总生存期差
图2 CDR1预示淋巴结转移和总生存期差 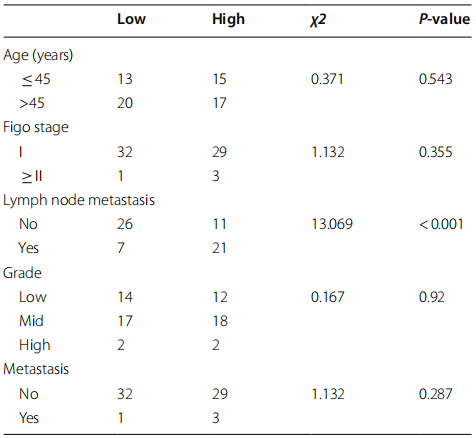
CDR1as可能促进子宫颈癌细胞的转移
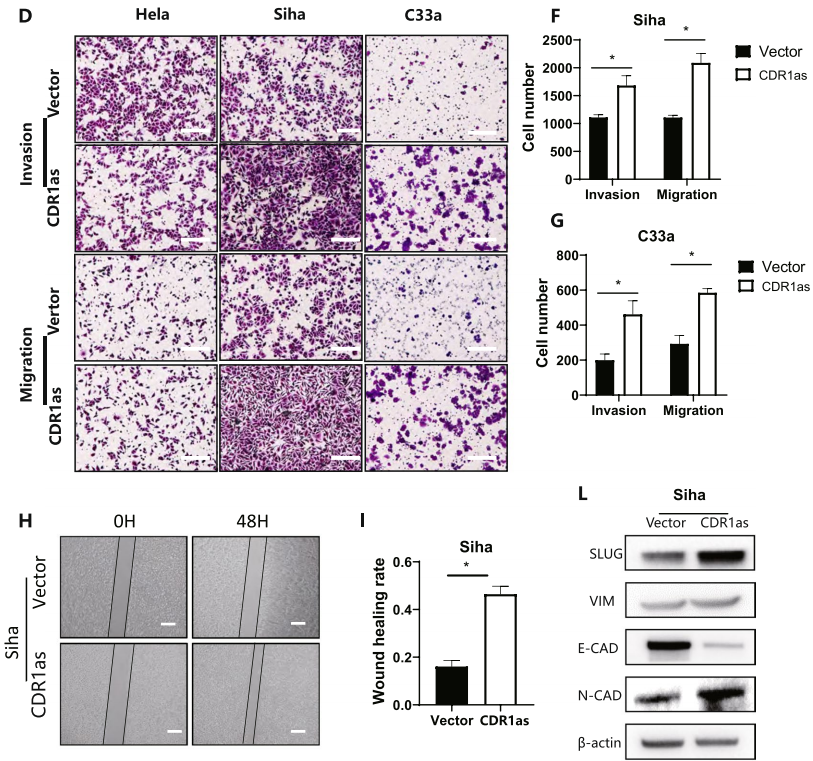
CDR1通过与IGF2BP1结合促进子宫颈癌细胞的EMT
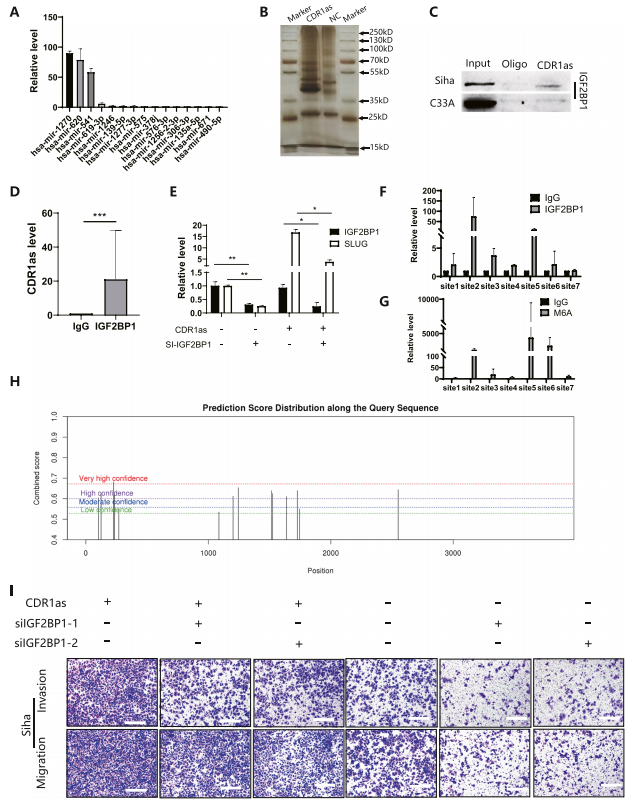
TGFβ信号可能通过子宫颈癌细胞中的CDR1as和m6A激活EMT
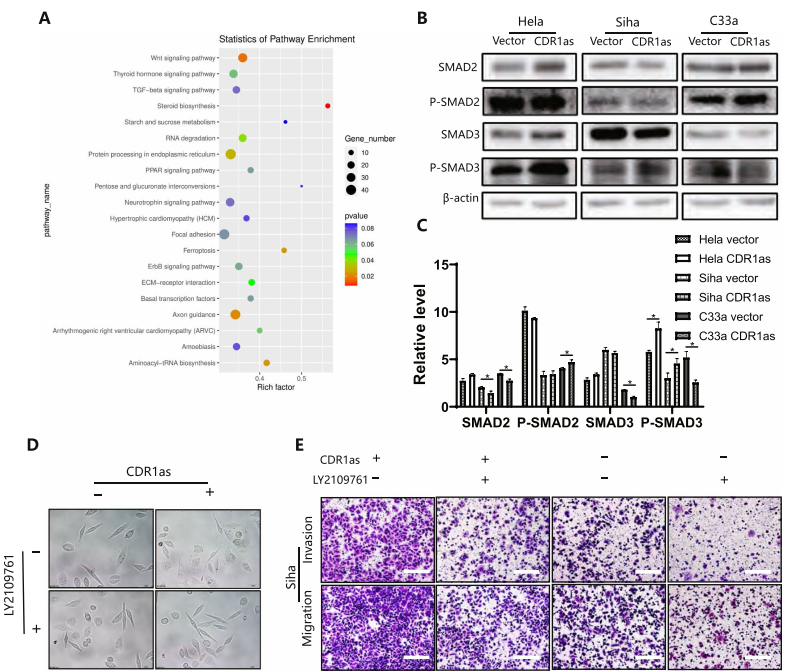
研究表明,N6-甲基腺苷参与RNA代谢的几乎所有步骤,这是转录修饰的重要组成部分。结合CDR1作为功能和机制的初步验证,作者分析了CDR1as上调后的不同mRNA水平和m6A水平。KEGG和GO分析表明,CDR1显著激活了TGF-β的信号。过表达的CDR1显著激活了p-smad2和p-smad3。当过表达的CDR1细胞被LY2109761处理时,这些EMT表型都逆转到载体水平,这表明CDR1通过激活TGF-β信号促进EMT。过表达的CDR1细胞的细胞穿透的数量明显增加。这些结果表明,CDR1激活TGF-β信号通路和EMT促进宫颈癌细胞的转移。
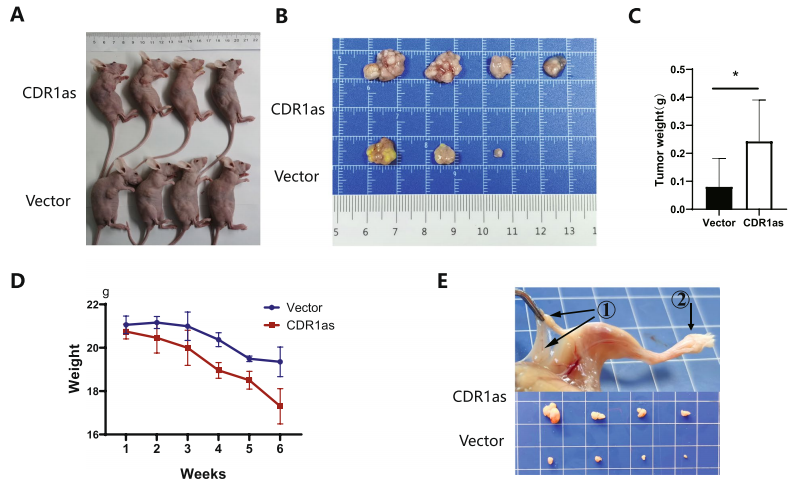
CDR1可促进体内子宫颈癌细胞的进展
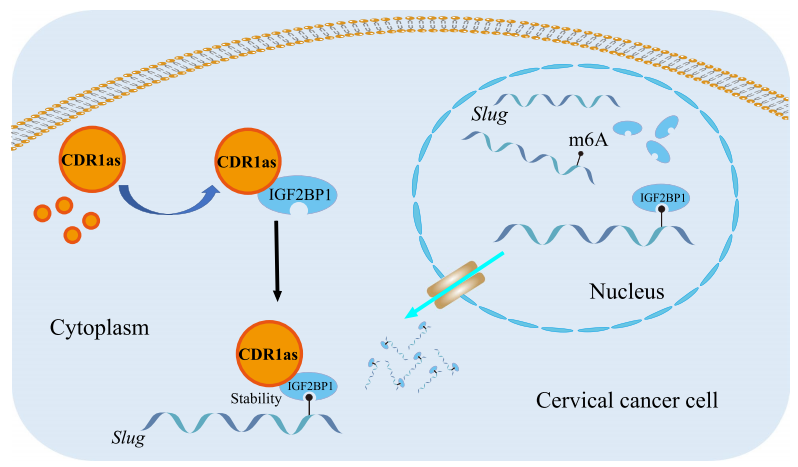
小结
大多数子宫颈癌的死亡可归因于转移,导致转移的机制尚未被完全渗透。作者对宫颈癌转移的相关机制进行研究。研究发现TGF-β的激活能促进CDR1的表达上调;CDR1as可以促进IGF2BP1对SLUG mRNA的调控,并稳定其不被降解;而沉默IGF2BP1会阻碍CDR1在宫颈癌中的相关转移。此外,也发现CDR1与淋巴结转移和生存时间缩短呈正相关,CDR1的过表达促进了宫颈癌的体内外转移。综上所述,CDR1as通过与IGF2BP1/SLUG mRNA作用激活TGF-β信号传导和EMT,促进宫颈癌转移,这也预示了治疗宫颈癌的潜在治疗靶标。


.png)
