circRNA可能作为免疫系统的调节作用已被很多文献报道。由于其共价闭环结构和没有5‘帽或3’polyA尾巴、比线性RNA更稳定,且可通过细胞外囊泡从细胞中释放出来。这些特征可作为诊断和预后生物标志物,应用于临床实践,从而越来越引起了人们的关注。
最近,作为疫苗的候选者,circRNA开发成的疫苗被证明可以在非人类灵长类动物中诱导对SARS-CoV-2的广谱保护[1]。然而,circRNA在体内识别、翻译和激活信号导致保护性免疫的机制目前尚不清楚。

circRNA与可溶性蛋白结合可在多种免疫途径中作为优秀的疫苗佐剂
体外合成circRNA和鸡卵清蛋白(称为OVAp)通过三种递送策略(皮下、鼻内和静脉注射)免疫C57BL/6小鼠,另外加以阳性对照(AddaVax,皮下佐剂)辅助验证,在第7天和第30天测量了脾脏、引流淋巴结(LNs)和肺部T细胞和抗体反应的大小。结果发现,circRNA+OVAp无论是哪种免疫途径均能诱导强烈的T细胞反应,并效果优于阳性对照。免疫后的抗体检测发现,所有给药途径中观察到血清中抗ovaIgG抗体的水平相似。此外,比较circRNA和Poly(I:C)作为鼻内佐剂的免疫效果发现,circRNA和Poly(I:C)诱导肺部抗原特异性CD8 T细胞的频率相当。综上所述,研究结果表明,circRNA可作为一种有效的疫苗佐剂用于多种免疫途径,并可媲美Poly(I:C)和AddaVax的免疫应答。
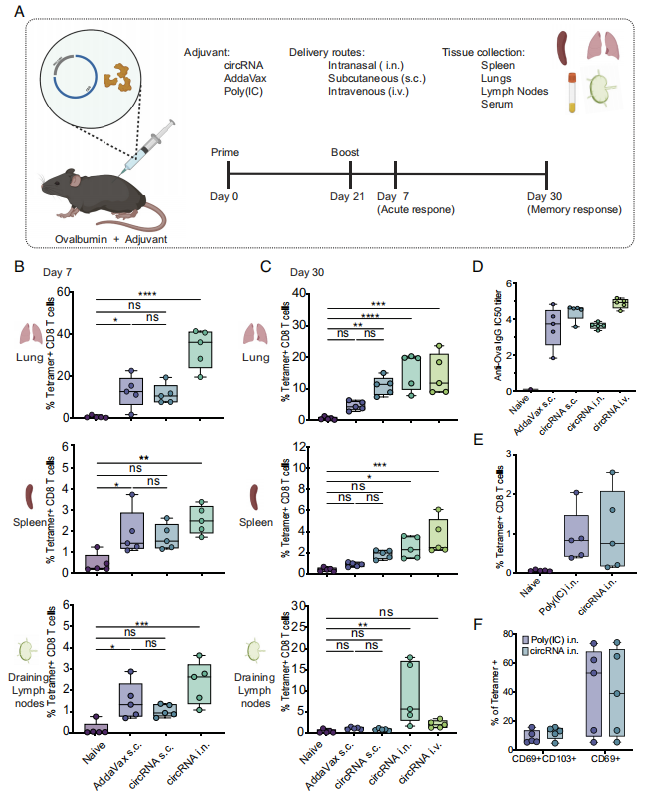
图1 circRNA对不同给药途径的辅助作用
circRNA注射到小鼠体内时,可激活先天免疫细胞,并诱导树突状细胞的免疫激活
首先确定了circRNA在体内传递时的生物分布。在circRNA免疫前后,用Luminex先天细胞因子面板分析血清。将circRNA偶联到荧光团AF488上,并皮下注射(s.c.)AF488-circRNA到C57BL/6小鼠。免疫24小时后,通过流式细胞术分析引流腹股沟淋巴结(iLNs)中的先天免疫细胞亚群。结果发现,circRNA在单核细胞、树突状细胞和一些巨噬细胞亚群中被检测到。巨噬细胞亚群包括边缘脊髓巨噬细胞(MCMs)、边缘窦巨噬细胞(MSMs)和囊膜下窦巨噬细胞(SSM),其中circRNA显著富集于MCMs和MSMs。尽管小鼠中B细胞没有检测到circRNA,但B细胞频率显著增加,CD86上调检测B细胞激活也增加,并且单核细胞的频率和激活显著增加,所有巨噬细胞和树突状细胞亚群的激活也显著增加,血清中的炎症免疫因子对circRNA免疫的反应也较为强烈。综上所述,circRNA注射到小鼠体内时,诱导几种先天免疫细胞激活,同时诱导炎症细胞因子产生强烈反应。
树突状细胞(DCs)是最有效的抗原呈递细胞,负责抗原加工和呈递、迁移和T细胞共刺激。作者发现,circRNA可诱导树突状细胞的成熟,从而增加了共刺激分子的表达和多种炎症细胞因子和趋化因子的分泌。
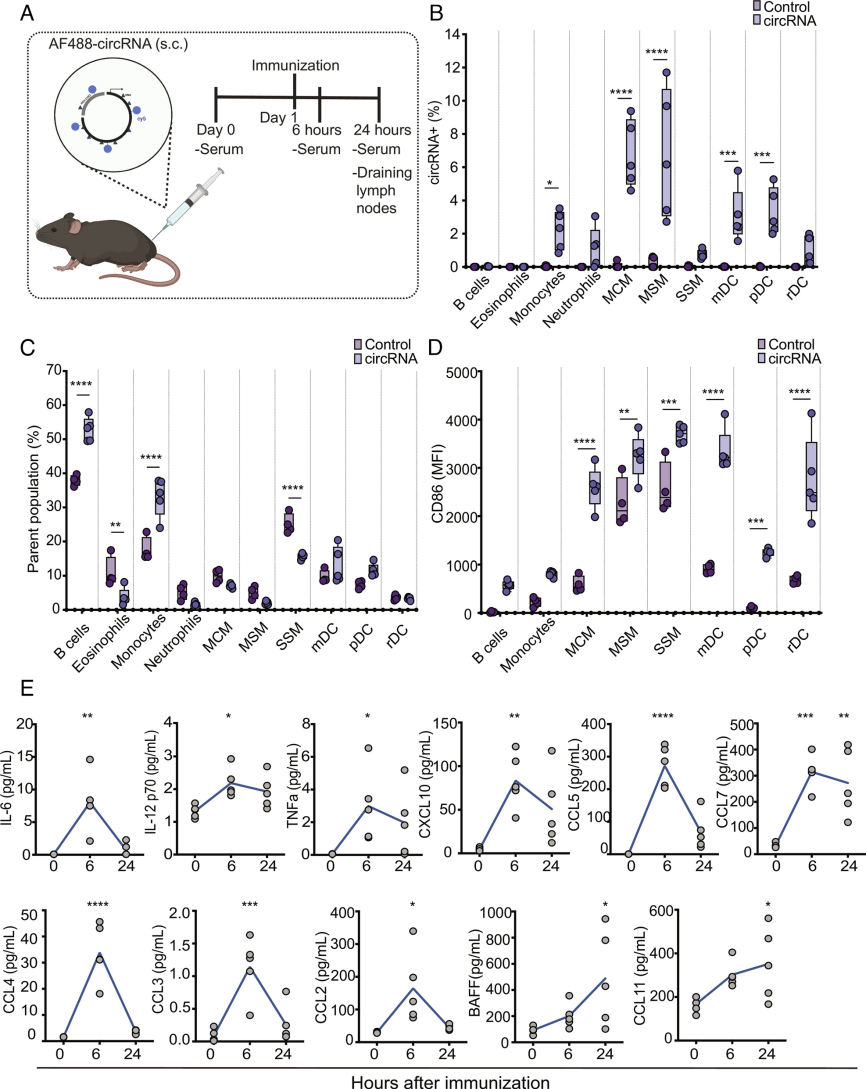
图2 circRNA的生物分布和先天免疫识别
CART传递工程circRNA改善蛋白编码从而呈递抗原
作者使用优化的元件来进行circRNA(编码circRNA的鸡卵清蛋白-circOVA)的设计和转录,从而为了使得circRNA翻译效果超过mRNA。体外细胞实验表示,circOVA具有翻译能力。
作者使用CART递送circRNA,这是一种合成的可降解材料,可以在细胞内复杂、保护和高效地递送mRNA和circRNA,从而导致高效的蛋白质翻译。CART-circOVA转染结果表明,由circRNA编码的蛋白质可以被树突细胞加工并呈现给免疫系统。
随后作者单独用CART、circRNA或CART-circRNA免疫小鼠,结果发现CART传递的circRNA导致了先天免疫亚群的激活谱,这与之前观察到的circRNA相似。
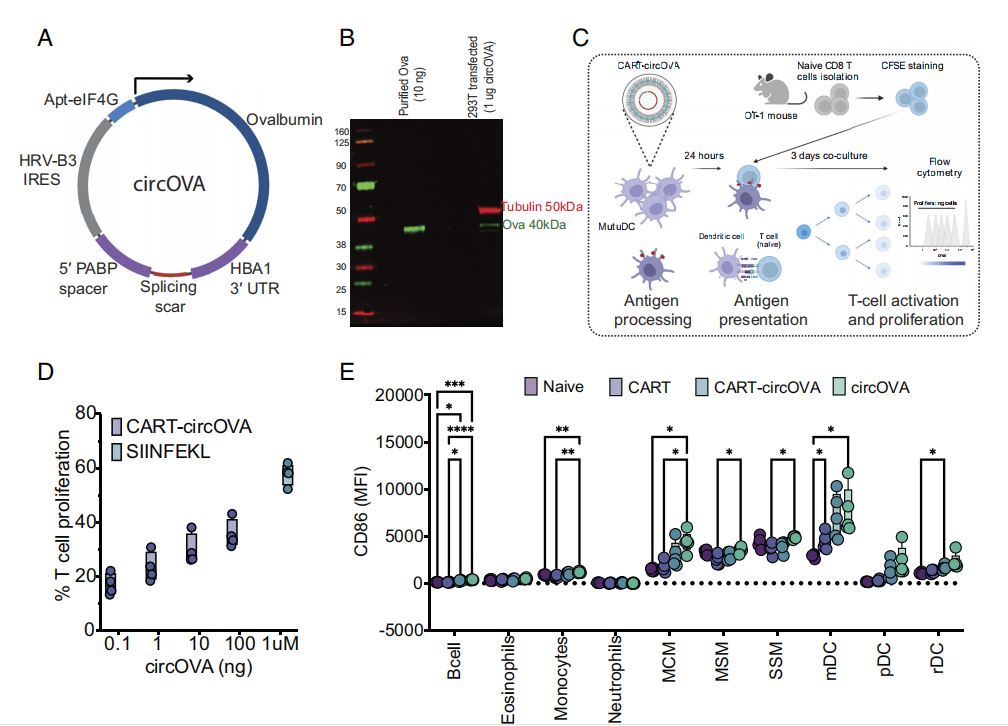 图3 circRNA被翻译并呈现给免疫系统
图3 circRNA被翻译并呈现给免疫系统
circRNA编码的抗原在体内诱导强烈的T细胞反应
接下来,作者试图确定circRNA和CART的组合是否可以推广到其他候选疫苗。流感病毒是突变最快的病毒之一,针对病毒保守位点(如核蛋白)的CD8 T细胞已被证明对异亚型流感感染具有保护作用。因此,作者构建了一个编码流感病毒(PR8株)核蛋白(NP)序列的circRNA,称为circNP。结果发现,circNP+CART(CART-circNP)腹腔注射后,在血液中诱导核蛋白特异性T细胞反应。结果表明,利用circRNA编码病原体来源的抗原序列可以有效地诱导抗原特异性CD8 T细胞应答。
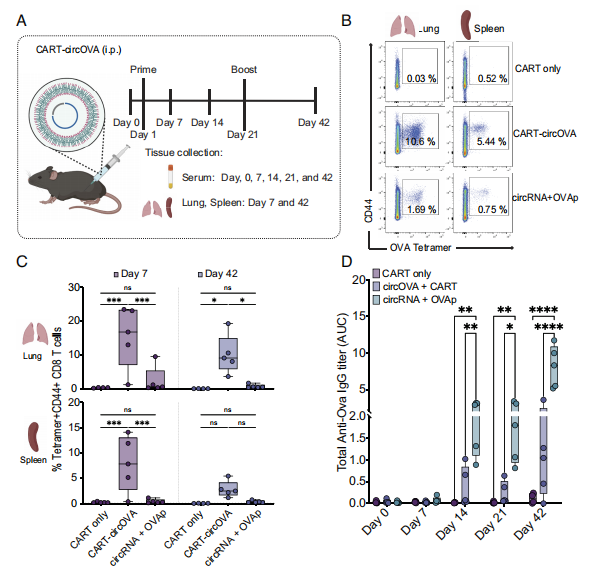
图4 体内circRNA传递激活T细胞特异性反应
circRNA疫苗可诱导抗肿瘤疗效
在小鼠治疗方案中作者测试了circRNA疫苗的抗肿瘤疗效。B16-F10-OVA黑色素瘤细胞接种在小鼠的背部皮下构建肿瘤模型,然后被随机分为两组:对照组(未治疗)和CART-circOVA(疫苗)组。与未治疗组相比,circRNA疫苗组具有明显的肿瘤生长抑制作用。结果表明,circRNA免疫可作为有效抑制肿瘤生长的免疫治疗策略。
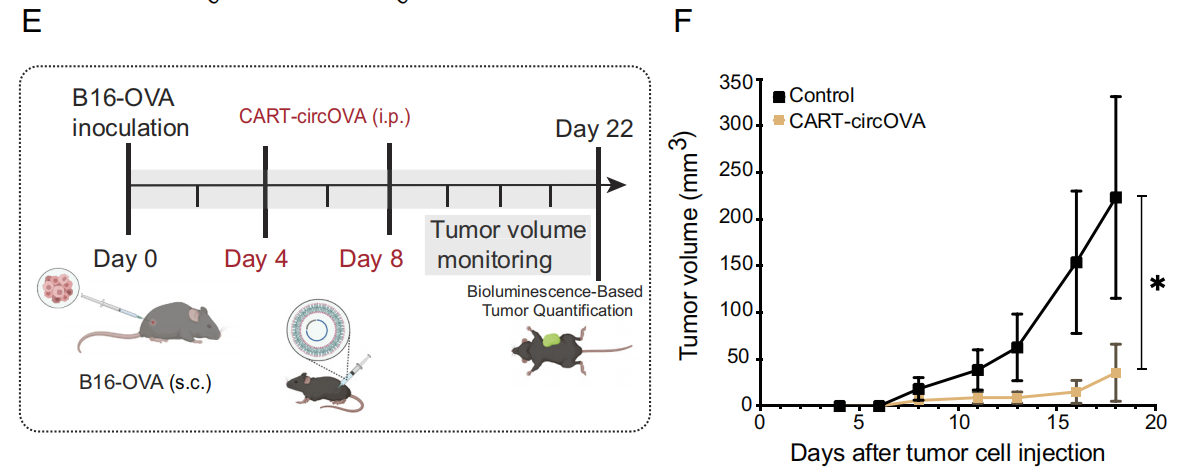
图5 circRNA疫苗可诱导抗肿瘤疗效
https://doi.org/10.1073/pnas.2302191120
参考文献:
1. L. Qu et al., Circular RNA vaccines against SARS-CoV-2 and emerging variants. Cell 185, 1728–1744.e16 (2022)

.png)
