环状RNA(circRNA)是一类非编码RNA,由前体mRNA反向剪接和选择性剪接形成的共价闭合的环型分子。circRNA具有miRNA和蛋白质海绵作用,进而间接调控下游靶基因的表达。此外,部分circRNA可以翻译成蛋白质或多肽来行使调控功能。越来越多研究表明,circRNA可以作为某些疾病的潜在生物标志物和治疗药物靶点。然而,circRNA在肌肉萎缩中的作用仍有待研究。

CircTmeff1在肌肉萎缩中上调
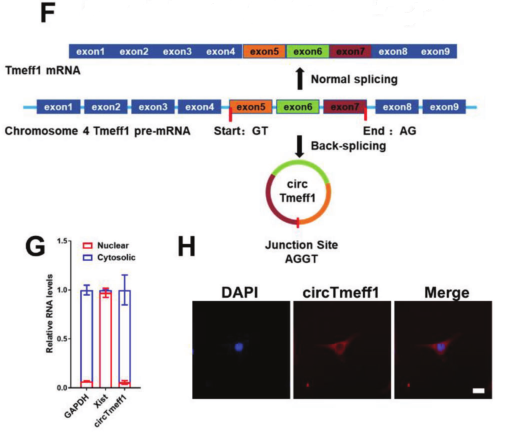
图1 CircTmeff1的结构和细胞定位
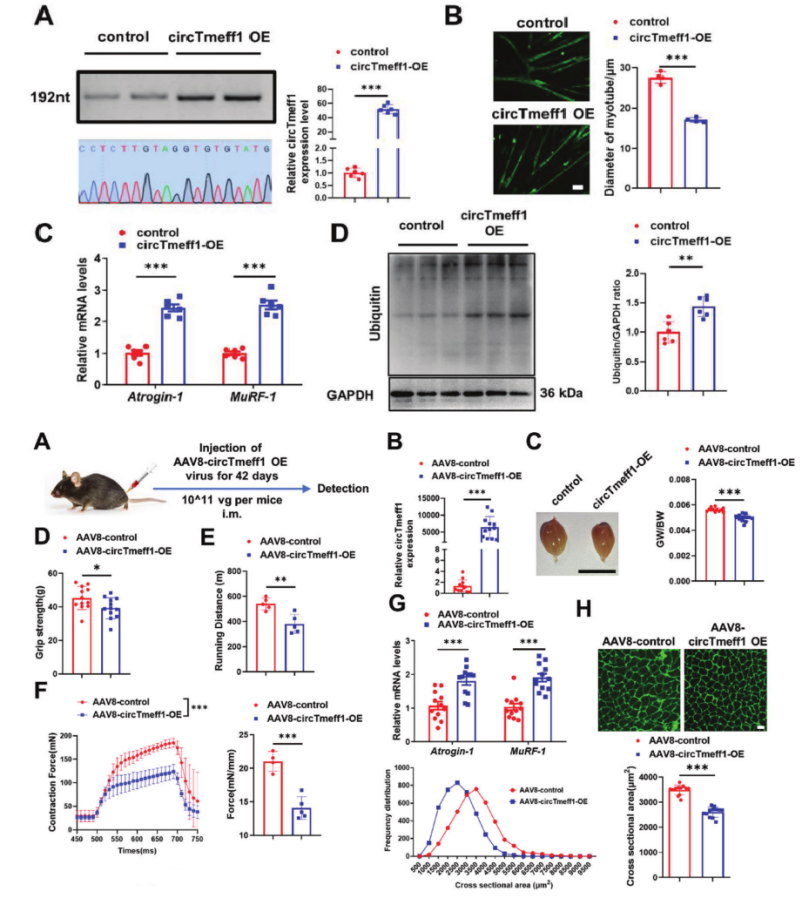
CircTmeff1在体外和体内均促进肌肉萎缩
免疫荧光结果显示,过表达circTmeff1降低了C2C12肌管的直径和面积。qRT-PCR分析显示,过表达circTmeff1使泛素蛋白连接酶E3s(Atrogin-1和MuRF-1)表达上调。通过Western-blot检测发现circTmeff1过表达会使UPS增强、ALP被激活、凋亡增强、PI3K/AKT合成代谢信号传导减少。接着,作者运用了AAV8载体介导circTmeff1过表达,再将病毒颗粒注射进小鼠的多处肌肉并在6周后评估其肌肉萎缩情况,发现过表达的circTmeff1会导致肌肉重量和肌肉功能受损。同时,当circTmeff1在GA肌肉中过表达时,蛋白质分解途径(UPS、ALP和细胞凋亡)被激活,AKT/FOXO3A/mTOR信号通路受到抑制。总的来说,circTmeff1在肌肉中的过表达足以诱导肌肉萎缩。
图2 CircTmeff1在体内和体外均促进肌肉萎缩
抑制CircTmeff1的表达可以缓解肌肉萎缩
免疫荧光和qRT-PCR结果显示,利用siRNA将circTmeff1敲低后,抑制了C2C12肌管直径的减小,Atrogin-1和MuRF-1的表达量增加。分别在Imo和AngII诱导的肌肉萎缩模型中,进一步利用AAV8介导的circTmeff1 shRNA进行干扰,发现敲低circTmeff1后均增强了肌肉质量,减少了Atrogin-1和MuRF-1的表达,增加了肌纤维的CSA,并重新激活了AKT/FOXO3A/mTOR信号通路,缓解了肌肉萎缩。为了模拟临床试验,作者在SWI肌肉萎缩模型中进行测试,发现AAV8-sh-circTmeff1疗法circTmeff1敲低可以恢复SWI小鼠的握力、运动耐力和强直收缩功能。总之,抑制circTmeff1显著减轻了肌肉萎缩。
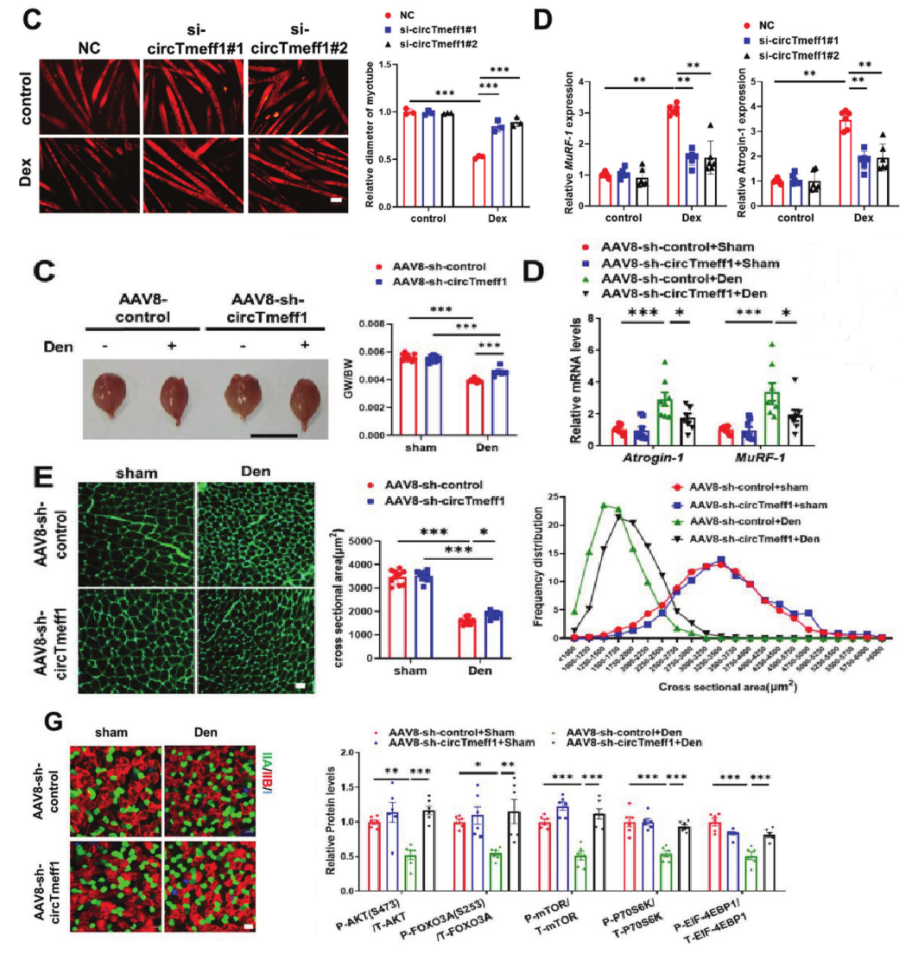
图3 CircTmeff1被敲低后可以缓解肌肉萎缩
CircTmeff1与TDP-43蛋白相互作用
为了探索circTmeff1促进肌肉萎缩的分子机制,作者首先使用RBPsuite分析了与之结合的蛋白,并通过RNA pull-down实验发现circTmeff1可以特异性结合TDP-43,而且运用RIP技术证实了TDP-43和circTmeff1之间存在相互作用。接着,作者通过共聚焦免疫荧光分析TDP-43和线粒体在C2C12细胞中的共定位情况,发现circTmeff1可以促进TDP-43聚集在线粒体中,而且细胞溶胶-线粒体分离实验结果也证实了这一点。此外,在注射AAV8-circTmeff1-OE的小鼠腓肠肌细胞中也观察到相同的结果。通过qRT-PCR检测mtCOI,发现circTmeff1促进了mtDNA在胞质溶胶中积累。接着,作者用Western-blot实验证实过表达circTmeff1会激活cGAS/STING通路。综上表明,circTmeff1在线粒体中募集TDP-43从而形成聚集体,触发线粒体DNA释放到胞质溶胶中,并最终激活肌肉细胞中的cGAS/STING途径。
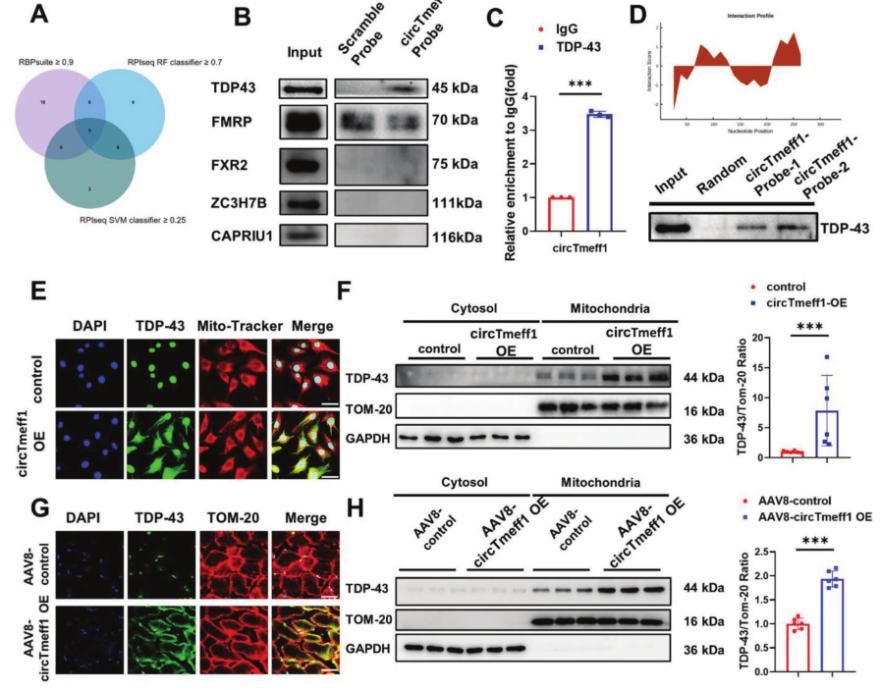
图4 CircTmeff1与TDP-43蛋白相互作用
CircTmeff1编码一种新蛋白质——TMEFF1-339aa蛋白及其促进肌肉萎缩的作用
为了验证circTmeff1的ORF是否可以在体内滚环翻译成339aa蛋白,作者构建了3×Flag-circTmeffl载体使其过表达,通过Western-blot检测到新蛋白在38kDa附近,进一步运用LC-MS检测并鉴定出新蛋白为TMEFF1-339aa。接着,作者构建了一个具有3×Flag的TMEFF1-399Aa线性全长序列的过表达载体,转染到C2C12细胞中并进行免疫荧光分析,发现TMEFF1-339aa位于细胞质中。此外,TMEFF1-339aa在C2C12肌管细胞中过表达可减小肌管直径,促进Atrogin-1和MuRF-1的表达,激活UPS和ALP,并抑制AKT/FOXO3A/mTOR信号通路。综上表明,过表达TMEFF1-339aa能在体外促进肌肉萎缩。
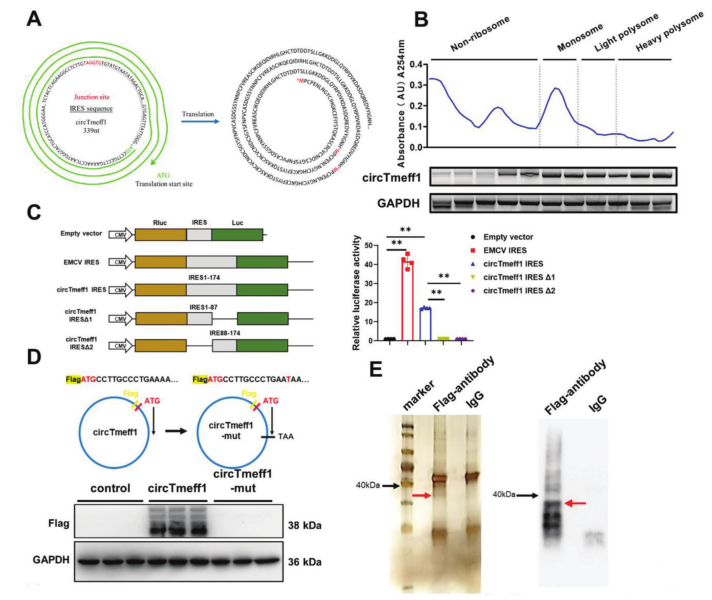
图5 CircTmeff1编码的TMEFF1-339aa蛋白在体内促进肌肉萎缩

.png)